

В базе OPM осуществлялся поиск по трансмембранным белкам, имеющим в структуре β-бочонок. Выбор пал на пилотин-секретиновый комплекс (AspS-GspD complex) (очень красивая структура). Этот комплекс грамотрицательных бактерий находится во внешней мембране и участвует в транспорте белков во внешнюю среду. Как следует из названия, в его состав входят белки пилотин и секретин, и именно последний имеет трансмембранные участки. Пилотин, в свою очередь, важен для направления и локализации секретина во внешней мембране. Интересно, что β-бочонок получается не из одной молекулой секретина, а нескольких так, что эта структура сформирована 15 субъединицами. В каждой субъединице 4 трансмембранных участка с координатами: 1 (340-345), 2 (349-354), 3 (408-415), 4 (418-426) — то есть на трасмембранный участок приходится 6, 8 аминокислотных остатков. Также в OPM указана толщина гидрофобной части — 20,6 Å. Такое значение при измерении в Jmol у меня получилось, как расстояние между слоями мембраны.
| PDB | 5ZDH |
|---|---|
| Тип | Трансмембранный |
| Класс | Трансмембранный β-бочонок |
| Суперсемейство | Секретин внешней мембраны бактерий |
| Семейство | Секреция через внешнюю мембрану бактерий |
| Организм | Escherichia coli |
| Локализация | Внешняя мембрана грамотрицательных бактерий |
| Толщина гидрофобной части (Глубина) | 20.6 Å |
| Угол изгиба | 0° |
| Энергия Гиббса переноса | -206.2 ккал/моль |
| Топология | субъединица А (N-конец внутриклеточный) |


Для работы нам также был выдан α-спиральный белок (CRUF_HALJT, fasta). Его последовательность была загружена на сервис DeepTMHMM для предсказания трансмембранных участков. Получили следующие результаты (текстовый вид):
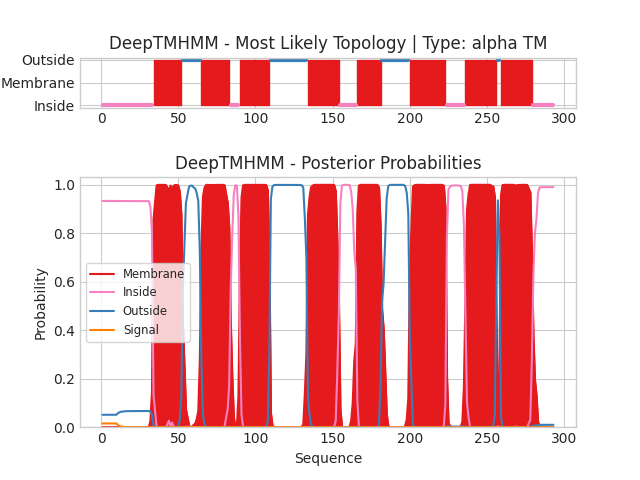
На горизонтальной оси отображен номер аминокислотного остатка, на вертикальной оси показано предсказание положения определённых участков (верхний график) и вероятность принадлежности конкретного остатка к той или иной топологии (нижний график). Цвета обозначают локализацию: Outside - вне клетки, Membrane - трансмембранный, Inside - внутри клетки, Signal - сигнал локализации. Для нашего белка было предсказано 8 трансмембранных α-спиралей. Оба конца белка согласно предсказанию являются внутриклеточными.
Такой же анализ был проведён и для β-листового белка. Результаты (текстовый формат):
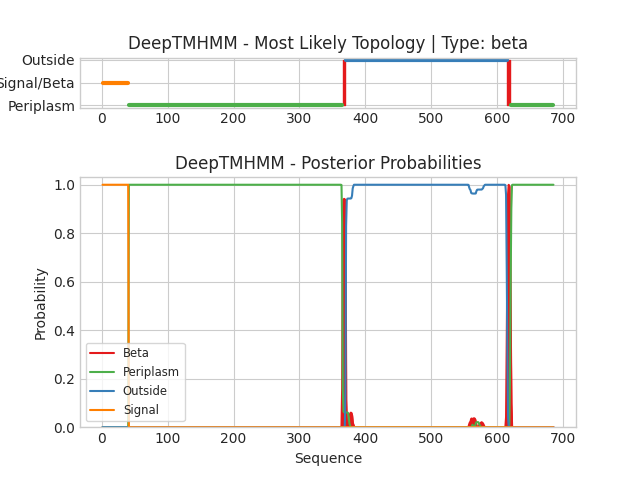
Обозначения в выдаче аналогичны. Цвета обозначают локализацию участка: Beta - бета-слой (мембранный), Periplasm - периплазматический (пространство между мембранами), Outside - внеклеточный, Signal - сигнал локализации. Для выбранного белка удалось предсказать всего 2 трансмембранных участка (в виде β-листов). Согласно предсказанию оба конца белка находятся с внутренней стороны. Таким образом, для этого белка предсказание получилось хуже. Возможно, сказалось наличие сигнальной последовательности, которая отсутствует в зрелом белке.
Получим предсказание о трансмембранных участках α-спирального белка (CRUF_HALJT) с помощью сервиса PPM версии 3.0. Количество мембран - 1. Так как Haloarcula japonica является археей, выбран соответствующий тип мембраны. Согласно предыдущему заданию N-конец находится внутри клетки. Параметр про искривления выбран no.
На вход был дан файл, на выходе получен файл
| Толщина гидрофобной части (Глубина) | 29.0 ± 1.1 Å |
|---|---|
| Энергия Гиббса переноса | -54.6 ккал/моль |
| Угол изгиба | 17 ± 0° |
| Трансмембранные сегменты | 1 (32-53), 2 (64-80), 3 (88-108), 4 (133-151), 5 (161-187), 6 (202-223), 7 (238-258), 8 (259-273) |
| Средняя длина трансмембранного сегмента | 20 остатков |
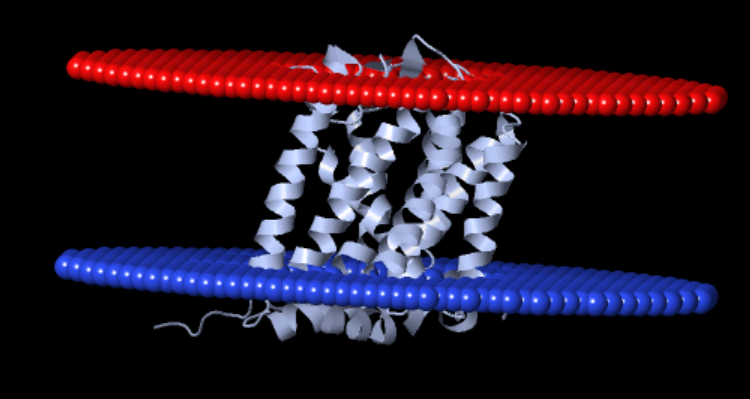
Сравнив результаты двух предсказаний для α-спирального белка, можно увидеть, что они значительно совпадают. Несмотря на отличие в пару аминокислотных остатках, общее число и положение спиралей совпадают. Думаю, на это повлияло и то, что в AplhaFold все основные спирали имели самый высокий доверительный score (pLDDT>90).