Практиум 3
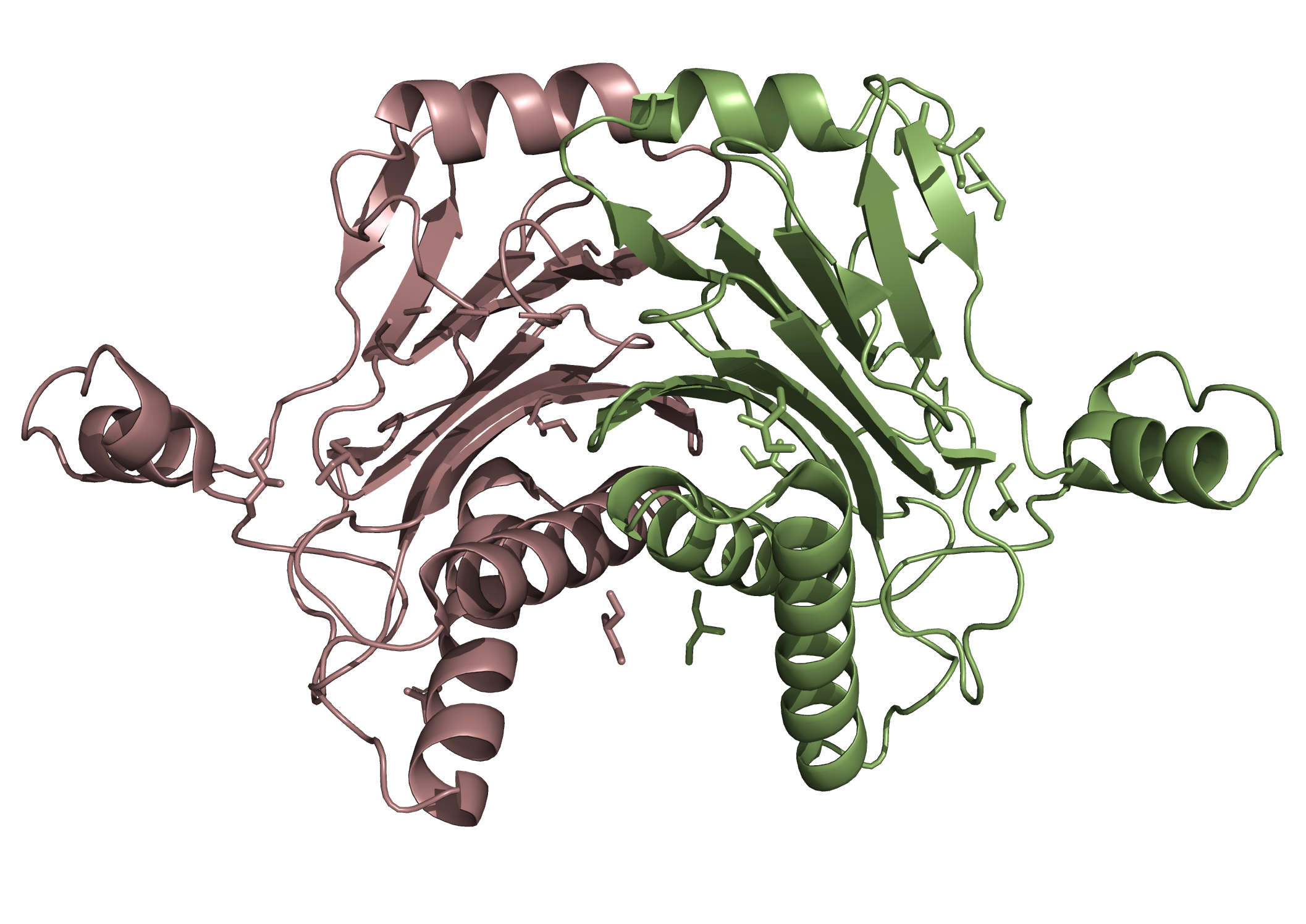
Структура в целом
Кристаллическая структура II стадии sporulation E Family Protein из Thermanaerovibrio acidaminovorans с pdb_id 3RNR является белком и представлена 1 уникальной полимерной цепью (но есть еще одна, гомологичная первой,цепь). В 1 биологическую еденицу входит 2 цепи (A, B).
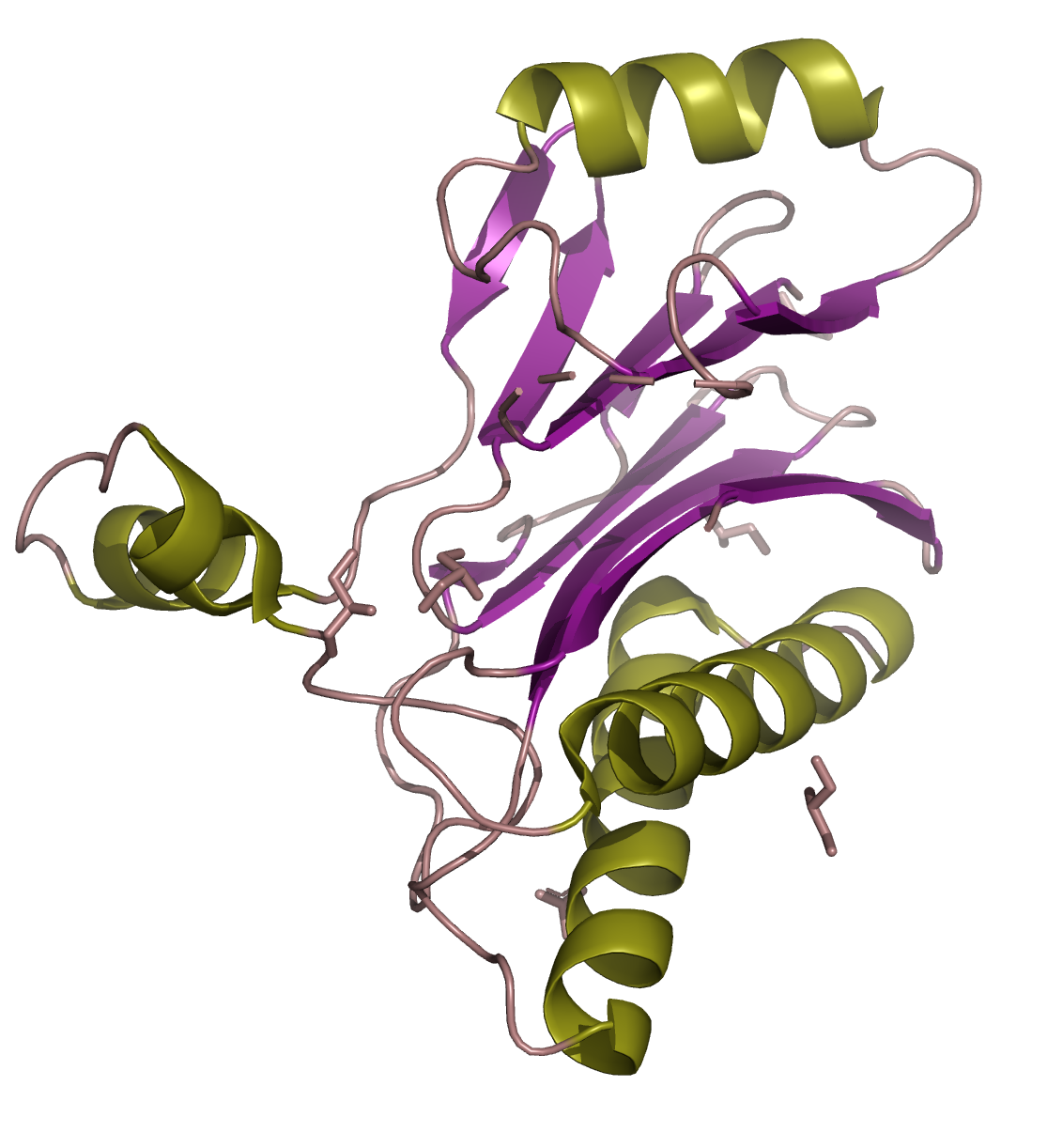
Отдельные цепи
Данная макромолекула отностся к организму Thermanaerovibrio acidaminovorans. Её uniprot_id D1B7C2, а полное название - Stage II sporulation E family protein. На данный момент описание функций отсуствуют, т.к. соответствующая статья находится в разработке.
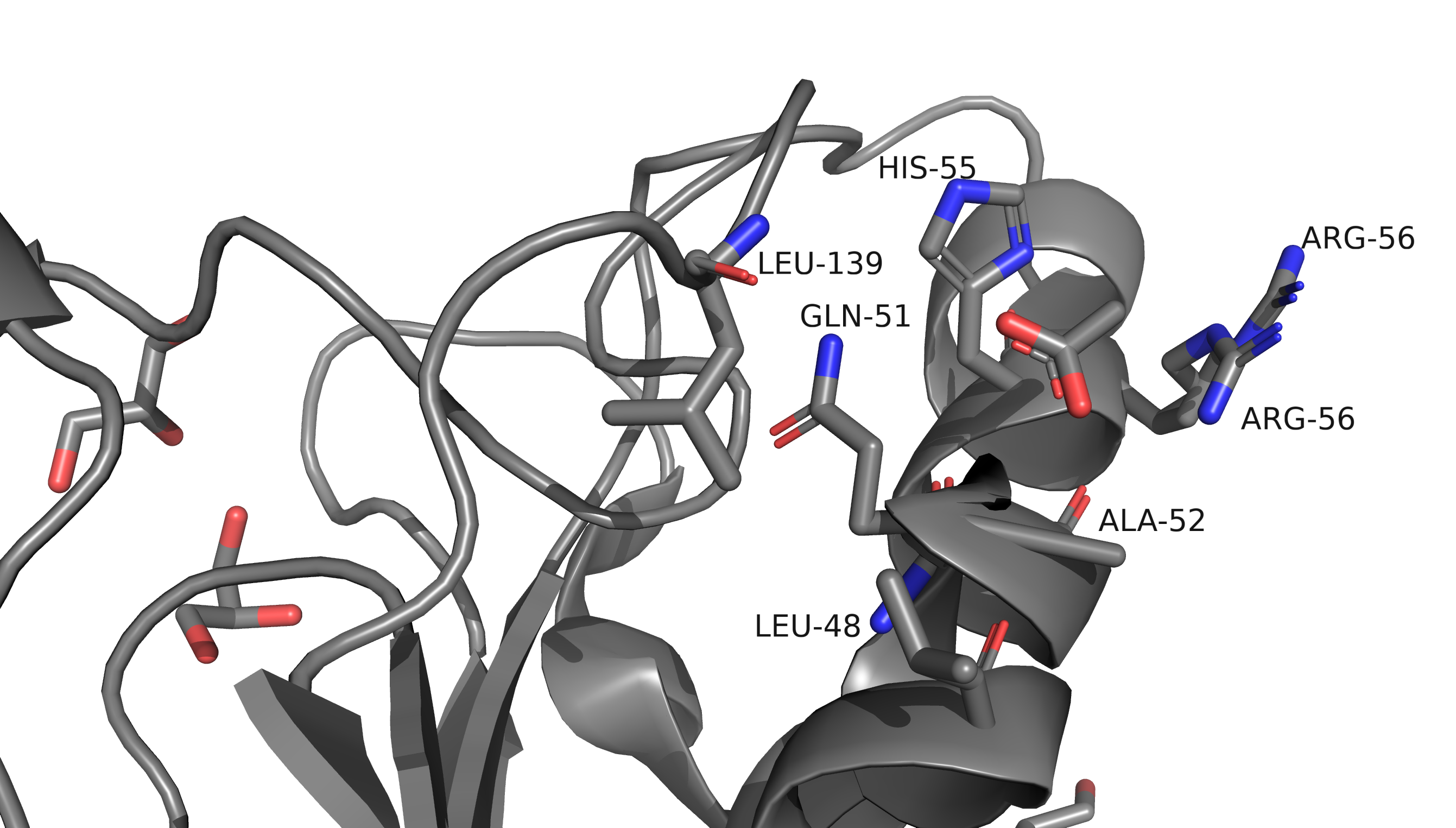
В Uniprot не было найдено информации относительно мутаций, но при просморе PDB файла были обнаружены мутации файл PDB . Также в сотсаве цепи были обнаружены модифицированные аминокислотные остатки файл PDB.
α-спирали = 10, β-тяжи = 30.
Малые молекулы
В записи присутствует 3 (4, если учитывать воду) вида малых макромолек:
1. PEDCQBHIVMGVHV-UHFFFAOYSA-N (GOL) - глицерин (C3 H8 O3) GOL,
2. LYCAIKOWRPUZTN-UHFFFAOYSA-N (EDO) - 1,2-этандиол (С2 H6 O2) EDO,
3. QTBSBXVTEAMEQO-UHFFFAOYSA-N (ACY) - уксусная кислота (C2 H4 O2) ACY,
4. Water (H2O) H2O.
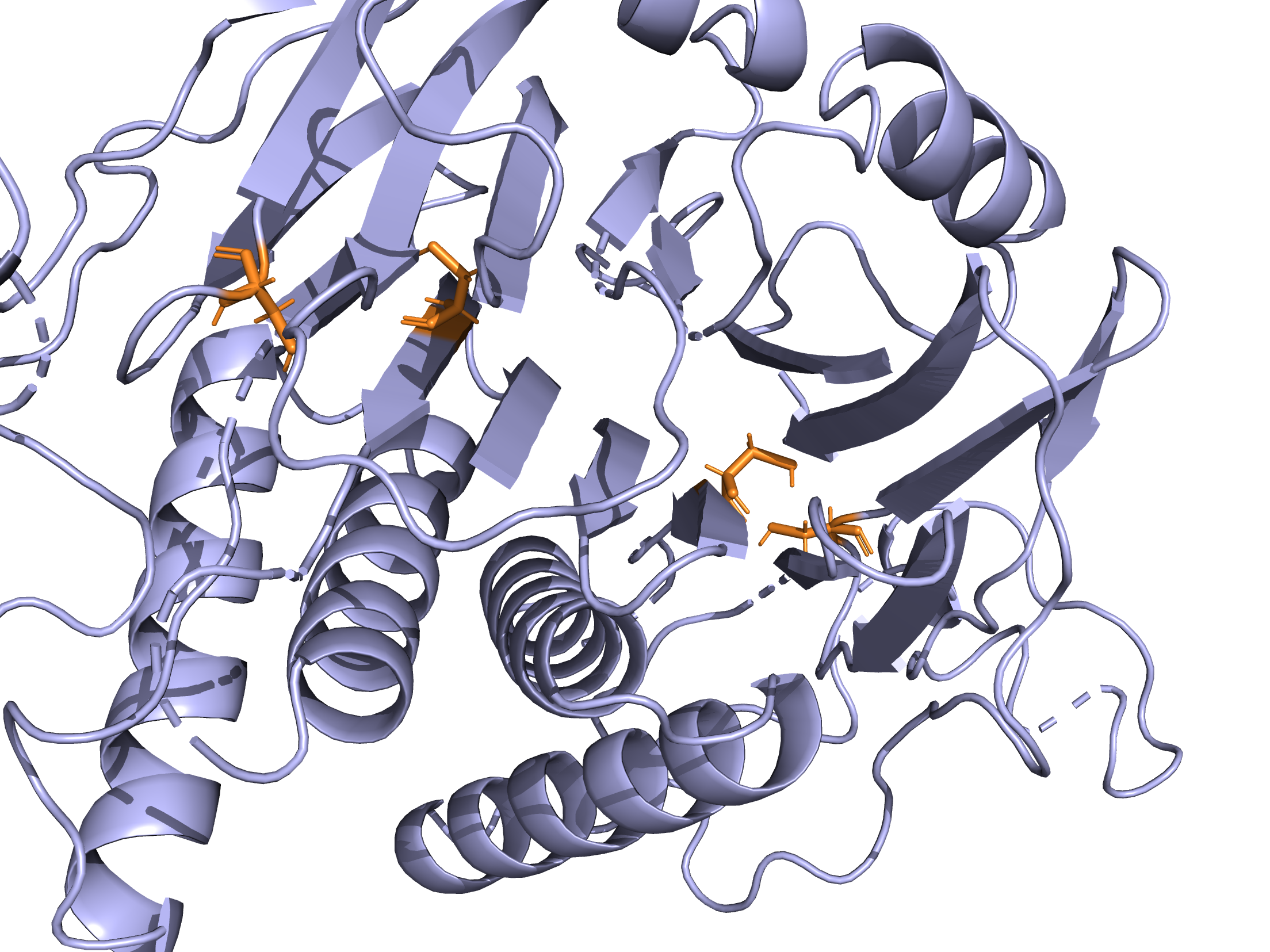
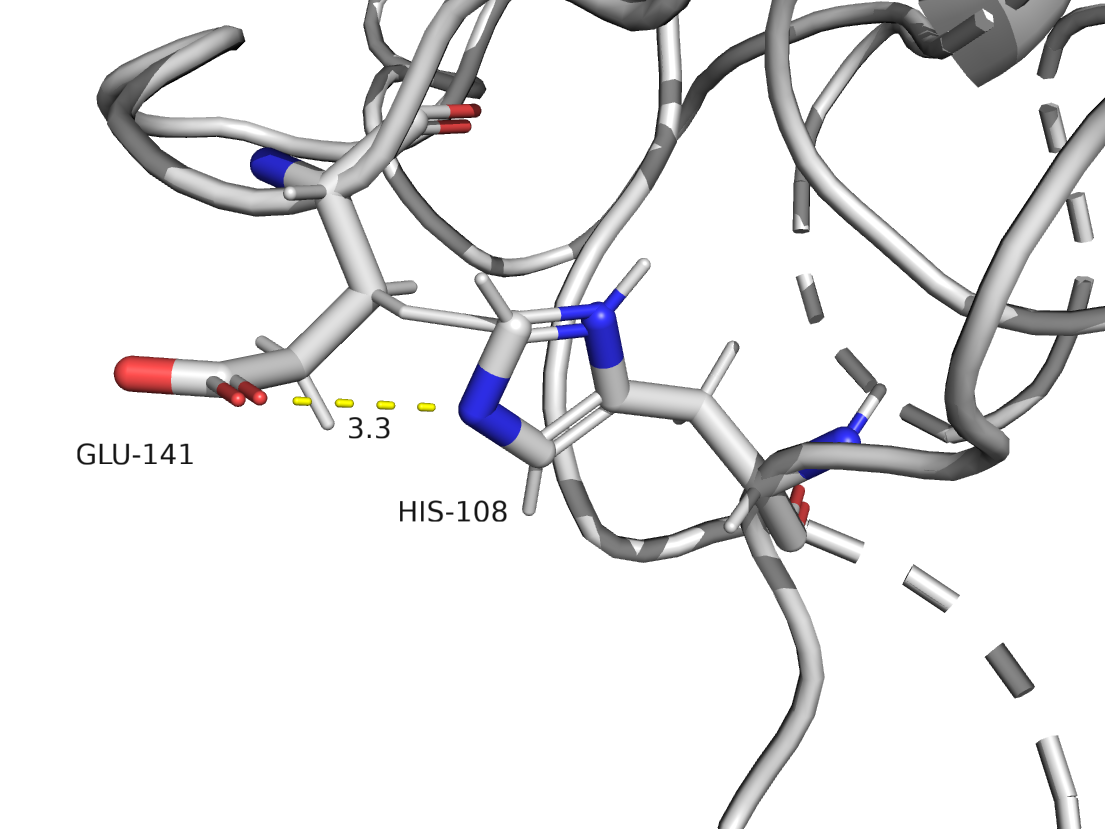
Взаимодействие между аминокислотными остатаками
В данной структуре присутсвуют следующие типы взаимодействий: водородные связи, солевые мостики, Т‑стекинги. Дисульфидных связей нет.
1.png)
.png)
.png)