
Главная страница > Третий семестр > Комплексы ДНК-белок
Целью задания было исследованик контактов между белком и нуклеиновой кислотой. С сайта PDB были скачаны необходимый файл и файл с биологической единицей. При рассмотрении файла PDB и файла с биологической единицей не было выявлено серьезных отличий в структуре (вот только количество молекул воды в файле PDB 409, а в файле с биологической единицей 484). Оба файла содержат комплекс ДНК-топоизомеразы I с молекулой ДНК длиной 22 нуклеотида. В дальнейших исследованиях комплекса будет использоваться файл с биологической единицей.
Для выполнения задания был использован скрипт. Ниже в таблице представлены различные типы контактов между белком и ДНК в комплексе 1A31. Следует заметить, что в таблице приведено число атомов домена Topoisom_I_N данного белка, контактирующие с ДНК.
| Контакты белка с ... |
|
|
|
| ... остатками 2'-дезоксирибозы |
|
|
|
| ... остатками фосфорной кислоты |
|
|
|
| ... остатками азотистых оснований со стороны большой бороздки |
|
|
|
| ... остатками азотистых оснований со стороны малой бороздки |
|
|
|
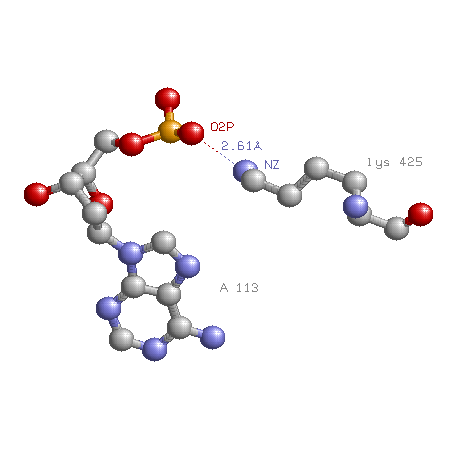
Мной был выбран полярный контакт атома кислорода остатка фосфорной кислоты с атомом азота лизина (LYS425A.NZ-A113D.O2P). Этот лизин принадлежит рассматриваему домену Topoisom_I_N. Полярные связи помогают этому домену надежно соединяться с молекулой ДНК на время реакции топоизомеризации. Подобную же связь образует tyr426.
В структуре ДНК-топоизомеразы существуют два домена, определяющие ее функцию:
Topoisom_I_N (он осуществляет связь с ДНК) и Topoisom_I (каталитическое ядро):
ДНК-топоизоимеразы - это семейство ферментов, катализирующие превращение одного топологического изомера ДНК в другой, путем образования или удаления узлов, уменьшая и увеличивая степень сверх-спирализации в молекуле. ДНК-топоизомеразы устраняют топологические затруднения при репликации, транскрипции и рекомбинации. Рассматриваемая ДНК-топоизомераза I является ферментом, катализирующие изменение топологического состояния молекулы ДНК путем образования, а затем сшития однонитевого разрыва. Данный фермент для осуществления реакции не использует энергию АТФ.
N-концевой домен отвечает за координирование процесса разрыва одной из цепей ДНК во время процесса топоизомеризации. Этот домен связывается с ДНК за счет фосфотирозиновой связи, тем самым ограничивая её подвижность. Консервативный остаток триптофана возможно является необходимым для связывания. Функционирование ДНК-топоизомеразы может ингибироваться растительным алкалоидом каптотецином, который обладает антираковой действием.
Следует отметить, что не все ДНК-топоизомеразы I ингибруются каптотецином. У Vaccinia virus (поксвирус, или вирус группы оспы) обнаружена ДНК-топоизомераза сходная с эукариотической, но она не ингибируется каптотецином. Она является самой маленькой из обнаруженных топоизомераз.
Рассмотренный ранее lys425 согласно выравниванию Pfam является очень консервативным остатком. Также очень консервативным остатком является tyr426. Вероятно это можно объяснить тем, что оба этих остатка образуют полярные связи с остатком фосфорной кислоты, что способствует более надежному закреплению молекулы ДНК нежели гидрофобные взаимодействия.
С помощью программы nucplot была получена схема контактов фермента с молекулой ДНК.
Ниже представлен фрагмент полученного изображения.
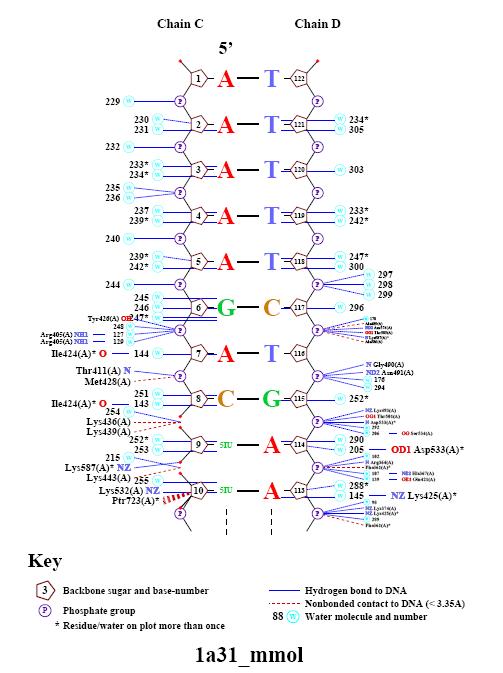
Это изображение в принципе согласуется с полученными с помощью RasMol данными. Следует отметить, что полярные взаимодействия образуются в основном между белком и остатком фосфорной кислоты. Полярные контакты белка с азотистыми основаниями практически отсутствуют (есть только контакт белка с модифицированным основанием). Программа обнаружело очень большое количество водородных связей. Большинство из них образованы молекулами воды. Аминокислотные остатки также образуют водородные связи в основном с остатками фосфорной кислоты. Есть также водородные связи а.о. с молекулами воды, уже связанными с остатками фосфорной кислоты.
© Алипер Александр Миронович