Практикум 1. Pymol. Взаимодействия
Задание 1
Файл PDB со следующим ID (2qs1) содержит модель комплекса "белок-лиганд", а именно: лиганд-связывающий домен GluR5-рецептора (каинатный рецептор) с UBP315 из Rattus norvegicus.
Каинатные рецепторы принадлежат к семейству ионотропных глутаматных рецепторов (iGluR), к которым относятся также NMDA-, AMPA-рецепторы[1], которые играют важную роль в реципрокном торможении[4]. Показано, что они выполняют определённые функции в центральной нервной системе: регуляция высвобождения L-глутамата, регуляция синаптической передачи возбуждения в обонятельной луковице, участвуют в синхронной ритмичной активности мозга, процессах запоминания.[2, 3, 4]. Каинатные рецепторы состоят из пяти субъединиц: GluK1-GluK5. С нарушениями их работы связаны следующие неврологиеские: нейродегенеративное расстройство, хронические боли, мигрень, - так и нейропсихическое заболевание, как шизофрения[1]. Следовательно, для детального изучения функций данного типа рецепторов необходимо найти молекулы, взаимодействующие с ними. Например, были найдены селективные антагонисты UBP310 и UBP316 - природные аналоги виллиардиина и др.[5] Также, в целом, на каинатные рецепторы действуют такие селективные агонисты, как глутамат, каинат и АТРА.
В статье[1], посвящённой кристаллической структуре комплекса, авторы показали взаимодействие лиганд-связывающего домена субъединицы GluK1 рецептора GluR5 с тремя высокоаффинными антагонистами: UBP315 (присутствует в PDB-файле со структурой, отмечена как "UB1"; рис.2), UBP318 и LY466195.
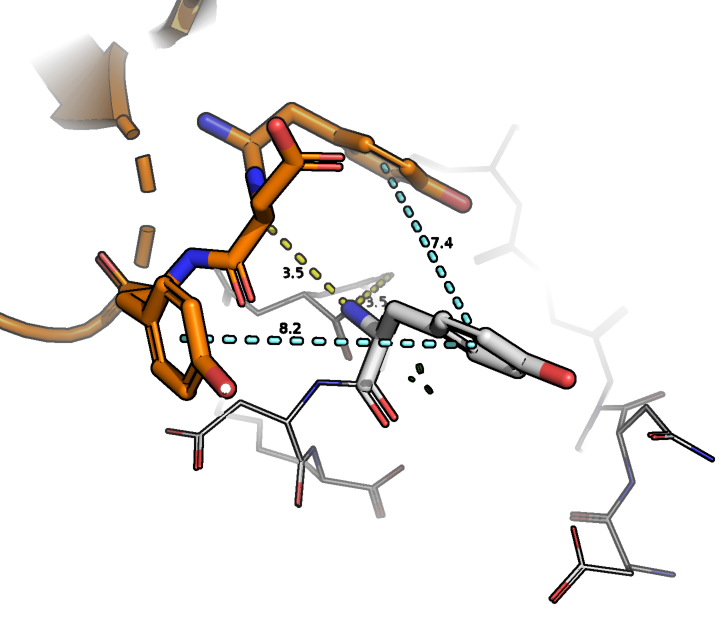
Посмотрим на взаимодействия между лигандом (UB1) и белком (ссылка на сессию) (рис.3):
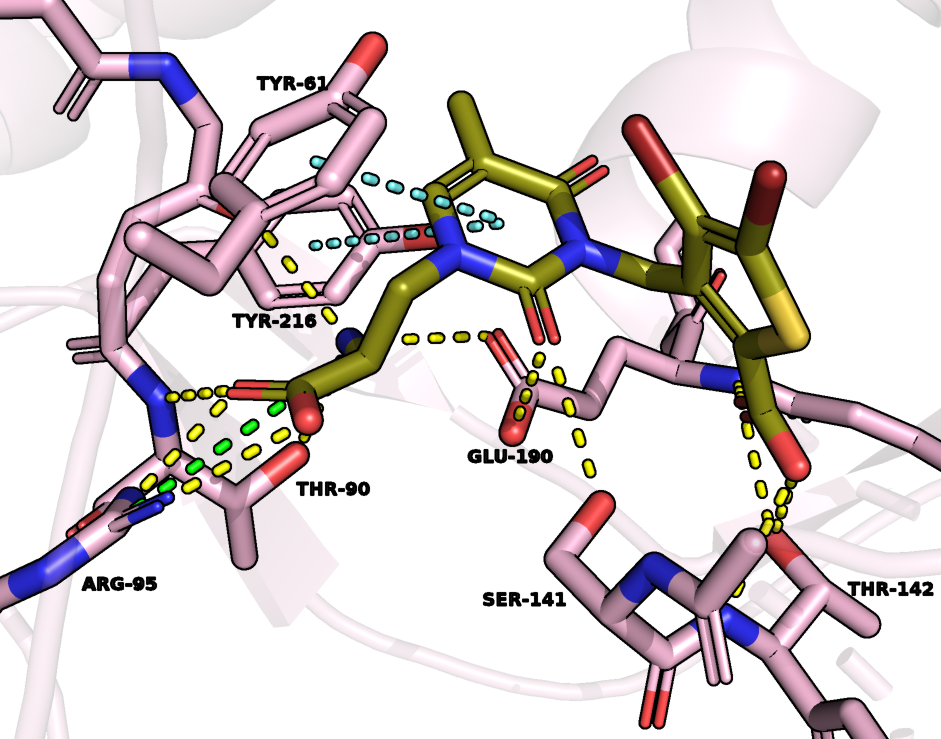
Жёлтым цветом показаны водородные связи, зелёным - солевые мостики, голубым - стэкинг-взаимодействия
Смотря на данную структуру, можно сделать следующие выводы: лиганд стабилизируется в молекуле белка за счёт водородных связей, создаваемых с аминокислотными остатками, показанными на рис.3, солевых мостиков и стэкинга. Данное суждение подтверждается (за исключением стэкингов) в статье с самой структурой.
Задание 2
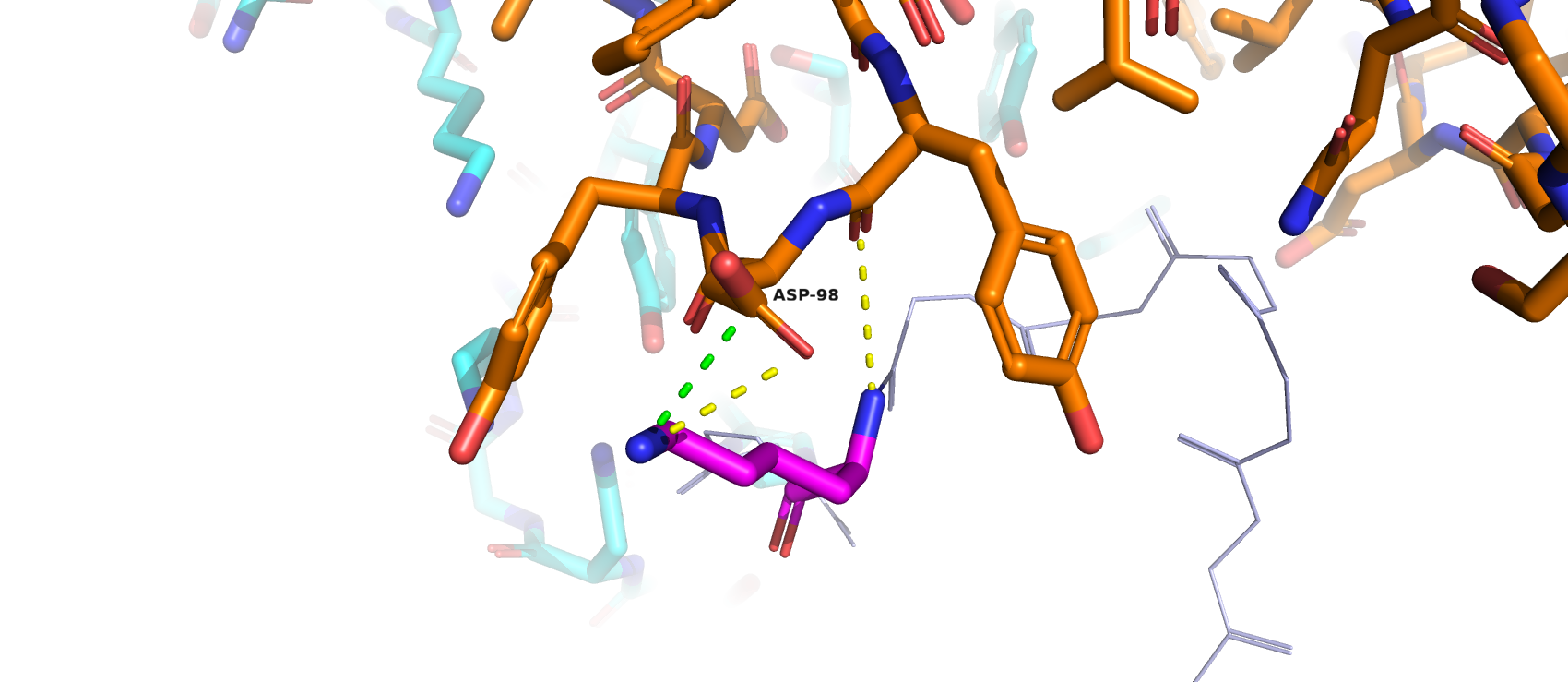
Дан комплекс антитела с его пептидным антигеном (файл 13). Антитела - белки, чья главная задача заключается в специфичном связывании своих антигенов. Антитела обычно стремятся к образованию множества взаимодействий с антигенами, максимизируя аффинность связывания. В данном случае антиген - это короткая белковая цепочка. Позицию 101 антигена в цепи Р мы заменили на глицин. Необходимо было найти исходную аминокислоту, которую заменили на глицин. Воспользовались инструментом "Wisard -> Mutagenesis -> Protein" (потому что функция "Mutation" PyMol не дала чётких ответов на то, на что можно было бы промутировать конкретный остаток), перебрали все аминокислотные остатки и смотрели на значение "strain" (табл.1): чем больше, тем меньше уверенности в том, что исходная аминокислота была такая-то (в табл.1 помечены красным цветом). Перебрав всевозможные аминокислотные остатки, получив соответсвующие для них значения strain, просмотрев взаимодействия всех ротамеров аминокислот (водороды были убраны), пересдав уже два раза это задание, можно предположить, что заменяли на глицин следующие аминокислоты: аспарагин (водородные связи с боковыми радикалами Asp-98 и Tyr-99, с остовом), глутамин (водородные связи с боковым радикалом Tyr-97 и остовом), глутамат (водородные связи с боковым радикалом Tyr-99 и остовом), лизин (водородные связи с боковыми радикалами Asp-98, с остовом и электростатические взаимодействия), гистидин (водородные связи с боковыми радикалами Asp-98 и Tyr-99, с остовом), серин, треонин (водородные связи с боковыми радикалами Tyr-99, с остовом) (мог бы быть треонин, но у него для всех ротамеров слишком далёкие расстояния). Скорее всего, это может быть лизин, хотя у него не минимальное значение "strain".
В окружении мутированной (исходной) аминокислоты присутствуют такие остатки, как два тирозина, по обе стороны отстоящие от неё, и депротонированный аспартат. Следовательно, можно предположить, что искомая аминокислота образует контакты именно с этими остатками (рис.4, ссылка на сессию). В качестве исходной аминокислоты мог бы выступать и тирозин (рис.5), однако длины образовавшихся стэкинг-взаимодействий не входят в интервал 4 - 6 Å. Изменяя положение аминокислоты, лучшей картины не наблюдалось (эта процедура была проделана и для остальных аминокислот).
Таблица 1. Значения "strain" для аминокислот
| Аминокислота | Strain |
|---|---|
| Ala | - |
| Arg | 17.90 |
| Asn | 17.80 |
| Asp | 18.07 |
| Cys | 33.25 |
| Gln | 16.89 |
| Glu | 16.49 |
| His | 14.61 |
| Ile | 35.31 |
| Leu | 27.48 |
| Lys | 23.91 |
| Met | 21.37 |
| Phe | 15.26 |
| Pro | 49.29 |
| Ser | 29.99 |
| Thr | 37.09 |
| Trp | 16.93 |
| Tyr | 14.36 |
| Val | 31.22 |
Список литературы
- Alushin GM, Jane D, Mayer ML. Binding site and ligand flexibility revealed by high resolution crystal structures of GluK1 competitive antagonists. Neuropharmacology. 2011 Jan;60(1):126-34. doi: 10.1016/j.neuropharm.2010.06.002. Epub 2010 Jun 15. PMID: 20558186; PMCID: PMC2976827.
- Jane DE, Lodge D, Collingridge GL. Kainate receptors: pharmacology, function and therapeutic potential. Neuropharmacology. 2009 Jan;56(1):90-113. doi: 10.1016/j.neuropharm.2008.08.023. Epub 2008 Aug 28. PMID: 18793656.
- Lerma J. Kainate receptor physiology. Curr Opin Pharmacol. 2006 Feb;6(1):89-97. doi: 10.1016/j.coph.2005.08.004. Epub 2005 Dec 19. PMID: 16361114.
- Blakemore LJ, Corthell JT, Trombley PQ. Kainate Receptors Play a Role in Modulating Synaptic Transmission in the Olfactory Bulb. Neuroscience. 2018 Nov 1;391:25-49. doi: 10.1016/j.neuroscience.2018.09.002. Epub 2018 Sep 11. PMID: 30213766; PMCID: PMC6267532.
- Dolman NP, More JC, Alt A, Knauss JL, Pentikäinen OT, Glasser CR, Bleakman D, Mayer ML, Collingridge GL, Jane DE. Synthesis and pharmacological characterization of N3-substituted willardiine derivatives: role of the substituent at the 5-position of the uracil ring in the development of highly potent and selective GLUK5 kainate receptor antagonists. J Med Chem. 2007 Apr 5;50(7):1558-70. doi: 10.1021/jm061041u. Epub 2007 Mar 10. PMID: 17348638.
- Gabriella Cavallo, Pierangelo Metrangolo, Roberto Milani, Tullio Pilati, Arri Priimagi, Giuseppe Resnati, and Giancarlo Terraneo. The Halogen Bond. Chemical Reviews 2016 116 (4), 2478-2601. DOI: 10.1021/acs.chemrev.5b00484