Практикум 3. Альтернативные положения, B-фактор, кристалл
Задание 1
В этом и следующих заданиях работали с PDB-файлом с ID 1K55 (β-лактамаза Pseudomonas aeruginosa), цепью С и аминокислотными остатками Ser-115 и Trp-102. β-лактамаза - гидролаза, расщепляющая β-лактамные антибиотики, что обеспечивает устойчивость бактерий против данных соединений. Данный феррмент представляет собой димер, и в бактериях он карбамилируется (именно остаток лизина - причём, обратимо). Карбамилированный лизин необходим для стадий катализа, в которые входят процессы ацилирования и деацилирования самого белка. Было показано, что β-лактамазы произошли от группы пенициллин-связывающих белков бактерий[link].
При помощи команды select был выбран альтлок (альтернативная конформация остатка) наших двух остатков:
select Ser115_A, resi 115 and chain C and alt "A"
select Ser115_B, resi 115 and chain C and alt "B"
select Trp102_A, resi 102 and chain C and alt "A"
select Trp102_B, resi 102 and chain C and alt "B"
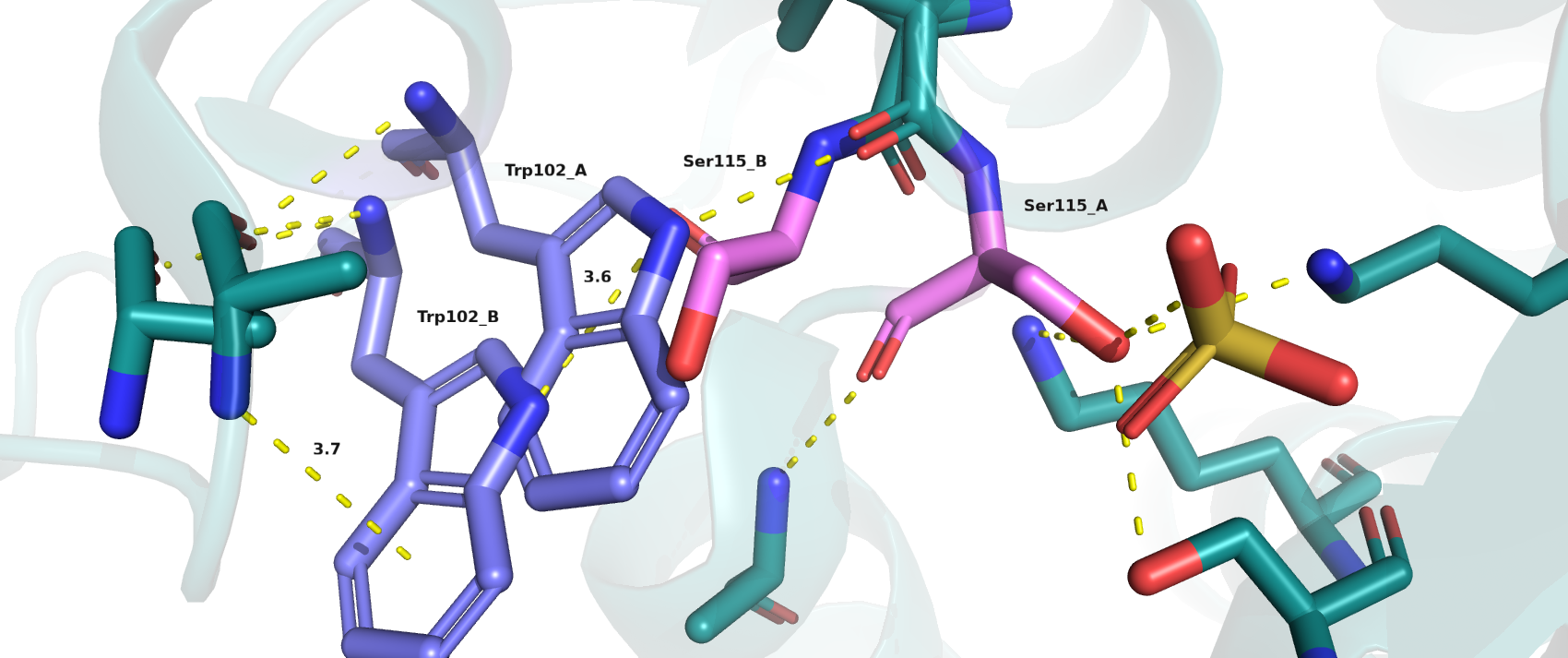
Видно, что сочетания альт-локов Ser_А + Trp_В (1) и Trp_A + Ser_B (2) невозможны в силу следующих причин: (1) Ser115_А связан водородными связями с остальными остатками белка и лигандом SO4, но слишком далеко расположен от Trp102_В; (2) Ser115_B расположен слишком близко к Trp102_А и вызывает стерические затруднения. Поэтому возможны сочетания А + А и В + В (между серином и триптофаном одинаковых конформаций возможны взаимодействия, обусловленные наличием между ними водородных связей, а также возможны взаимодействия данных остатков с остальными остатками белка и остовом (рис.1)). Могла бы быть π-водородная связь между остовом метионина в конформации А и Trp_B и водородная связь между Trp_B и Ser_B, но длины связей несколько больше 3.0-3.5 Å (показаны на рис.1).
Дополнительно были проверены значения уровня заселённости данных остатков в PDB-файле. Для всех атомов серина и триптофана обоих конформаций коэффициент заполнения составляет 0.5, следовательно, обе конформации равновероятны, но выше мы рассмотрели наиболее оптимальные ситуации с альтернативными конформациями.
Задание 2
Далее мы красим атомы остова белка по B-фактору (температурному фактому) (атомы с низким B-фактором будут покрашены синим, с высоким – красным) (рис.2):
spectrum b, blue_white_red, backbone
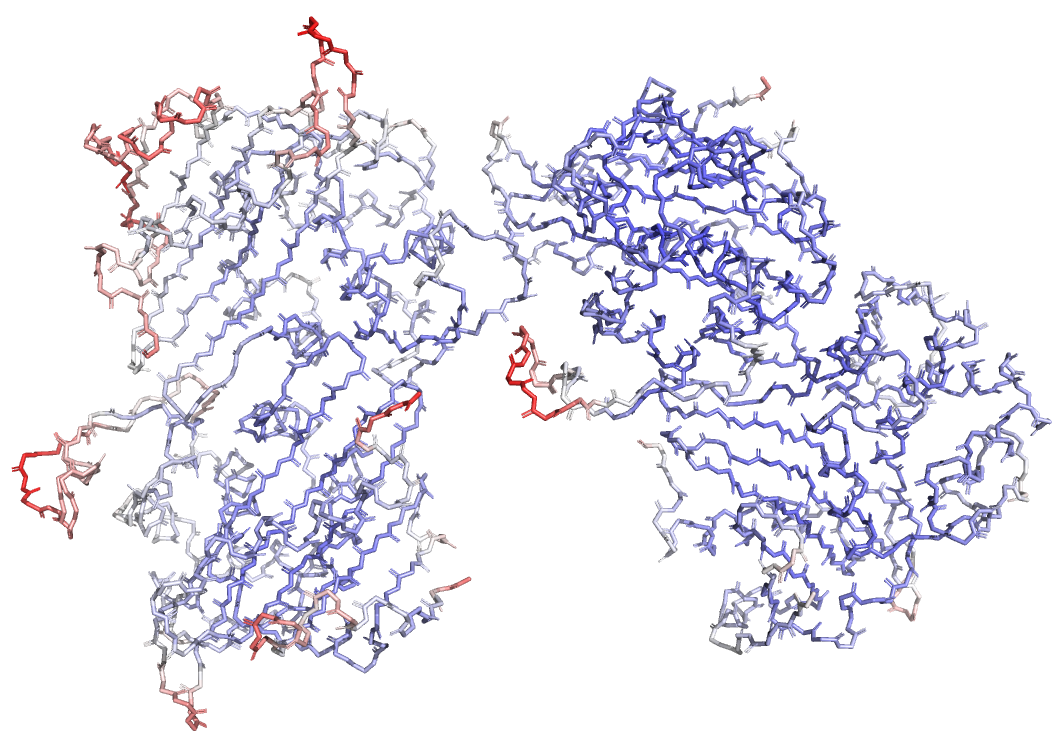
Величина В-фактора характеризует подвижность атомов: меньше 10 - атом мало подвижен и фиксирован в одном положении во всех молекулах белка внутри кристалла, выше 50 - атом сильно подвижен, из-за чего слабо детектируется во время эксперимента. Такое может быть для атомов, находящихся на поверхности белка, где длинные боковые цепи могут свободно находиться в окружающем растворе.
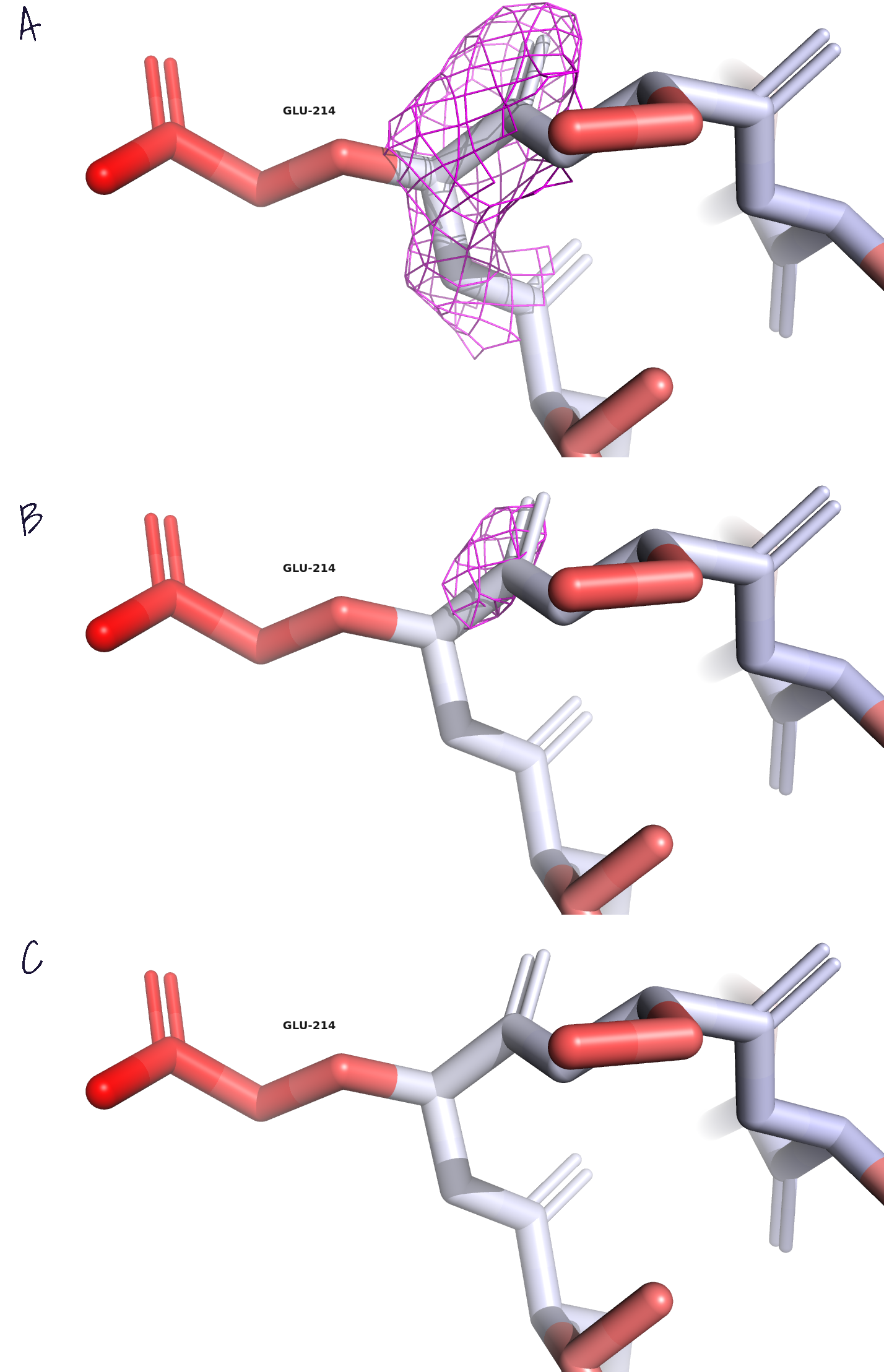
В данном случае участков с высоким В-фактором не так много: они расположены в выпетливаниях и α-спиралях на поверхности белковых субъединиц. Далее мы покрасили уже весь белок, не включая лиганды, по В-фактору и выбрали остаток, который к окончанию становится красным, - Glu-214 (рис.3). Мы рассмотрели электронную плотность вокруг этого остатка на разных уровнях подрезки (carve=1.5). Заметим, что даже при σ=1 боковой радикал совсем не покрыт электронной оболочкой, а при увеличении σ до 3 и вовсе исчезает. Следовательно, атомы этого остатка сильно подвижны в растворе, и потому сложнее становится их точно локализовать.
Задание 3
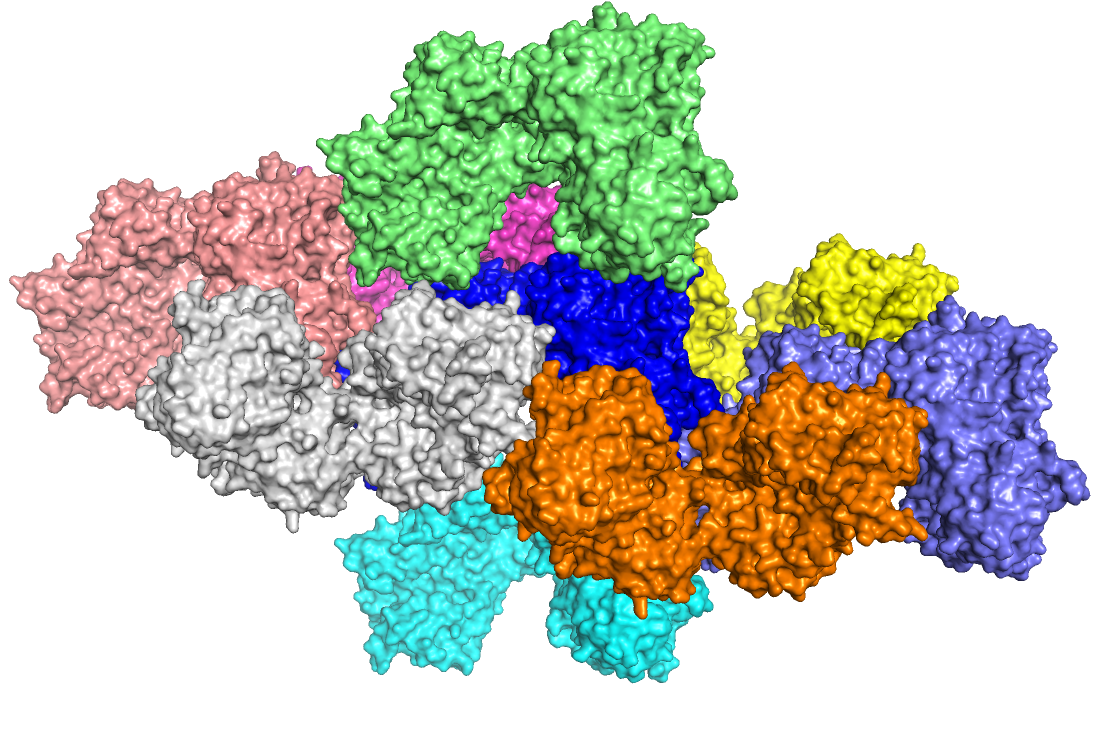
Здесь мы должны восстановить структуру кристалла, из которой вытащили один белок для анализа его структуры. Для этого мы генерируем соседей с помощью GUI (команда "generate") на уровне отсечки, равном 4 Å. Таких белков нашлось восемь штук.
Задание 4
Здесь мы исследовали интерфейсы контактов между отдельными молекулами белка. Среди восьми соседей, которые контактируют с исходным белком, было найдено не так много уникальных контактов (три).
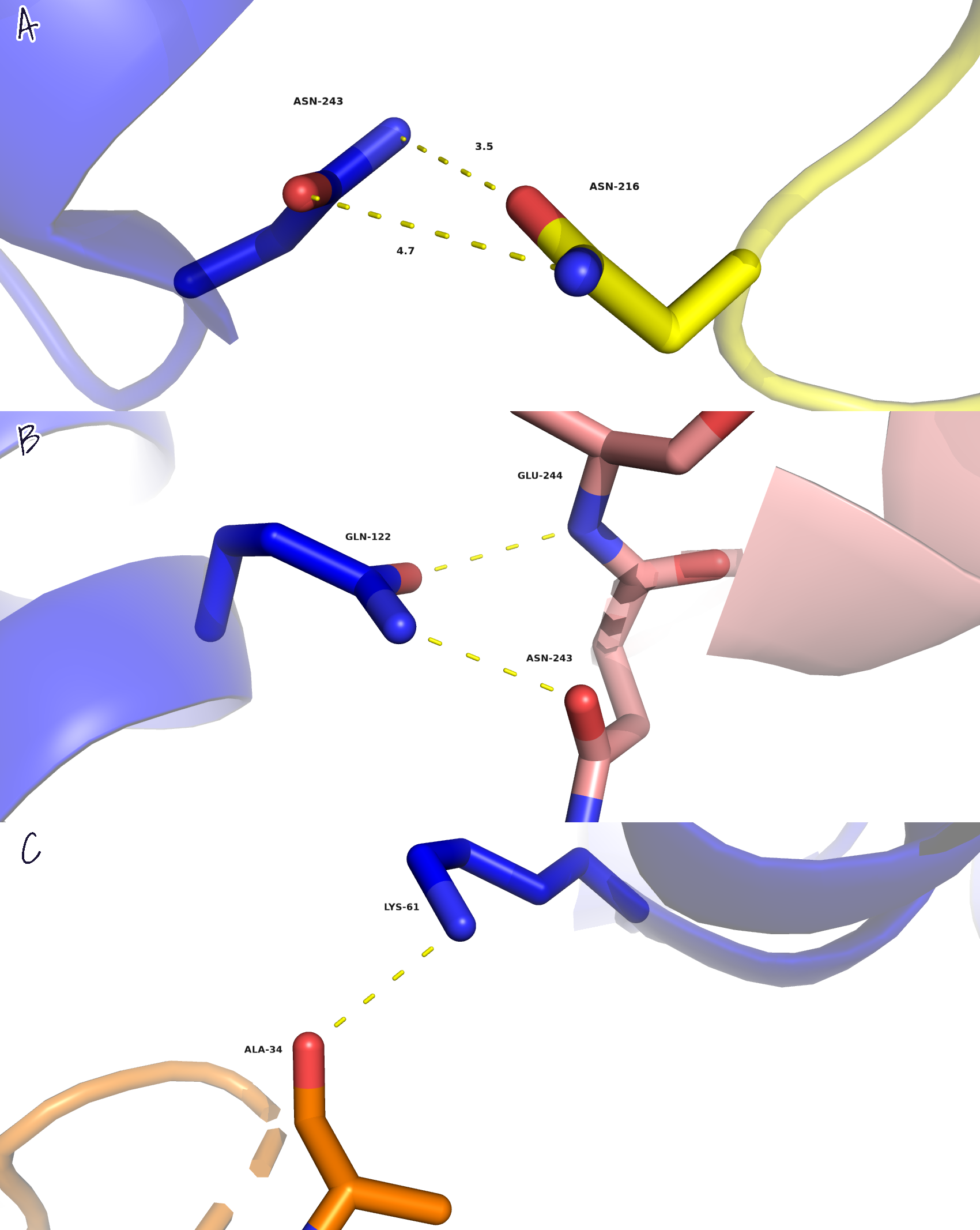
В остальных зонах молекулы связаны неуникальными контактами, представленными водородными связями, а также контактами с лигандами SO4 в белках. В природном варианте в составе искомого белка 1K55 (димера) присутствуют четыре цепи, при этом они попарно одинаковы; две неодинаковые цепи образуют контакты, которые наблюдались между соседями и искомым белком. В информации из PDB-файла было сказано, что структуру белка получали при рН=7.5 (рН=7.0-7.5 - физиологические условия), поэтому такой комплекс вполне имеет место быть.