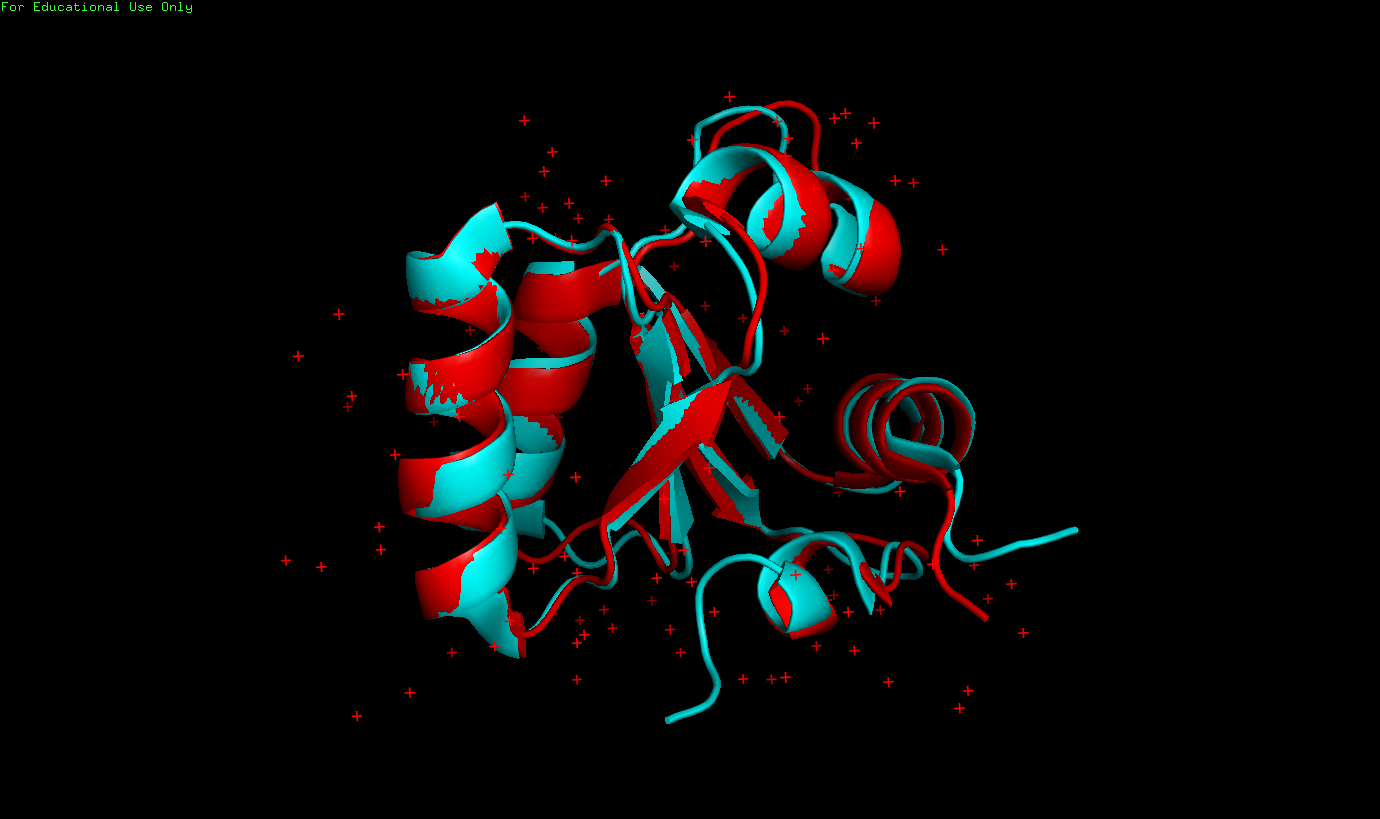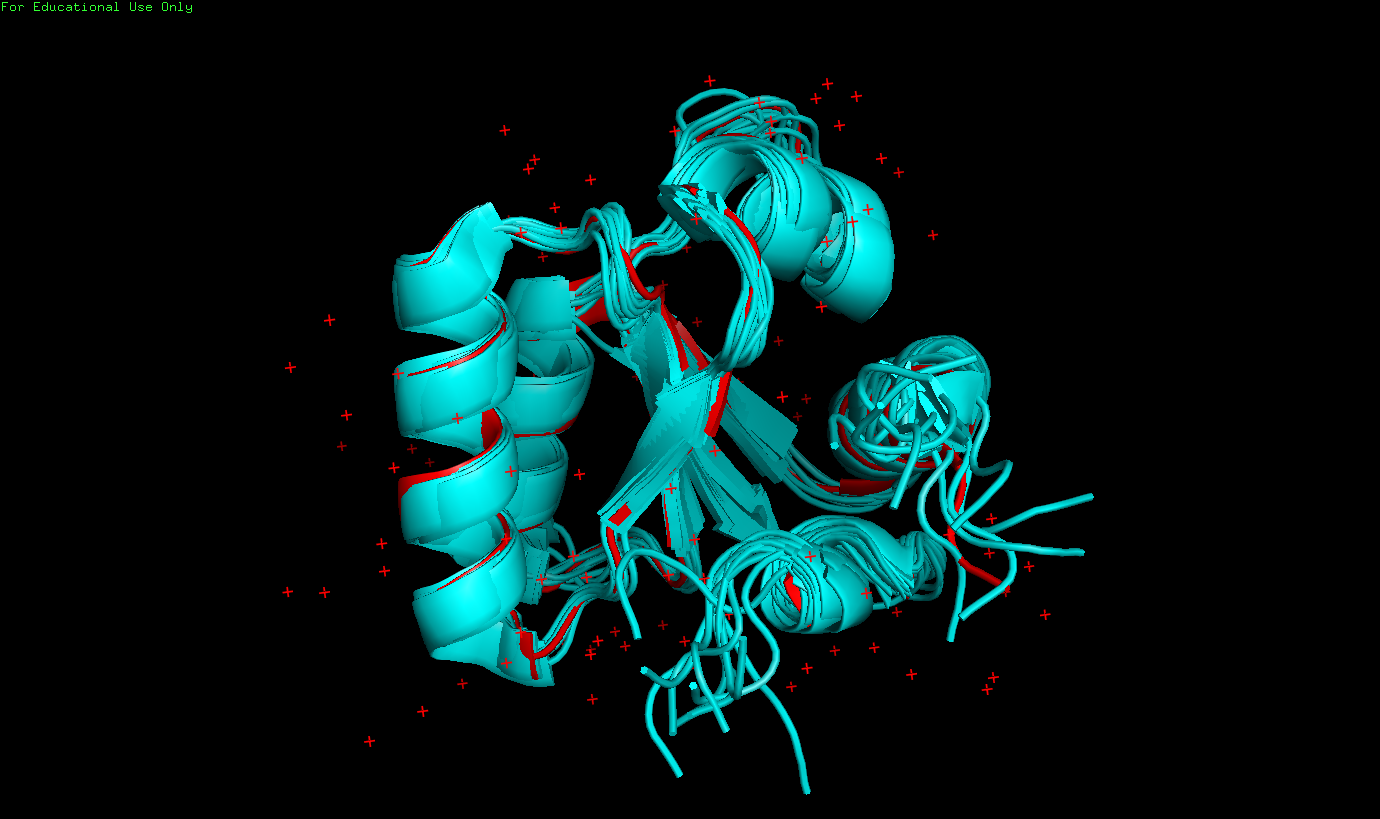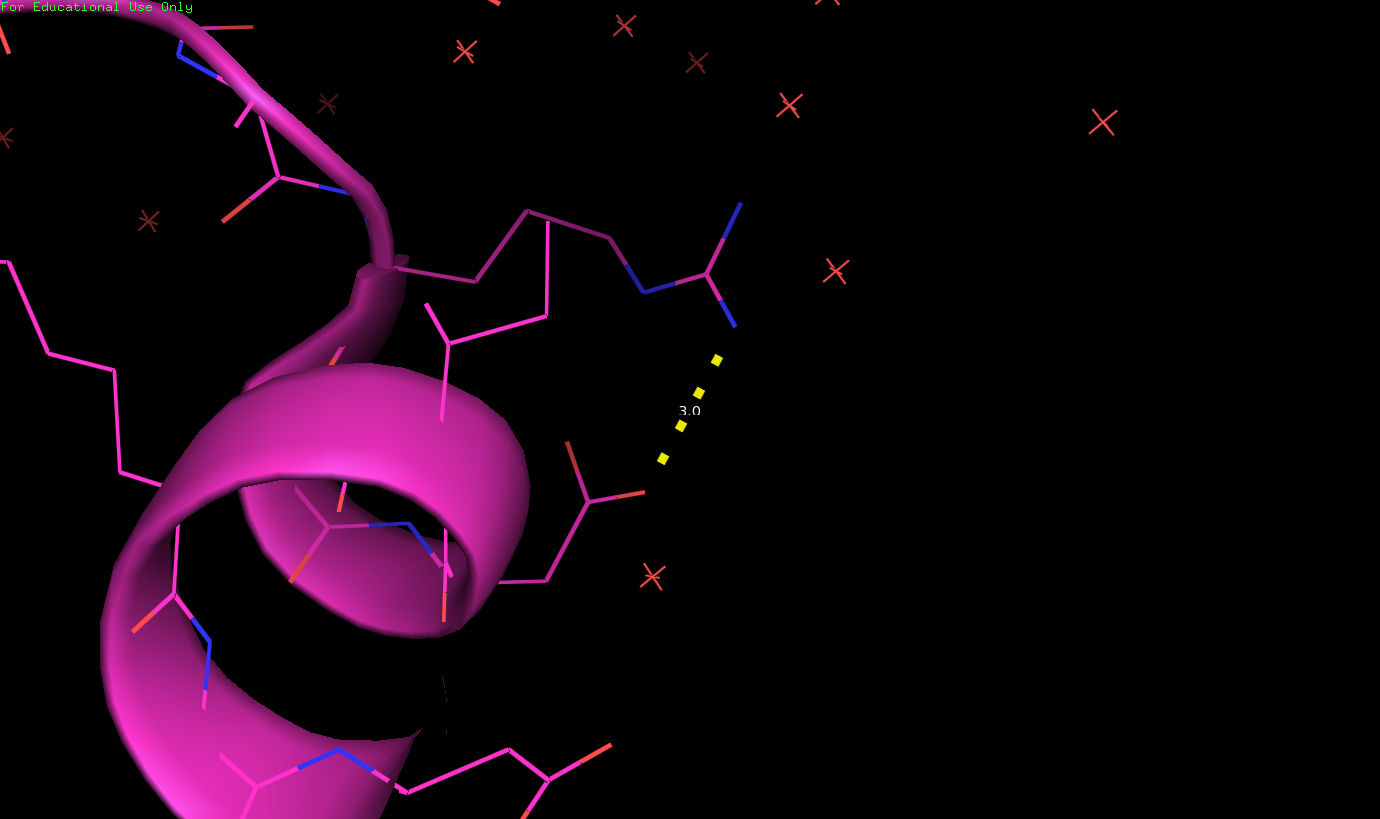



| РСА (3 Å) - найденная водородная связь на поверхности | РСА (найденная водородная связь на поверхности), тоже самое, но масштабировано | ЯМР (все 10 моделей) |
 |
 |
 |
| РСА (2.8 Å) - найденная водородная связь в ядре между β-тяжами | РСА (найденная водородная связь в ядре между β-тяжами), тоже самое, но масштабировано | ЯМР (все 10 моделей) |
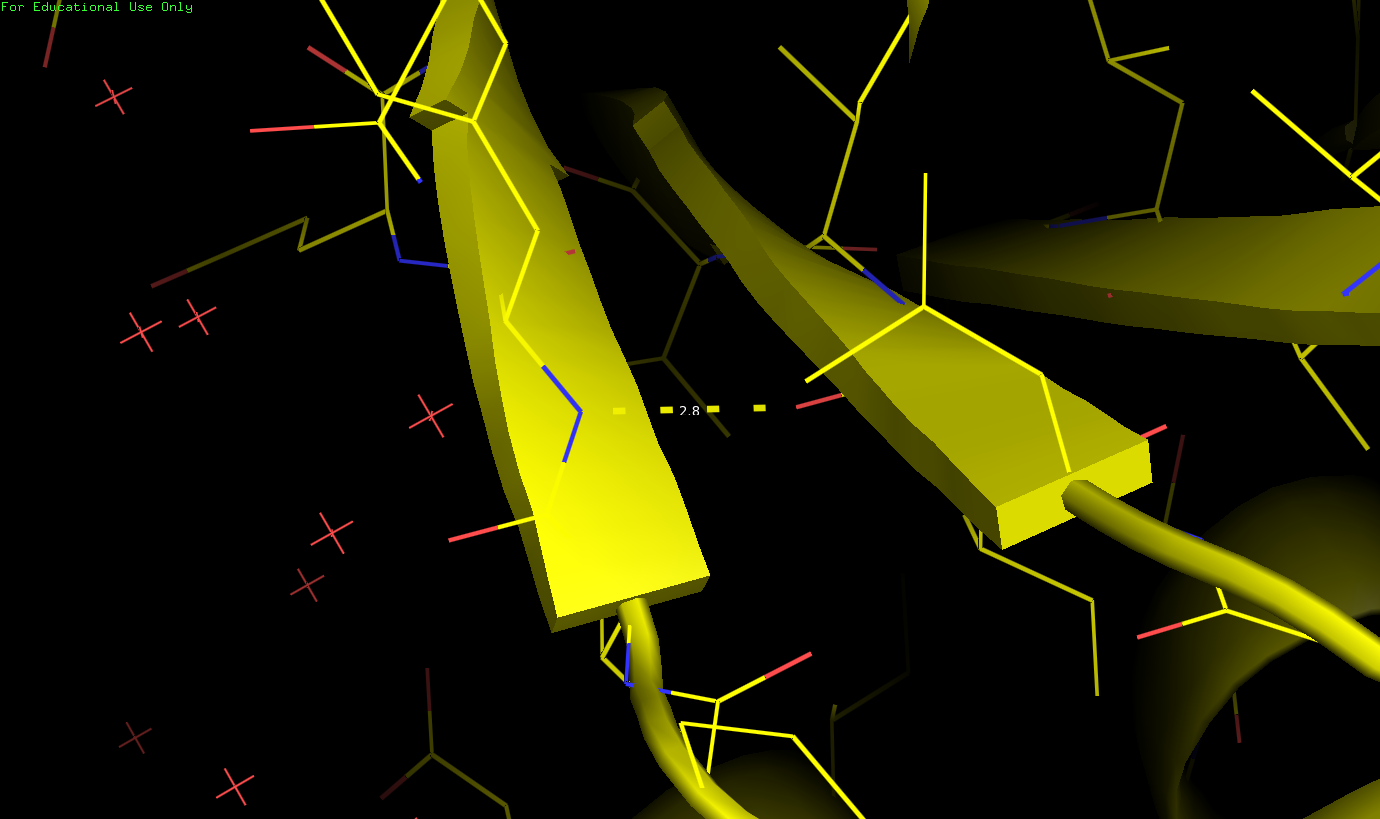 |
 |
 |
| РСА (4 Å) - найденная водородная связь в ядре в пределах одной α-спирали | РСА (найденная водородная связь в ядре в пределах одной α-спирали), тоже самое, но масштабировано | ЯМР (все 10 моделей) |
 |
 |
 |
| Расположение водородной связи | Длины связи (для РСА) | Длина связи - наименьшая (для ЯМР) | Длина связи - наибольшая (для ЯМР) | Длина связи - медиальная (для ЯМР) | В скольких моделях встречается* (число и процент) |
| На поверхности белка. Связь между ARG42 (донор) и ASP44 (акцептор) | 3 Å | - | - | - | 0 (0%) |
| В ядре белка (между β-тяжами). Связь между ILE35 (донор) и TYR61 (акцептор) | 2.8 Å | 1.7 Å | 1.8 Å | 1.78 Å | 10 (100%) |
| В ядре белка (в пределах одной α-спирали). Связь между LEU70 (донор) и LEU74 (акцептор) | 4 Å | 1.8 Å | 2.1 Å | 1.96 Å | 10 (100%) |