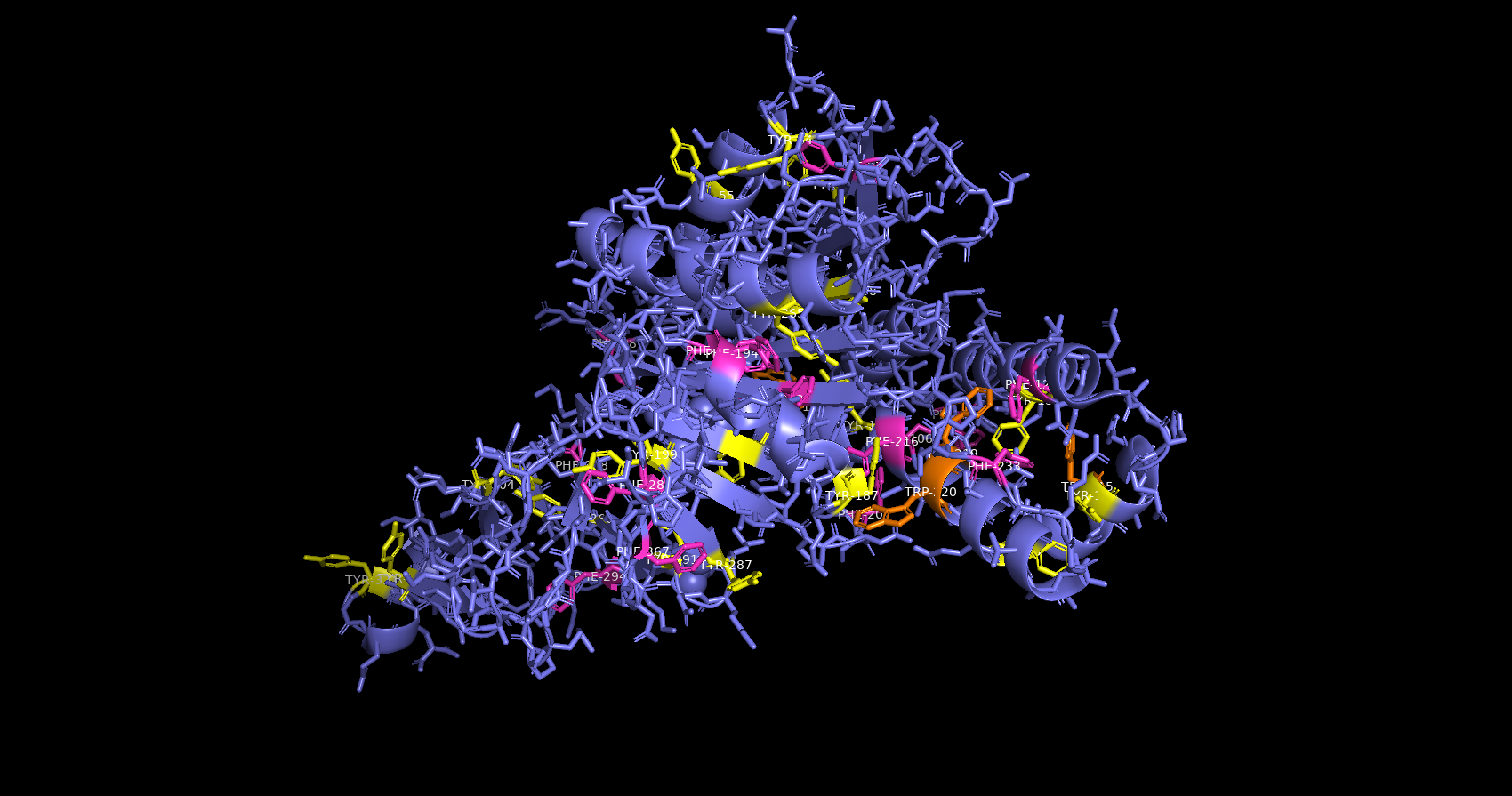
Взаимодействия между аминокислотными остатками в белке 3LWU
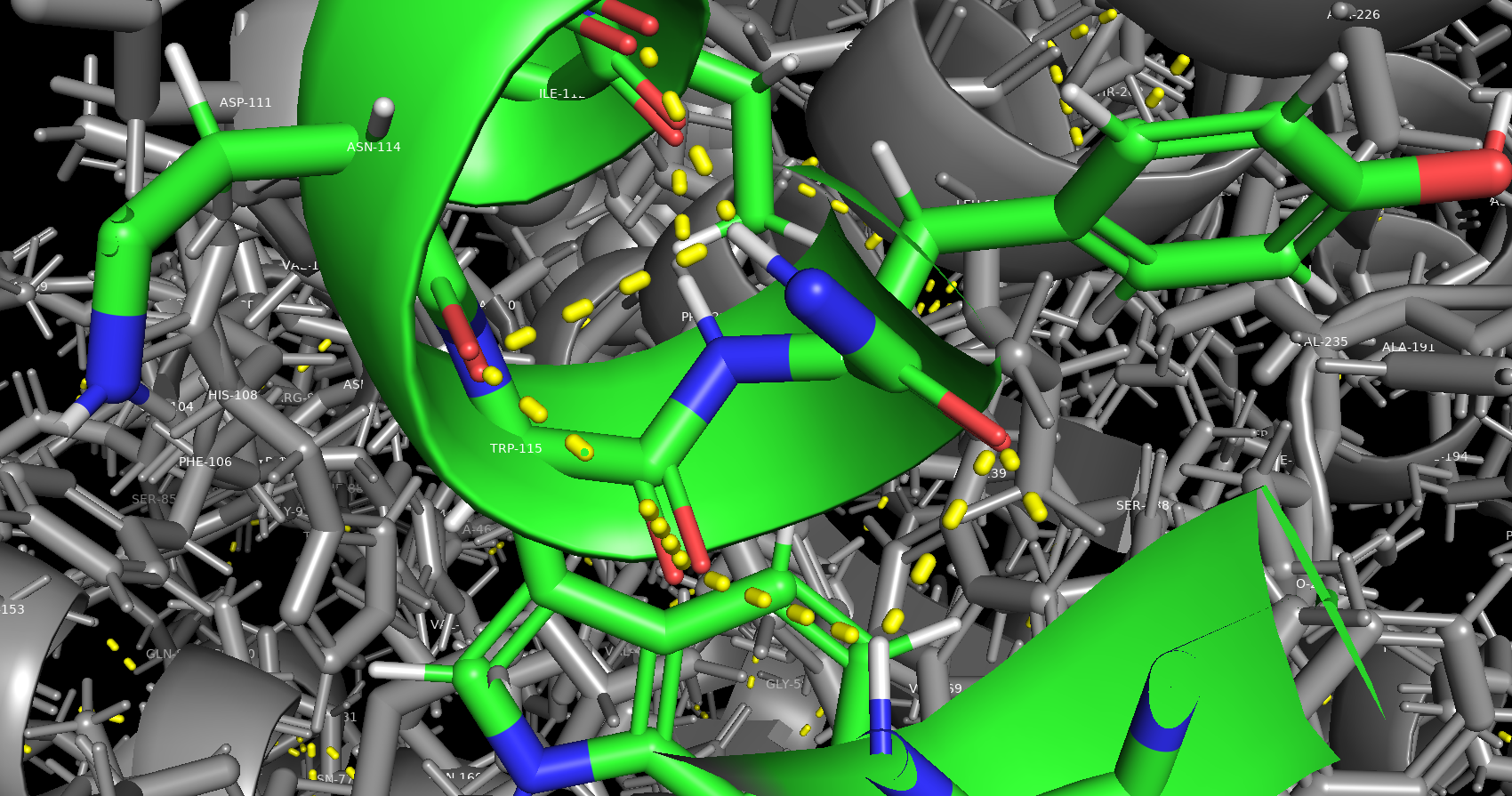
Водородная связь, затрагивающая атомы остова белка
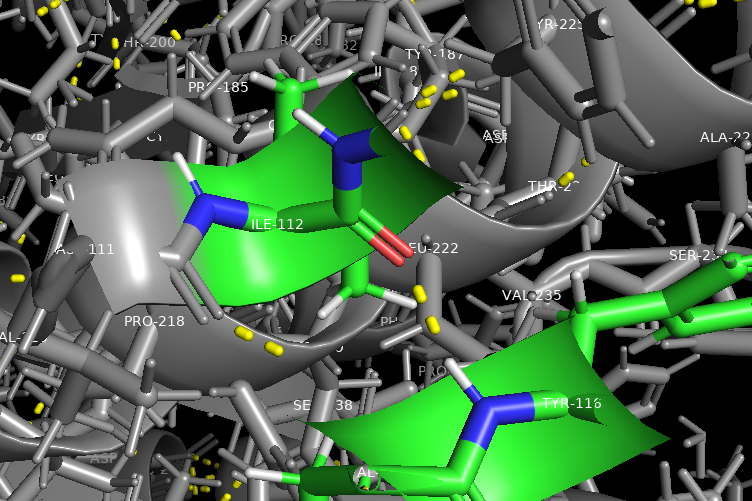
Водородная связь, затрагивающая атомы боковых радикалов аминокислот
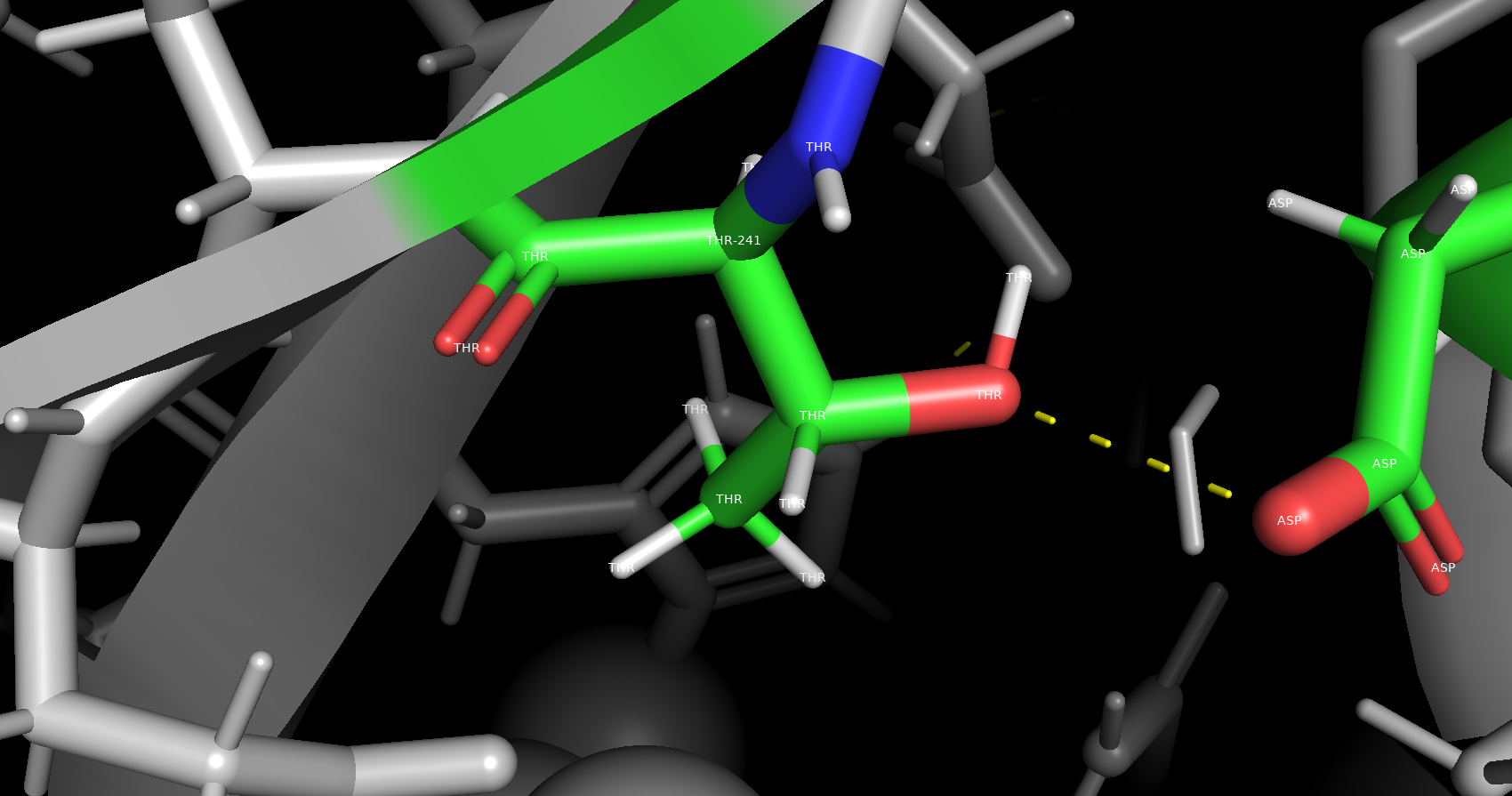
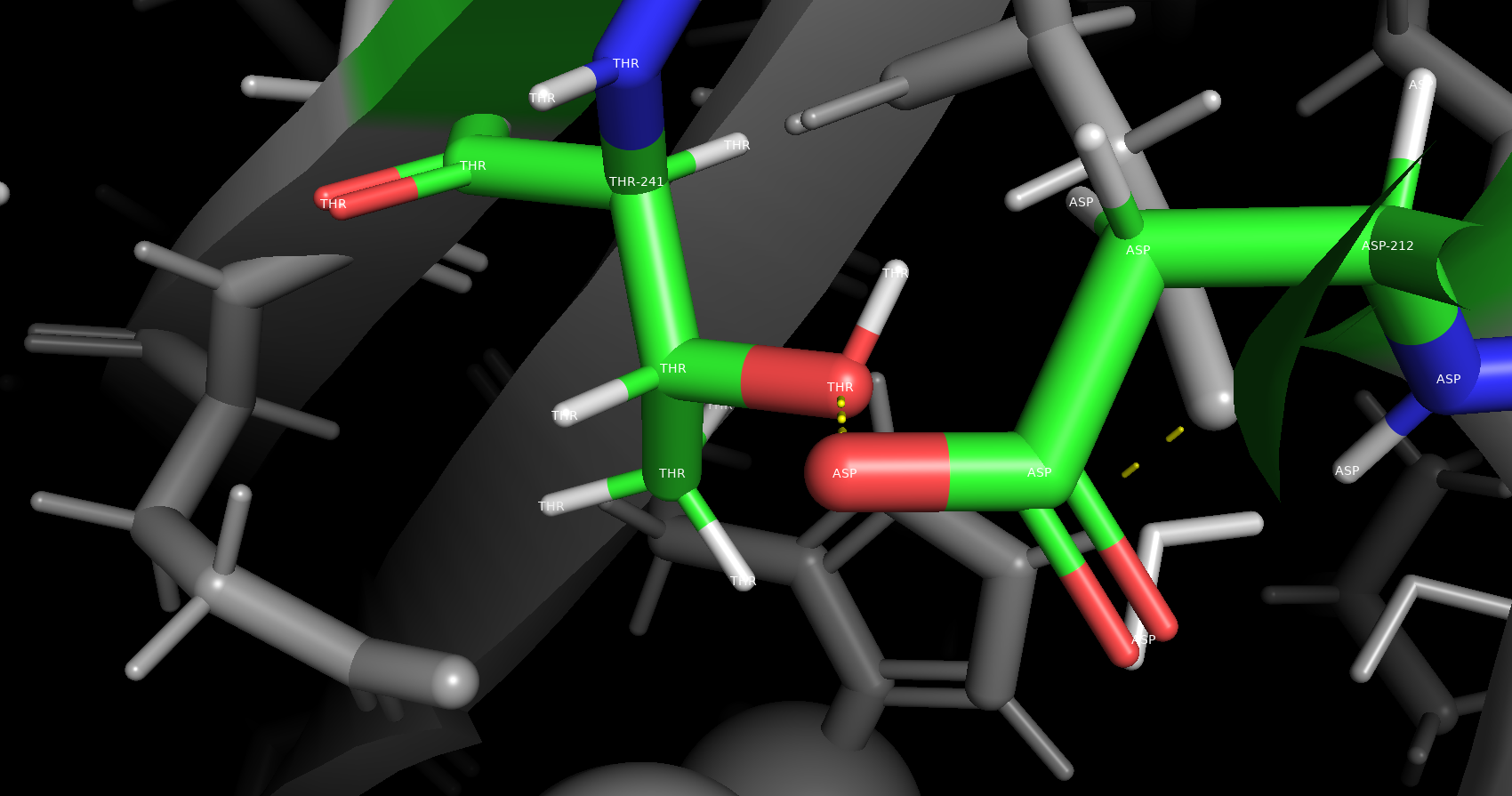
Солевой мостик
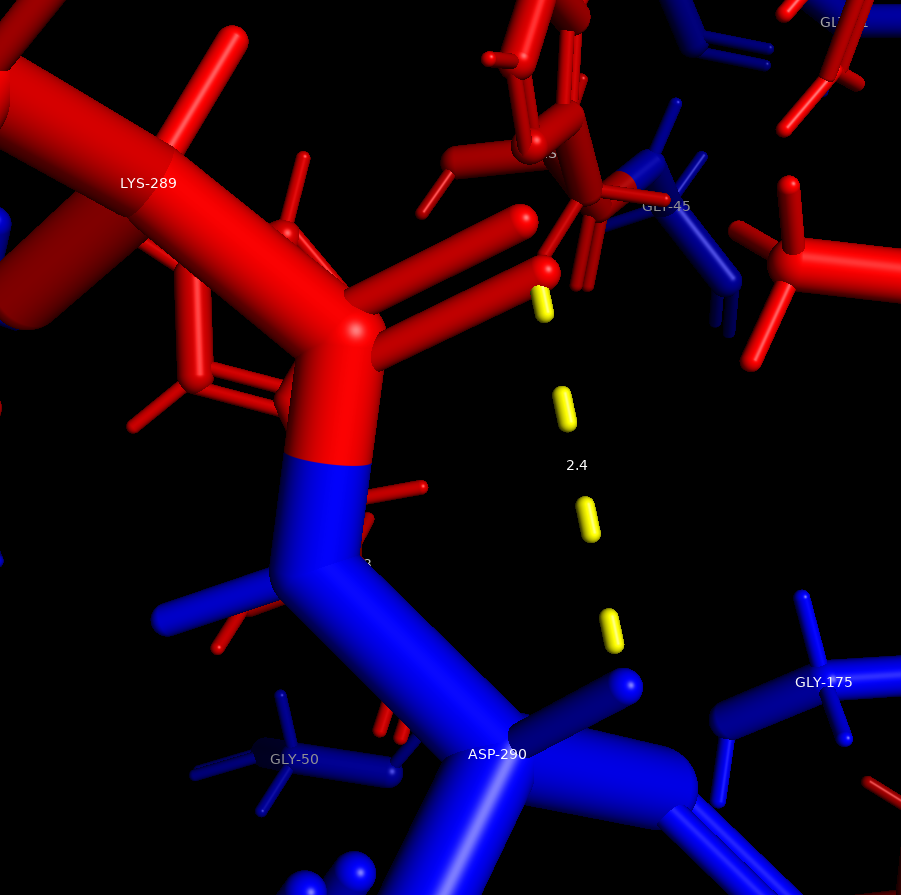
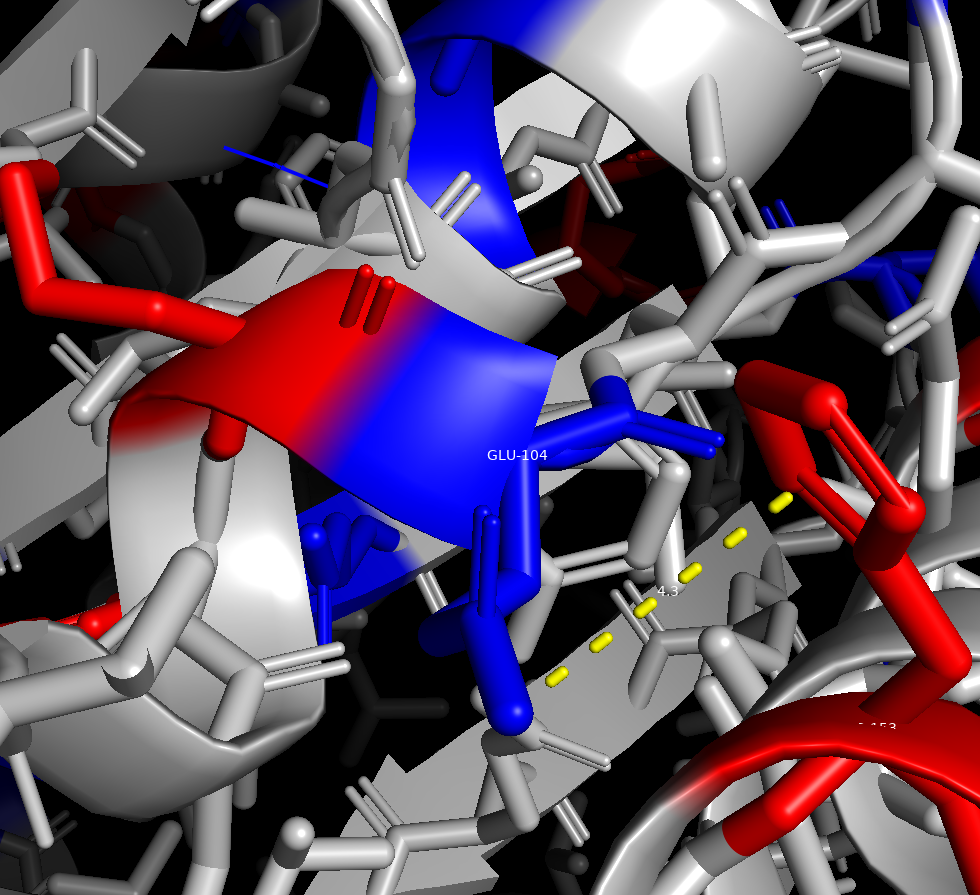
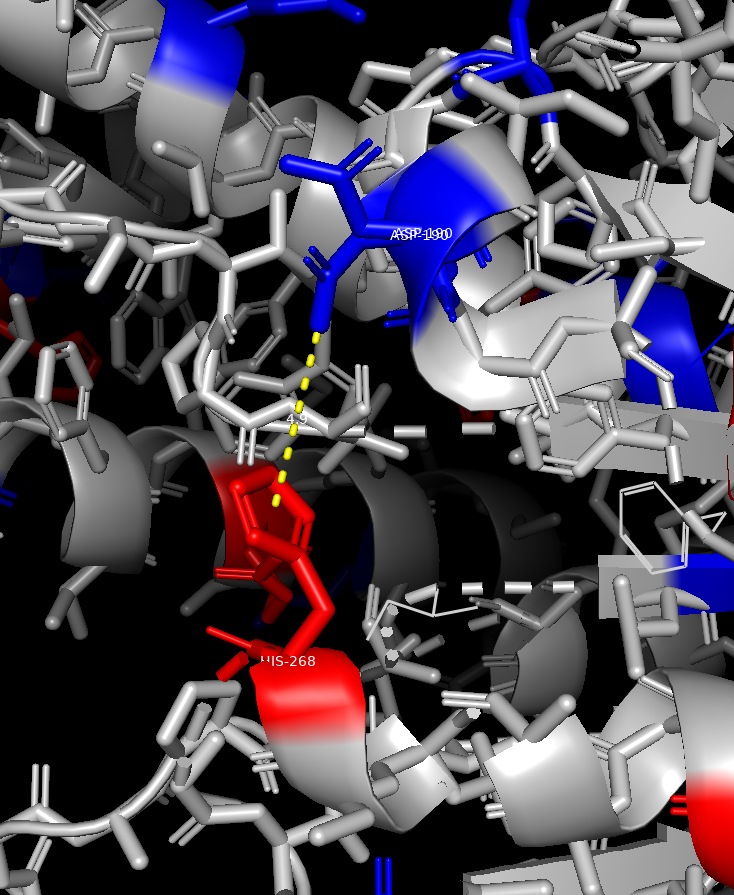
Все положительно заряженные аминоксилоты (Lys,Arg,His) были окрашены в красный цвет, а все отрицательно заряженные аминоксилоты (Asp,Gly) в синий. В ходе измерений расстояний, между разнозаряженными радикалами аминоксилот было выявлено,что минимально расстояние составляет 4.3 ангстрем (между GLU-104 и HIS-153). Помимо этого, в белке могут образовываться более 3 потенциальных солевых мостиков, так как расстояние между разнозаряженными радикалами входило в допустимый диапозон расстояний.
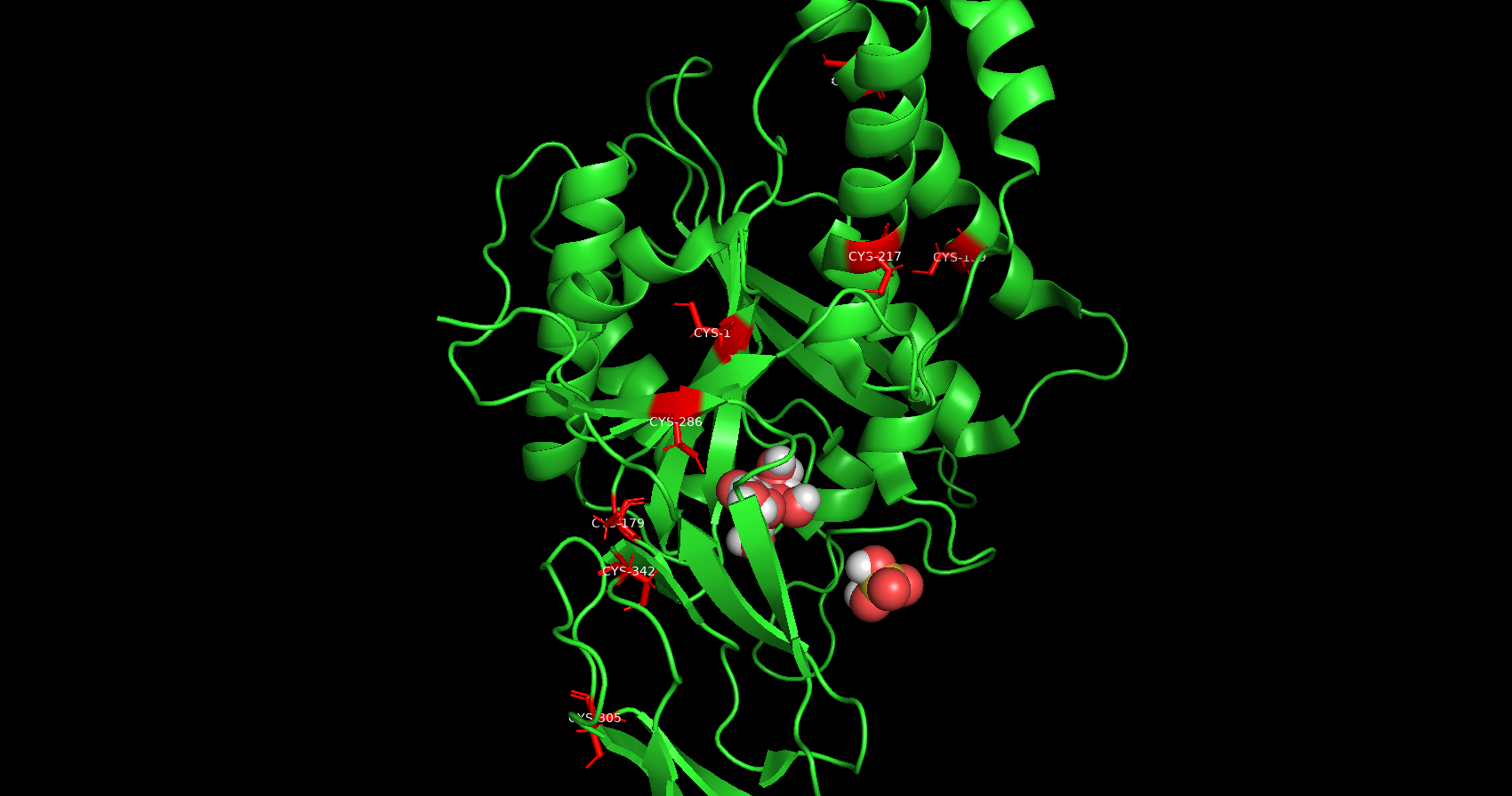
Дисульфидная связь
Все аминокислотные остатки цистеина находятся на большой удалении друг от друга для образования дисульфидных связей.
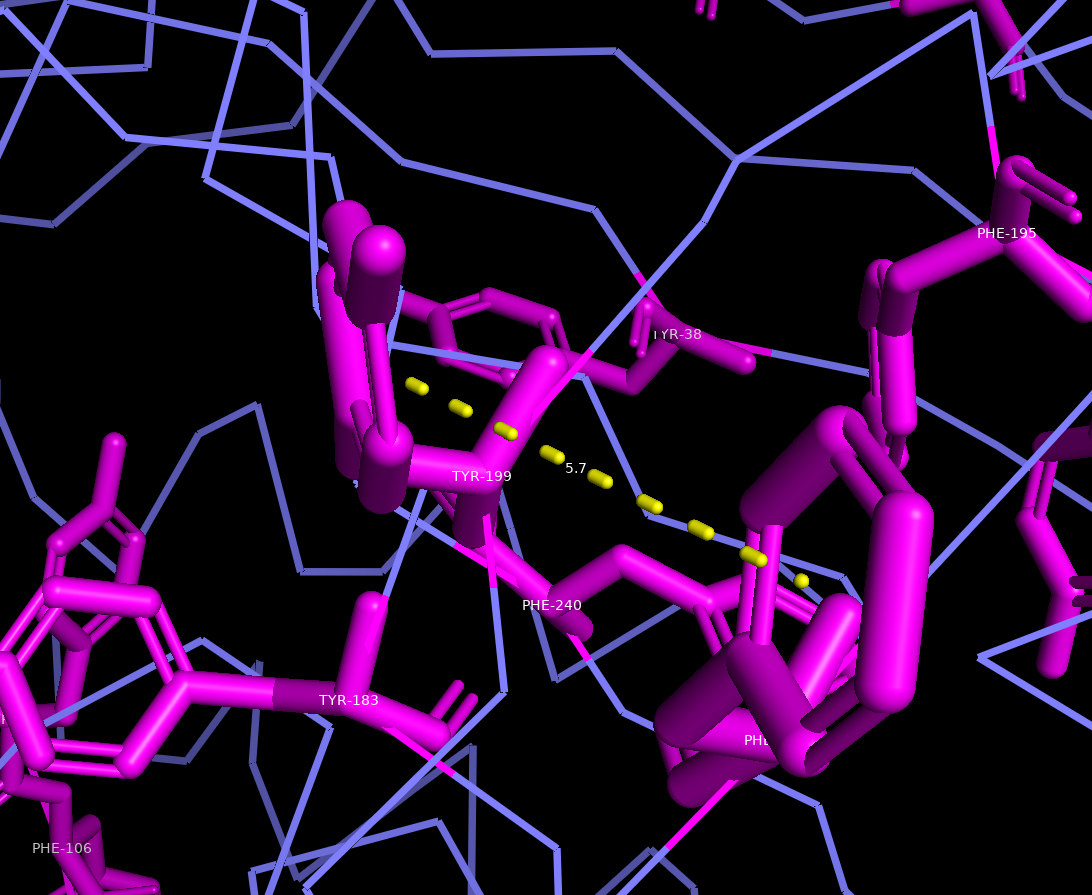
Стэкинг
В данной структуре присутсвует Т-стэкинг (рис.10) и параллельный стэкинг (рис.11). Для образования стэкинг взаимодействий между ароматическими аминоксилотами необхожимо расстояние между кольцами 4-6 ангстрем.