Количество водородных связей 220
Количество альфа-спиралей 11
Количество бета-складок 17
Количество бета-поворотов 33
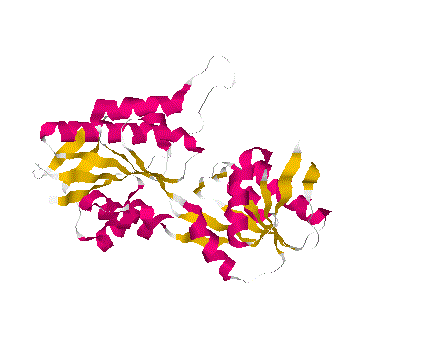
Мой белок относится к альфа+бета-спиральным белкам.
Это легко определить по изображению его ленточной модели:
здесь присутствуют и альфа-спиральные белки (розовые) и
бета-структурные белки (желтые).
Для исследования выбраны элементы вторичной структуры:
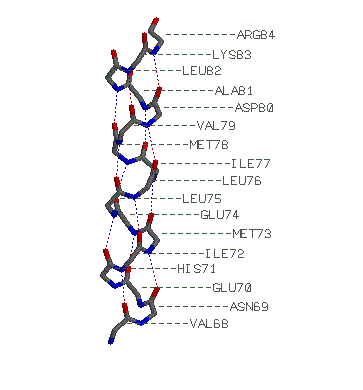
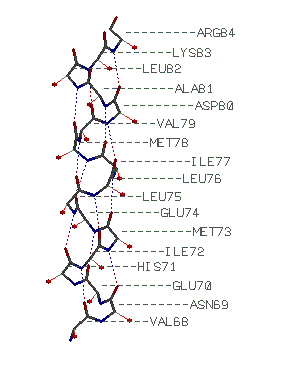
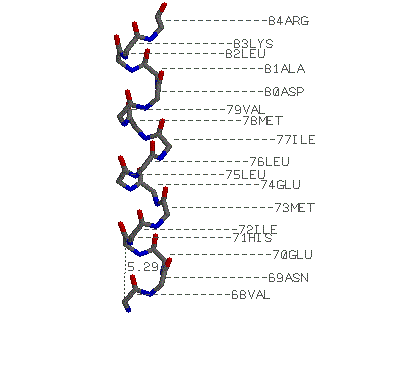
альфа-спираль: Val 68-Arg 84
антипараллельные бета-тяжи: Cys 35-Arg 39, Val 45-Ile 49
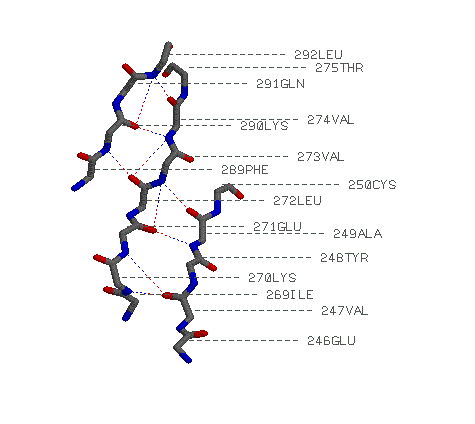
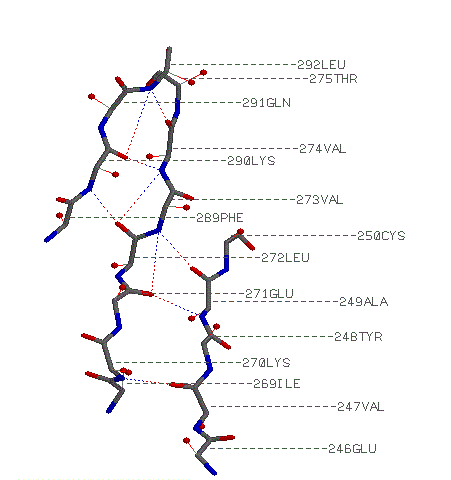
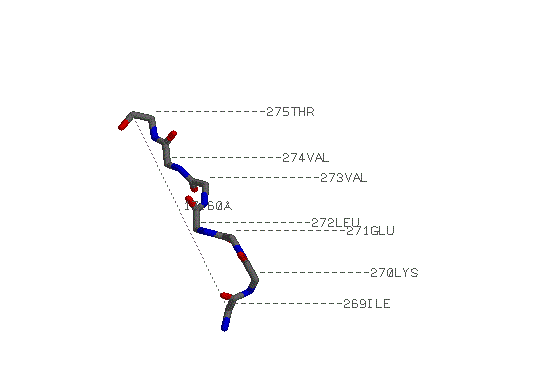
параллельные бета-тяжи: Ile 269-Thr 275, Glu 246-Cys 250
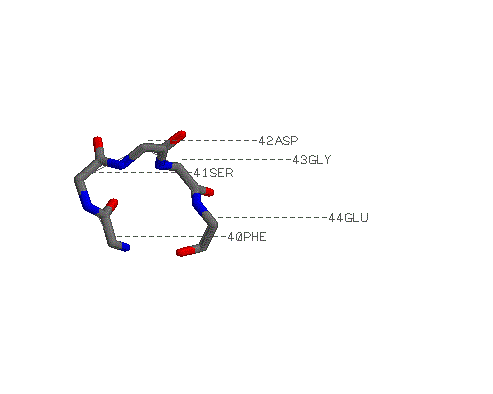
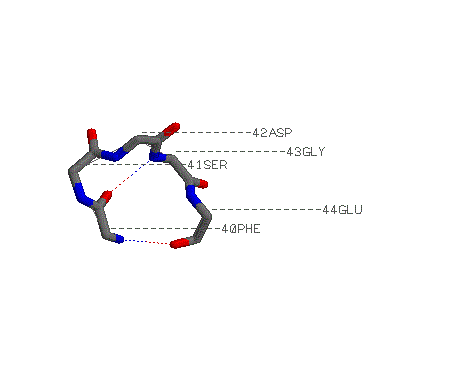
петля, в которой полипептидная цепь круто
разворачивается на 180°: Phe 40-Glu 44