Практикум 5
Автор старался, но не может гарантировать отсутствие биологических ошибок.
Данный практикум посвящен поиску взаимодействий между аминокислотными остатками. Рассматривалась структура с pdb_id 1B9H в базе PDB. Для работы с белком использовался PyMOL.
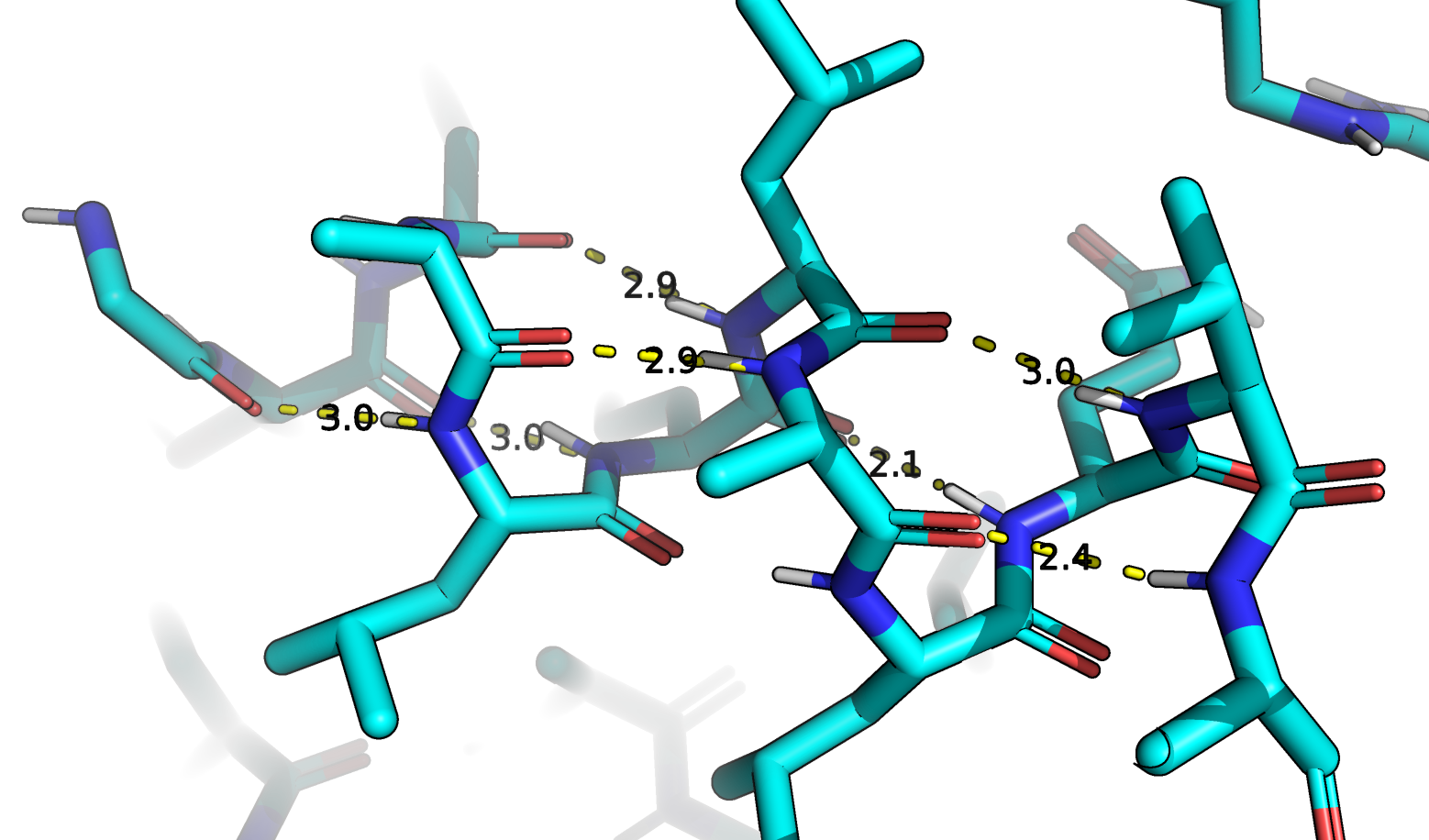
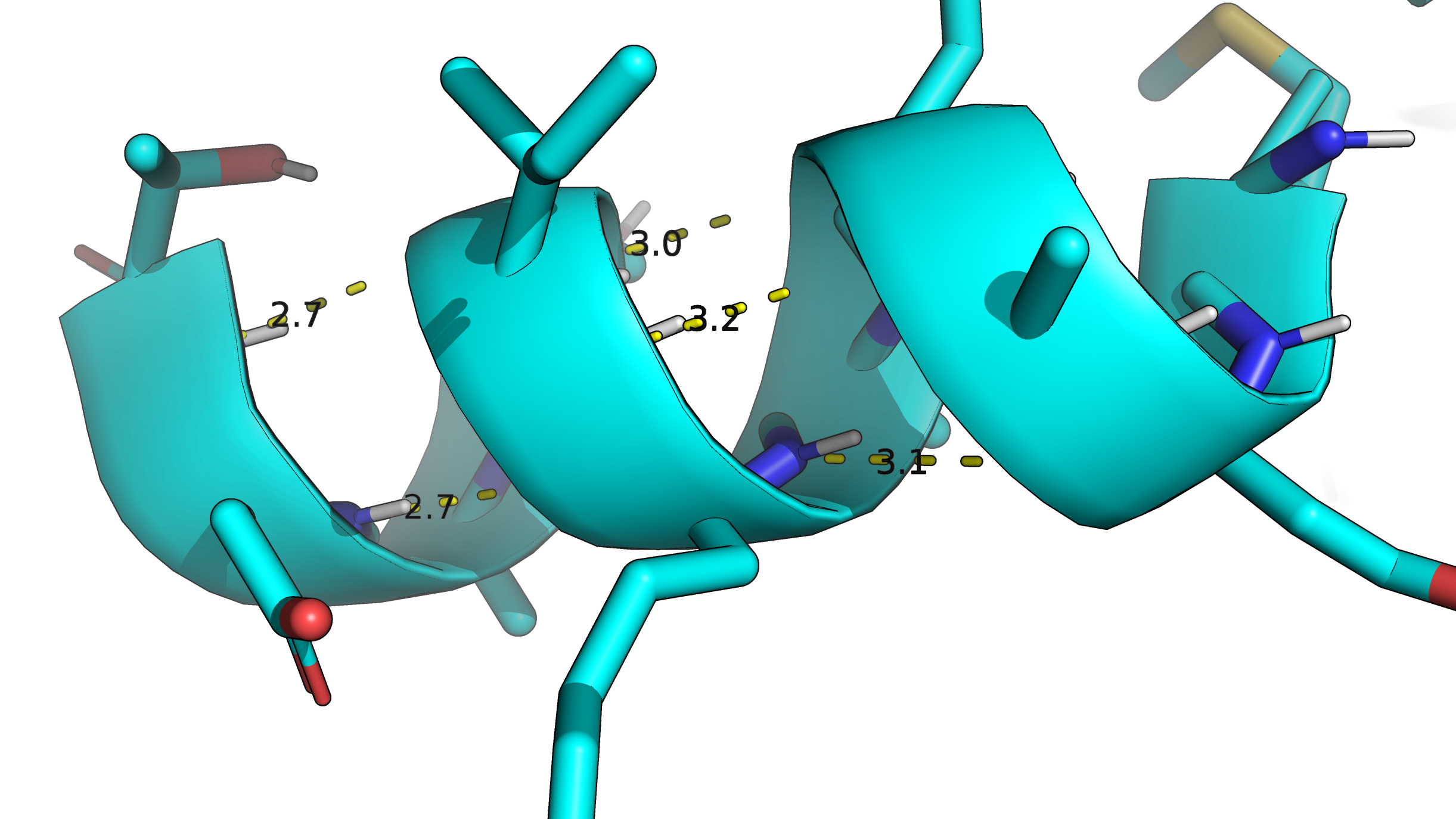
Водородная связь, затрагивающая атомы остова белка
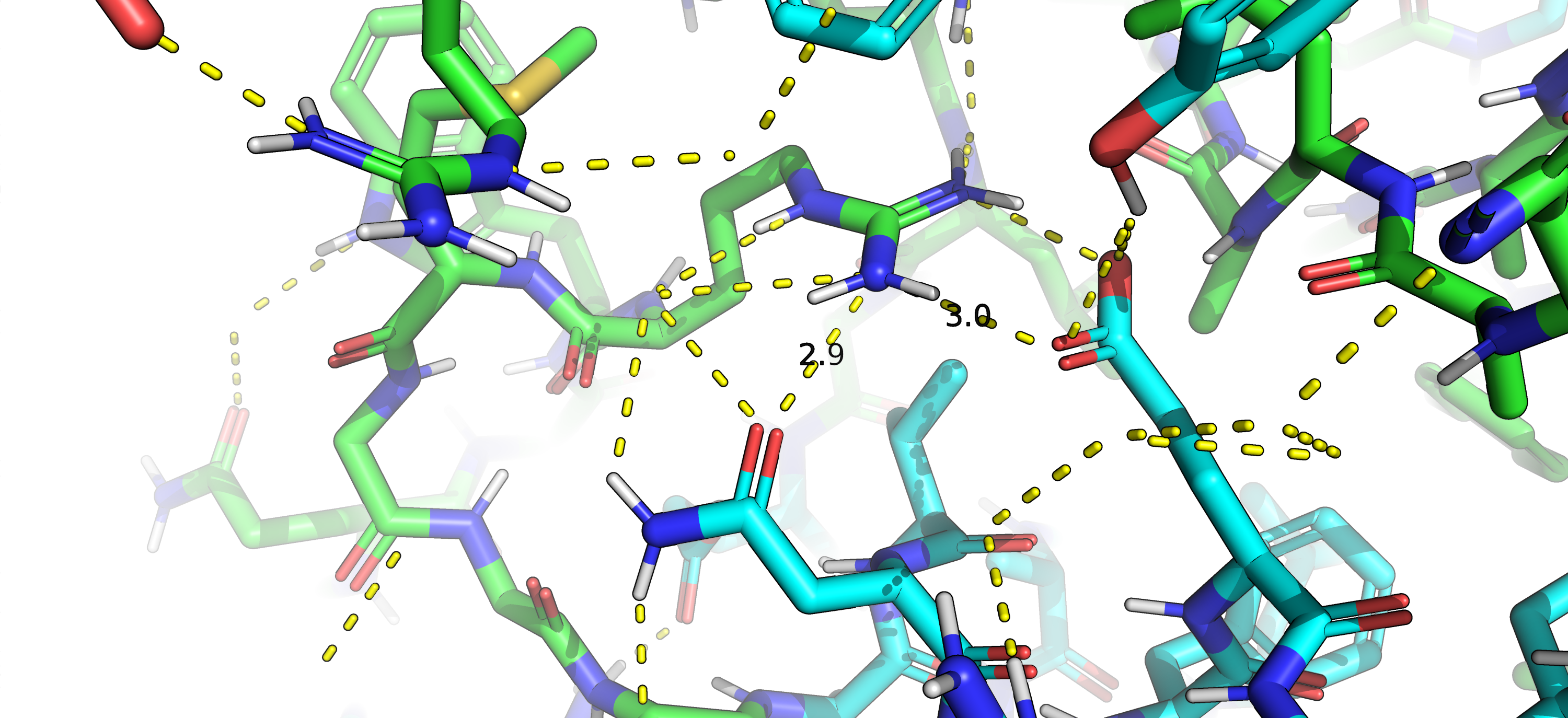
Вторичные структуры белка - α-спирали, β-слои - формируются при участии водородных связей. На изображениях представлены водородные связи в α-спиралях AHBA синтазы. Рассматривались два участка белка. Результаты для наглядности представлены в двух форматах - с отображением спирали (рис 1) и без (рис 2).
Водородная связь, затрагивающая атомы боковых радикалов аминокислот
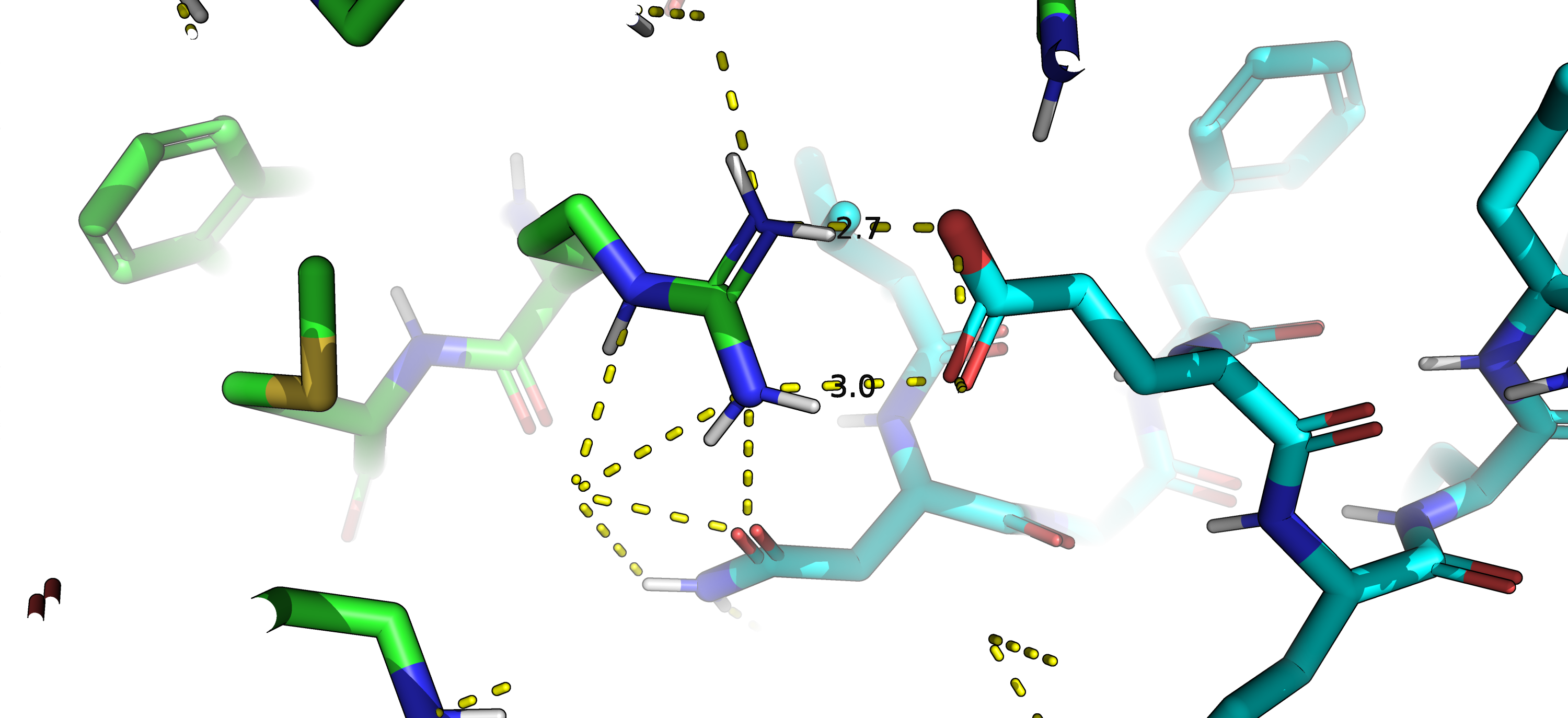
Водородная связь образуется между электроотрицательным атомом, содержащим неподеленную электронную пару, и водородом, ковалентно связанным с другим электроотрицательным атомом. Водородная связь является разновидность донорно-акцепторной. Расстояние между донором и акцептором: 2.5-3.5Å. В первом рассматриваемом случае в роли первого атома выступают атомы кислорода аспарагина и глутаминовой кислоты, а в роли втрого - атом азота аргинина, связанный с водородом (рис 3). Во втором случае водородная связь между аргинином и глутаминовой кислотой дублирует солевой мостик (рис 4).
Солевой мостик
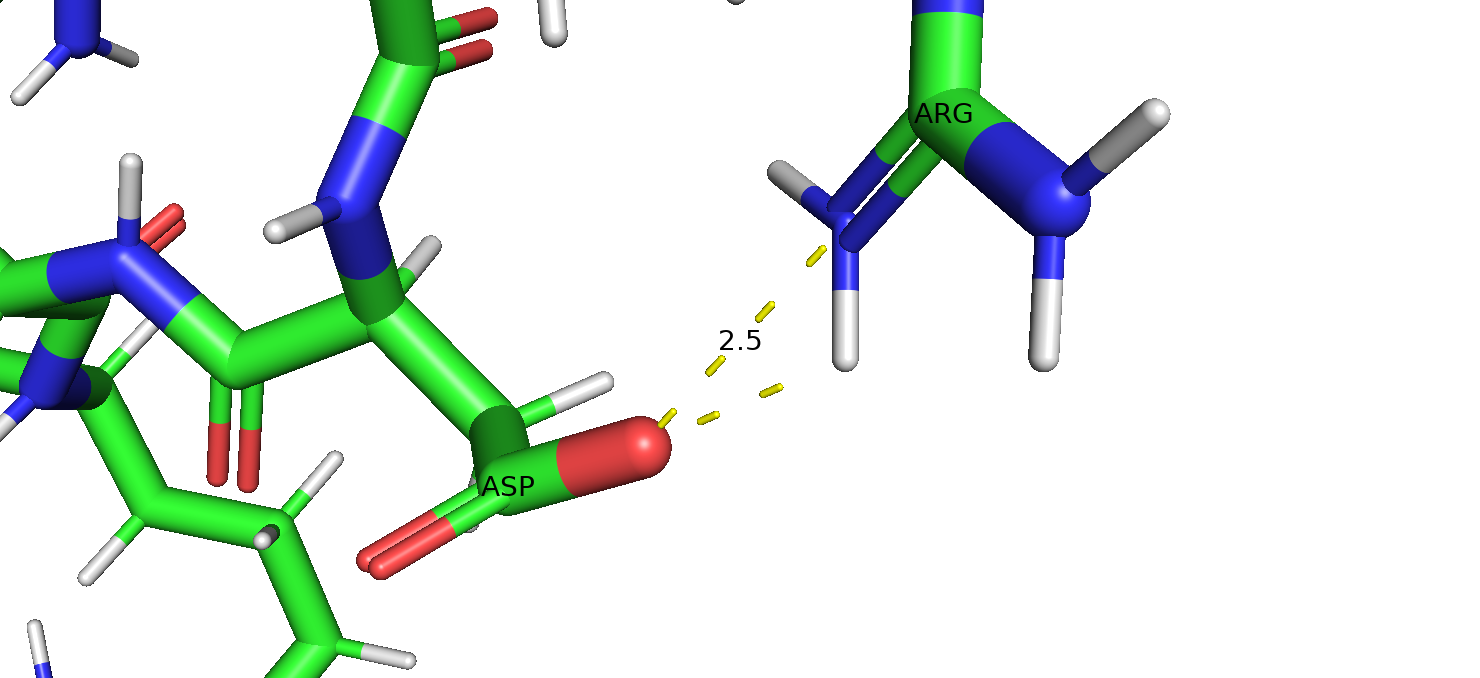
Солевые мостики представляют собой связи на основе электростатических взаимодействий между разнозаряженными атомами. Расстояие между противоионами: 3-4.5Å. В данном примере на атоме азота аргинина сосредоточен избыточный положительный заряд, на атоме кислорода аспарагиновой кислоты, наоборот, - отрицательный (рис 5). Такая связь также дублируется водородной (азот - донор, кислород - акцептор).
Дисульфидная связь
Дисульфидная связь образуется между атомами серы цистеинов. В AHBA синтазе содержатся цистеины, но в пространственной структуре они не располагаются вблизи и не помогают поддерживать третичную структуру (рис 6).
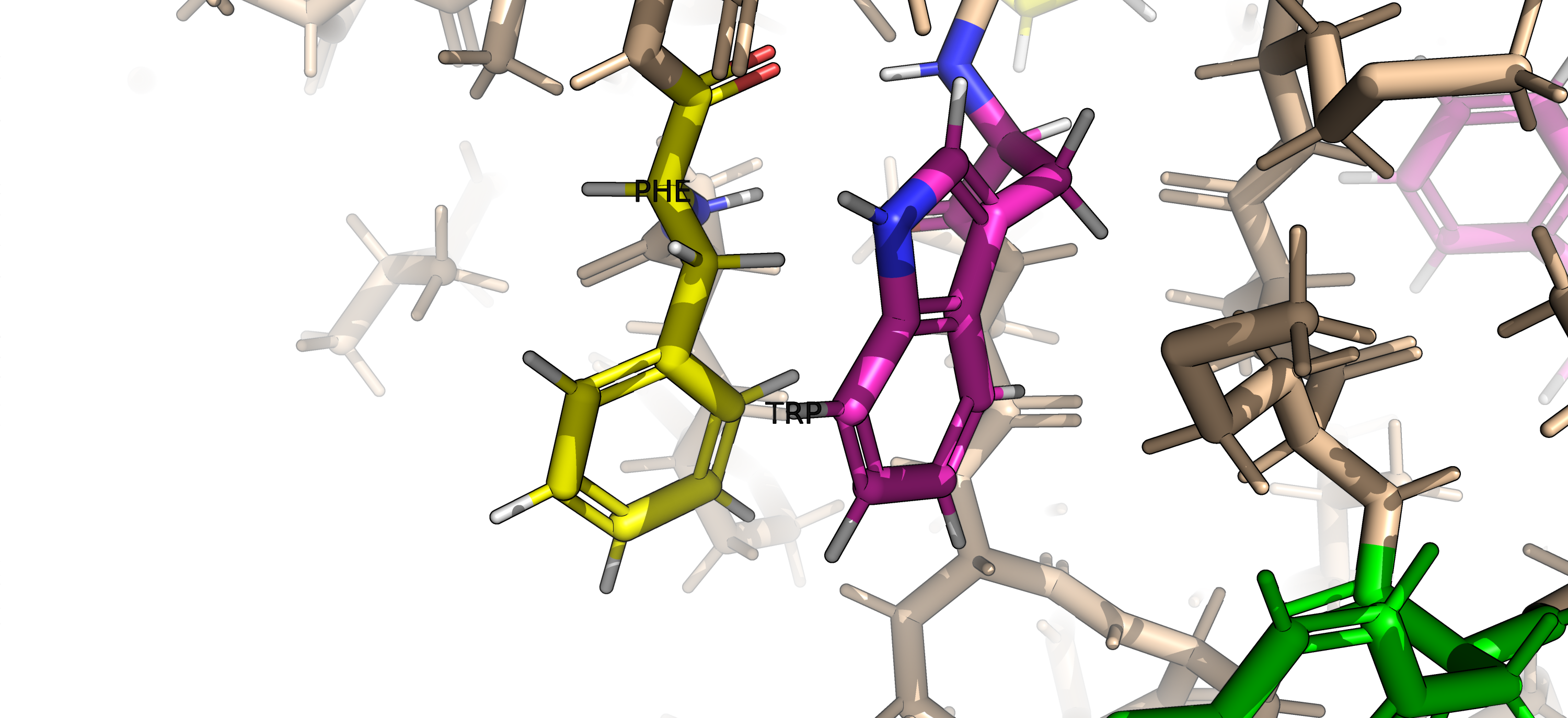
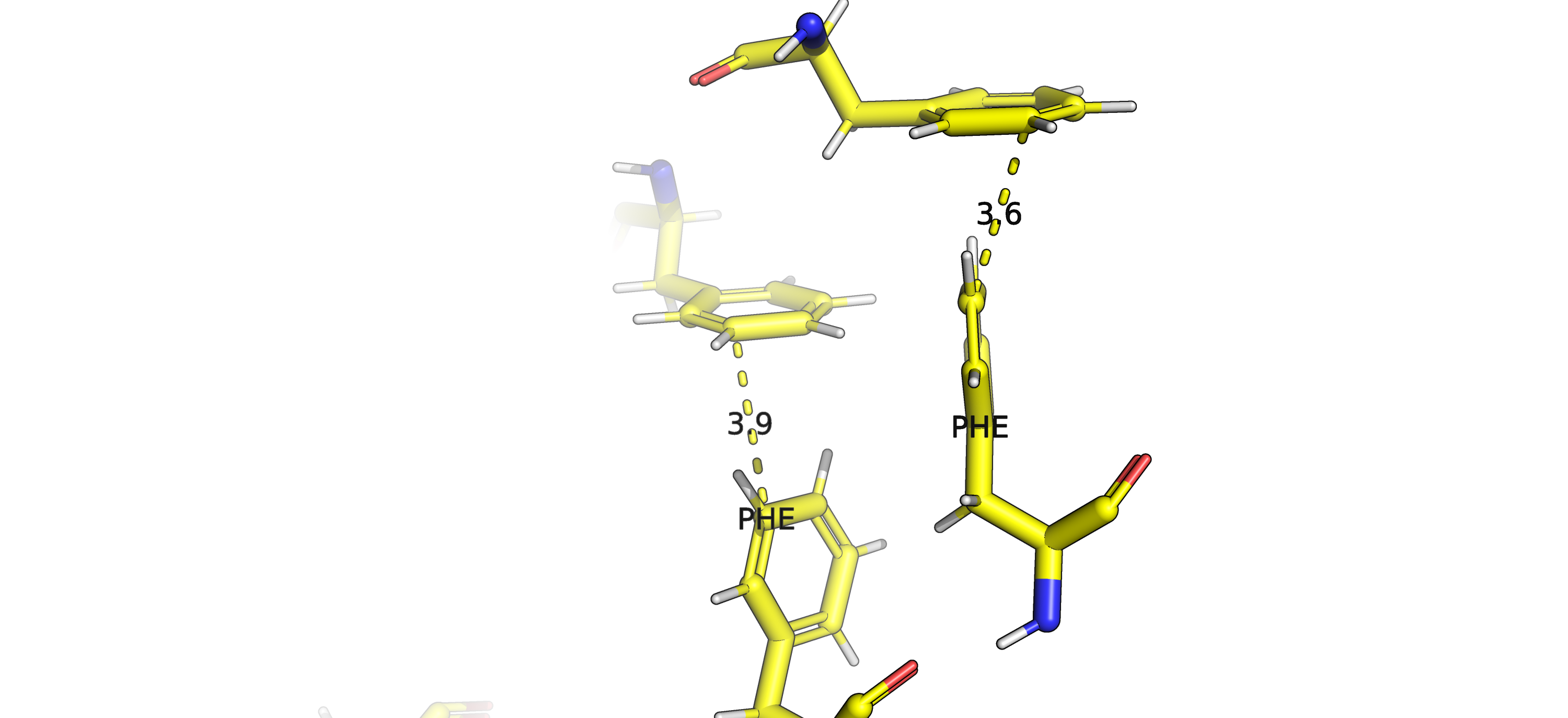
Стекинг
Стекинг представляет собой взаимодействие между ароматическими кольцами. Среднее расстояние между кольцами: 4-6Å. Он имеет электростатическую природу. В центре ароматического кольца сосредотачивается отрицательный заряд, а положительный - распределяется по поверхностям с обеих сторон. При взаимодействии отрицательного "ядра" одного кольца с положительным "краем" другого расположенные вблизи в пространстве кольца могут испытывать притяжение. Сущетсвует три вида стекинга: параллельно сдвинутый, T-стекинг и π-катионный. AHBA точно содержит параллельно сдвинутый стекинг (рис 7) и T-стекинг (рис 8).