Общая характеристика структуры 3BMX
| Идентификатор PDB | 3BMX |
| Название белка | Бета-N-гексозаминидаза |
| Количество цепей | 2 |
| Молекулы, не относящиеся к белку | Na+(4 иона),Ацетат ион (7 молекул), P4G(C8H18O3) 3 молекулы |
На рисунках 1-2 представлена структура белка:
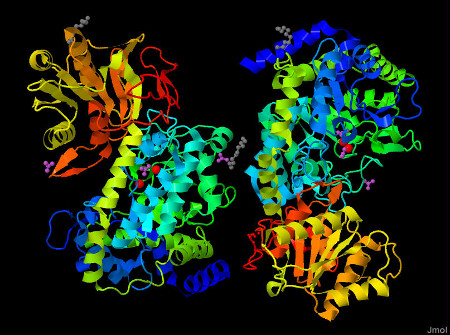
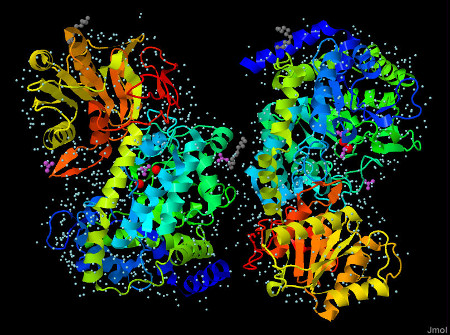
Рис. 1-2 Структура Бета-N-гексозаминидазы. Слева цепь А, справа - В. Цепи белка окрашены от N-конца к С-концу(от синего к красному). Красные шарики - ионы Na+. Пурпурные молекулы - ацетат ионы. Серые молекулы - 1-этокси-2-(2-этоксиэтокси)этана. На рисунке 2 белок представлен вместе с окружающими его молекулами воды(голубые шарики).
Анализ структуры альфа-спиралей и бета-листов в цепи А белка с кодом PDB 3BMX
Проведен анализ альфа-спирали, образованной аминокислотными остатками с 196 по 214 в цепи А, и крупного бета-листа. На рисунке 3 представлены эти структуры.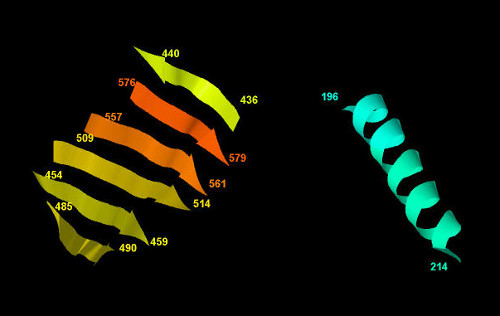
Рис. 3. Бета-лист (слева) и альфа-спираль (справа). Числа обозначают номера аминокислотных остатков в начале и конце спирали или каждого тяжа бета-листа.
Как видно из рисунка 4, длина альфа-спирали равна 2,779 нм, количество витков - 5.
Следовательно, средний шаг спирали равен 5,55 Å. (Рис.4)
Всего в спирали 19 аминокислотных остатков.
Следовательно, количество остатков, приходящихся на один виток, равно 19/5 = 3,8.
Остаток под номером n из середины спирали будет образовывать водородные связи с остатками с номерами
n-4 и n+4.(Рисунок 5, n=204).
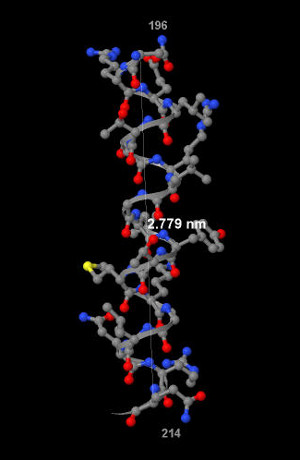
Рис.4. Шаг альфа-спирали. Серые атомы углерода, красные - кислорода, синие - азота, желтые - серы. Белой линией показано расстояние вдоль оси спирали, соответствующее полному витку.
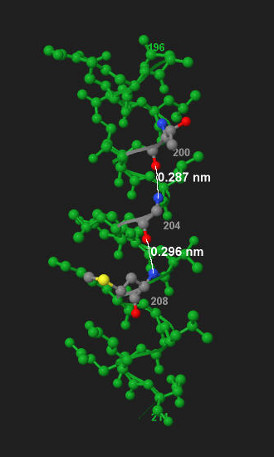
Рис.5. Водородные связи в альфа-спирали. Остаток с номером 204 образует водородные свзяи с остатками 200 и 208. Остальные остатки выделены зеленым цветом. Белой линией обозначены водородные связи, подписана их длина.
 Рис.6. β-лист. Тяжи из остатков 436-440 и 576-579 являются антипараллельными.
Остальные - паралельными.
Рис.6. β-лист. Тяжи из остатков 436-440 и 576-579 являются антипараллельными.
Остальные - паралельными.
В анализируемом β-листе имеются как паралелльные, так и антипаралелльные тяжи. (Рис.6). Паралельные тяжи - это тяжи,у которых N-конец одного тяжа соответствует N-концу другого(лежит параллельно). Антипаралельные тяжи - это тяжи, у которых N-конец одного тяжа соответствует С-концу другого (лежит антипараллельно).
 Рис.7. Выгнутая форма β-листа.
Рис.7. Выгнутая форма β-листа.
Анализируемый β-лист имеет выгнутую поверхность. Изгиб приходится на примерную середину листа (Рис.7).
Внутримолекулярные взаимодействия боковых групп белка в цепи В структуры 3BMX
Остатки цистеина в молекуле белка не обнаружены.
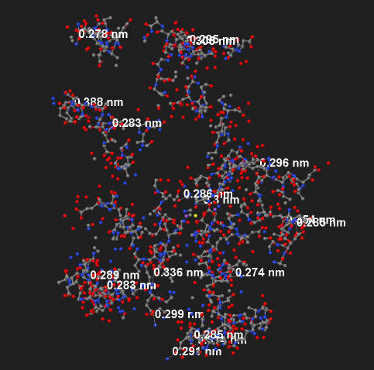 Рис.8. Примерное количество солевых мостиков в цепи В. Цифры показывают
длину связи солевого мостика.
Рис.8. Примерное количество солевых мостиков в цепи В. Цифры показывают
длину связи солевого мостика.
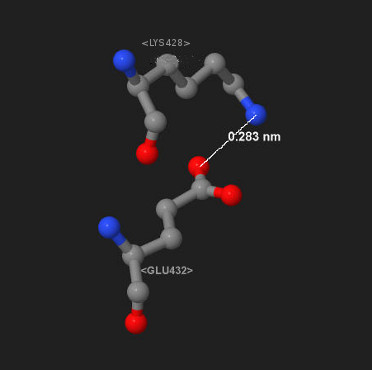 Рис.9. Солевой мостик между Glu432 и Lys428. Белой линией отмечена линия связи.
Синим цветом обозначены атомы азота, красным - кислорода, серым - углерода.
Рис.9. Солевой мостик между Glu432 и Lys428. Белой линией отмечена линия связи.
Синим цветом обозначены атомы азота, красным - кислорода, серым - углерода.
В цепи В имеется достаточно большое количество остатков глутаминовой и аспаригоновой кислот. Многие из них образуют солевые мостики с лизином и аргинином. На рисунке 8 представлено их примерное количество.
Рисунок 9 наглядно отражает геометрическое расположение молекул при образовании солевого мостика. Связь возникает в результате электростатического притяжения атома азота, несущего положительный заряд, и атома кислорода (OD2), несущего отрицательный заряд.
 Вконтакте
Вконтакте allakarpova@kodomo.fbb.msu.ru
allakarpova@kodomo.fbb.msu.ru vseokeyboss@gmail.com
vseokeyboss@gmail.com