Лиганды в структуре 3BMX
Структура 3BMX белка Бета-N-гексозаминидаза имеет 3 типа лигандов:
- Ион Na+
- Ацетат ион
- 1-этокси-2-(2-этоксиэтокси)-этан - P4G (Рис.1).
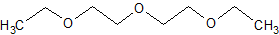
Рис.1. Структура лиганда P4G структуры 3BMX белка ybbD.
На рисунке 2 представлены все лиганды, встречающиеся в структуре 3BMX:
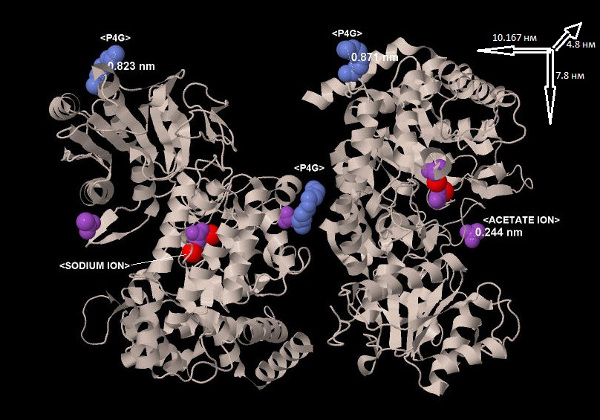
Рис.2. Лиганды в структуре 3BMX. Цепи белка обозначены бежевым цветом, красным - ионы натрия, сиреневым - ацетат ионы, голубым - P4G. В правом верхнем углу указаны размеры белка по трем осям. Также указано расстояние между самыми дальними атомами лигандов.
Белок имеет на 1-2 порядка большие размеры, чем лиганды, что видно из рисунка 2. В таблице 1 указаны размеры всех лигандов:
| Лиганд | Размеры в Å | Размеры в нм | Размеры в м |
| Na+ | 0,95 | 0,095 | 9*10-11 |
| Ацетат ион | 2,44 | 0,244 | 2,44*10-10 |
| P4G | 8,5 | 0,85 | 8,5*10-10 |
Табл.1. Размеры лигандов в структуре 3BMX.
Несколько слов о лигандах: ацетат ион - это анион уксусной кислоты, имеет заряд -1,
в пространстве имеет форму плоского треугольника, молекулы ацетат иона расположены в белке
либо на его поверхности рядом с неструктурированными участками, либо внутри каждой цепи,
координируя ионы натрия. Возможно, эти лиганды есть кофакторы, изменяющие конформацию белка, приводя его в
рабочее состояние, а также меняющие заряд белка на более отрицательный.
1-этокси-2-(2-этоксиэтокси)-этан - это простой полиэфир без каких-либо функциональных групп, а
следовательно, можно сказать, гидрофобный. Одна молекула P4G находится между двумя субъединицами белка, она
помогает двум субъединицам правильно ориентироваться относительно друг друга, тем самым правильно сформировать
активный центр белка. Две другие молекулы P4G располагаются сверху двух цепей, и т.к. белок
мембранный, то можно предположить, что эти они помогают белку удерживаться в мембране.
Анализ области контакта белка из структуры PDB 3BMX и лиганда P4G
Напоминаем, что на рисунке 2 лиганд P4G обозначен голубым цветом.
Так как этот лиганд имеет длинную углеродную цепь, то его положение координируется гидрофобными участками
аминокислот, таких как тирозин, лизин, аргинин, фенилаланин, изолейцин, лейцин, глутамат и глутамин (Рис.3). Все эти
аминокислоты имеют, как минимум, 2 углерода в радикале; складываясь вместе, они образуют гидрофобный карман, в который
помещается молекула P4G.
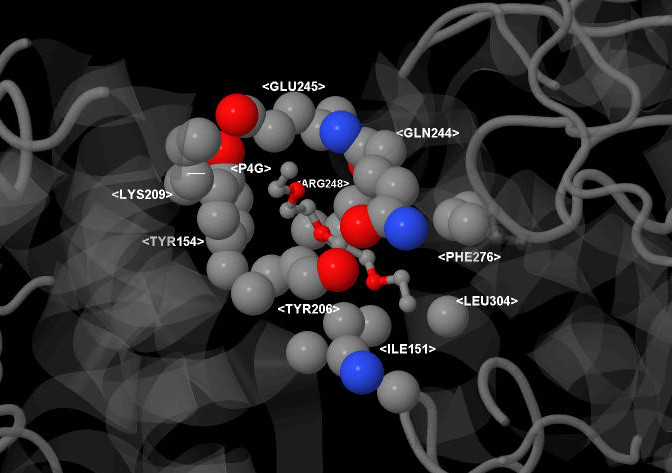
Рис.3. Связь лиганда P4G с белком в структуре 3BMX. Более крупными шарами показаны аминокислоты, образующие карман, более мелкими шарами - лиганд P4G.
На рисунке 4 изображена схема связей между лигандом P4G и аминокислотами, образующими карман. Отметим,
что все эти взаимодействия являются гидрофобными.
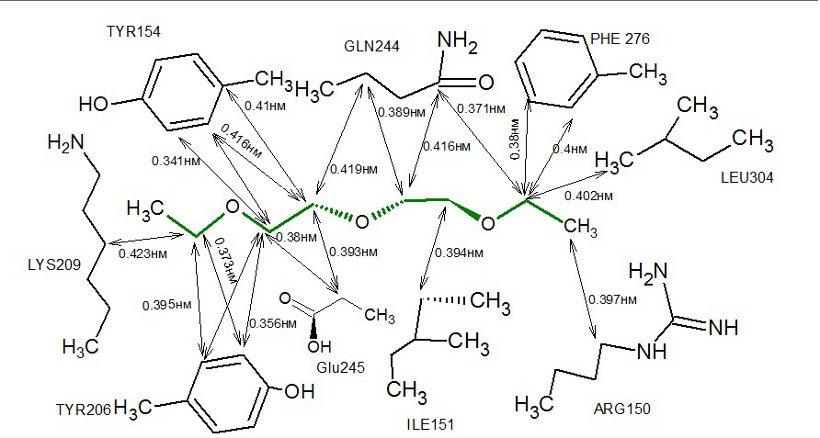
Рис.4. Схема гидрофобных взаимодействий лиганда P4G (зеленый) с окружающими аминокислотными остатками (черный). Двойными стрелками показаны гидрофобные взаимодействия, а также указаны расстояния между взаимодействующими атомами.
Для получения изображения белка в JMol, как на рисунке 2, а затем и как на рисунке 3, можно воспользоваться этим скриптом.
Проект генно-инженерного эксперимента с белком из структуры 3BMX
Известно, что при замене определенных аминокислот, связывающих лиганд с белком, может случиться
так, что белок утратит способность связываться с этим лигандом и тогда, возможно, потеряет
свою активность, а может случиться так, что эта замена не внесет сильных изменений
в геометрию белка и не ухудшит его сродство к лиганду.
Рассмотрим, какие же точечные мутации могут произойти в белке ybbD, чтобы он потерял своё
сродство к лиганду.
Во-первых, лиганд координируется во многом за счет ароматического тирозина и глутамина, которые
формируют довольно протяженную стенку кармана и имеют наибольшее число связей с P4G.
Если, в результате точечных мутаций, заменить TYR206, TYR154 и GLN244 на те, которые имеют короткий радикал
(лучше заряженный или полярный), то можно получить белок, неспособный связаться с данным лигандом. Для этих целей
подойдут, например, глицин, аспарагиновая кислота, цистеин и метионин. Т.к. TYR206 и TYR154
из цепи В, а GLU245 - из А, то без них, как основополагающих в связывании P4G, невозможно будет соединение двух цепей, а
значит и возникновение хоть каких-нибудь гидрофобных взаимодействий других аминокислот и лигандом. Следовательно, способность
белка свзяывать лиганд будет утеряна.
Во-вторых, можно уменьшить пространство кармана за счет замены, например, GLU245 на TRP245. Массивный радикал
триптофона исказит внутреннюю поверхность полости, в которую помещается лиганд, поэтому последний там не сможет расположиться
должным образом.
Теперь рассмотрим какие точечные мутации не приведут к потери этой способности.
Во-первых можно заменить не столь важные аминокислоты на похожие. В частности, GLU245 на GLN245, LEU304 на VAL304, PHE276 на TYR276.
Во-вторых, TYR154 и TYR206 возможо заменить на фенилаланин, сохранив нужную поверхность кармана и достаточно большое
количество гидрофобных связей.
 Вконтакте
Вконтакте allakarpova@kodomo.fbb.msu.ru
allakarpova@kodomo.fbb.msu.ru vseokeyboss@gmail.com
vseokeyboss@gmail.com