Запросы в PubMed
| Запрос | Запрос как его понял PubMed | Всего находок | Всего в открытом доступе | Всего обзоров |
| (ras protein[Title]) AND functions[Title/Abstract] | ras protein[Title] AND functions[Title/Abstract] | 9 | 4 | 2 |
| (ras proteins[Title/Abstract]) AND Hancock[Author] | ras proteins[Title/Abstract] AND Hancock[Author] | 36 | 22 | 6 |
| (ras proteins[Title/Abstract] OR ras pathway[Title/Abstract]) AND Olson[Author] | ras proteins[Title/Abstract] AND Hancock[Author] | 9 | 3 | 4 |
| (Related Citations for PubMed (Select 10727422) | "ADP-ribosylation of oncogenic Ras proteins by pseudomonas aeruginosa exoenzyme S in vivo". Related citations | 250 | 130 | 18 |
| (Related Citations for PubMed (Select 23419283) | "Ras nanoclusters: a new drug target?". Related citations | 97 | 68 | 5 |
Ras effector pathway activation by epidermal growth factor is inhibited in vivo by exoenzyme S ADP-ribosylation of Ras
В данном исследовании были проанализирован результат присоединение АДФ-рибозы к Ras белку экзоэнзимом S (ExoS), выделенным из Pseudomonas aeruginosa. Для этого в линии клеток HeLa и NIH3T3 был введен белок ExoS с помощью секреционной системы 3 типа (T3SS) грам-отрицательной бактерии Yersinia Pseudotuberculosis, что привело к изменению соотношения ГТФ/ГДФ, напрямую связанного с Ras-белком in vivo. Это подавило способность Ras связывать домен Raf при стимуляции эпидермальным фактором роста (ЭФР). В настоящем исследовании показано, что активность ExoS не пересекается ни с EGF-рецептором, ни с образованием Grb-2-активируемого Shc комплекса при действии ЭФР, а согласуется с блокировкой митогенного сигнального пути экзоэнзимом S на уровне Ras. В результате было определено влияние введения ExoS на эффекторный путь Ras.
Введение
Белки суперсемейства Ras участвуют в передаче сигнала, возникшего в ответ на какие-то внешние факторы, например, эпидермальный фактор роста (ЭФР). При стимуляции ЭФР образуется комплекс между белками адапетрами Shc и Grb2, вызывая гуанин нуклеотидный фактор обмена и приводя к активации Ras. Ras - низкомолекулярные G-белки, активные, когда связаны с ГТФ, и неактивные, когда связаны с ГДФ. Ras играет ключевую роль в активации каскада митоген-активирующих протеин киназ(MAPK), что связано с контролируемым и некотролируемым размножением клеток. ExoS принадлежит к семейству АДФ-рибозилирующих токсинов. Он имеет 2 домена: N-концевой домен, гомологичный домену бактериального токсина из Yersinia, вызывает разрушение актина в микрофиламентах; С-концевой домен имеет АДФ-рибозилирующую активность, что оказывается смертельным для эукариотических клеток. Каталитическая активность ExoS зависит от фактора активации ExoS. Раньше было показано, что ExoS (продуцированный штаммом Ps. aeruginosa 388) может АДФ-рибозилировать с-На-Ras in vitro. Но никто ещё не показал, как это влияет на сигнальный путь Ras in vivo. В настоящем исследовании представлено, как С-концевой домен ExoS модифицирует Ras in vivo, как это дает большое число ГДФ-связанного белка Ras, была рассмотрена способность Ras быть активированным ЭФР-рецептором, невозможность взаимодействия Ras-Raf при действии ЭФР. Также было показано, что активность ExoS никак не связана с фосфорилированием ЭФР-рецептора или с образованием Grb-2-активируемого Shc комплекса. Было выяснено, что модификация Ras ингибирует фосфорилирование MAPK.
Эксперимент
Штаммы бактерий, плазмиды и антитела.
Y. Pseudotuberculosis экспрессирует дикий тип и точечной
мутированный ген ExoS, YPIII (pIB251, pTS103), и YPIII (pIB251, pTS106). Стандартными методами делеции были получены
мутанты YPIII (pIB251, pTS103) и YPIII (pIB251, pTS106)с вырезанными 98-232 нуклеотидами. Плазмиды pTS106, pTS103
были вырезаны белком EagI и снова лигированны с делецией 289-694 нуклеотидов. Также в исследовании были использованы
К-Ras и H-Ras антитела, моноклональные антитела к фосфотирозину 4G10, поликлональные антитела к человеческому Shc и
ЭФР-рецептору,антитела к МАРК и фосфо-МАРК.
Клеточная культура, лизис и падение иммунитета.
HeLa и NIH3T3 были выращены в минимально необходимой среде. После
инфецирования и стимуляции ЭФР в течение 2 минут, клетки были дважды промыты и лизированы специальным буфером с добавлением ингибитора
протеаз. Лизат был очищен центрифугированием, такой же объем был обработан в течение часа GST-белками и в течение 30 минут белком
G-агарозы. Затем 4 раза промыт, а затем прокипячен в SDS/PAGE буфере.
P-маркирование клеток HeLa in vivo.
Измерение нуклеотид-связанного Ras в HeLa и NIH3T3. HeLa
были метаболическим путем помечены 32P в течение ночи. Клетки различное время
обрабатывали диким типом ExoS и стимулировали ЭФР в течение 2 минут. Образцы с подавленным иммунитетом были разделены полиэтилениминцеллюлозной тонкослойно хроматографией
и проанализированны с помощью PhosphoImager.
АДФ-рибозлирование Ras in vitrо.
Анализ АДФ-рибозлирования in vitro было выполнено, как описывала Фритц-Линдстен: 10 µl ExoS были добавлены к лизату клеток
HeLa и инкубированы с [32P]НАД в течении 1 часа при 37°С. Затем образцы подверглись электрофорезу и иммуноблотингу.
Результаты
АДФ-рибозилирование Ras экзоэнзимом S.
Были использованы дикий тип ExoS, ExoS мутанты, ExoS(E381A), ExoS(D98-232) и
ExoS(D98-232, E381A). Показано, что АДФ-рибозилирование Ras связано с С-концевым доменом ExoS, что 381 остаток является ключевым в АДФ-рибозилазной аткивности ExoS.
Мутанты ExoS(D98-232) и ExoS(D98-232, E381A) составлены на основе гомологии между N-концевыми половинами ExoS и YopE.
Для оценки модификации Ras in vivo клетки HeLa были инфицированы несколько раз. По прошествии 15 минут Ras показал медленную подвижность
на электрофорезе. После 40-80 минут весь белок Ras был модифицирован, и все клетки были с разрушенным актином в микрофиламентах. Этого не наблюдалось при действии мутанта ExoS(E381A).
Мутант ExoS(D98-232) аткже эффективно модифицирует Ras, как и дикий тип ExoS, а ExoS(D98-232, E381A) показывает низкую каталитическую активность, как
и ExoS(E381A).
Ингибирование экзоэнзимом S активности Ras, обусловленной ЭФР.
В этой части исследователи измеряли соотношение ГТФ/ГДФ-связанного Ras in vivo. Меченные фосфором-32 линии клеток
HeLa и NIH3T3 были инфецированны несколько раз разными видами белка ExoS. Ras был иммунопреципитирован, а потом подвергся тонкослойной хроматографии
в присутствии меченных нуклеотидов. АДФ-рибозилирование не повлияло на иммунопреципитацию Ras c использованием антитела Y13-259.
На рисунке 1 можно увидеть, как менялось соотношение ГТФ/ГДФ-связанного Ras. У клеток инфицированных диким типом ExoS(А) наблюдалось уменьшение
ГТФ-связанного Ras c 12% до 5%. Стимуляция ЭФР не инфецированных клеток(-) в течение 2 минут привела к возрастанию в 6-7 раз
уровня ГТФ-связанного белка. После 80 минут инфицированные ExoS клетки показали, что только 11% Ras находится в комплексе с ГТФ.
В противоположность, инфецирование ExoS(E381A)(В) или смоделированное инфецирование(М) не ингибировало образование комплекса Ras-ГТФ в ответ на ЭФР.
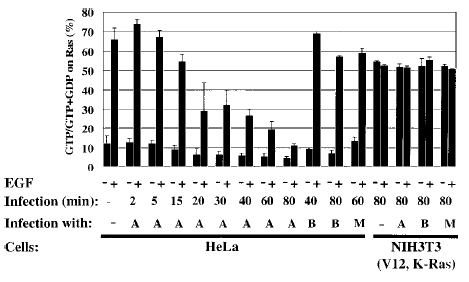
Рис.1.[1]
Было выяснено влияние ExoS на связывание Ras-ГТФ с Raf1. Для этого лизаты клеток HeLa, зараженных разными видами ExoS, инкубировали
с блоком белков GST-Raf-RBD, после вымывания образцы подверглись электрофорезу. Результаты можно увидеть на рисунке 2.
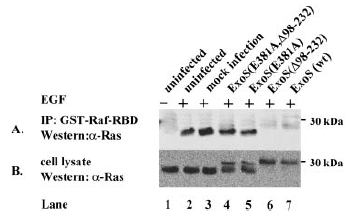
Рис.2.[1]
Действие ЭФР на неинфецированные клетки увеличило сродство Ras к GST-Raf-RBD. Cовместного осаждения этих белков не наблюдалось у образцов, зараженных диким типов ExoS или ExoS(D98-232), и наоборот, наблюдалось у образцов, инфецированных ExoS(D98-232, E381A) и ExoS(E381A). ExoS не влияет на фосфорилирование ЭФР-рецептора или на образование Shc-Grb2 комплекса.
Были предприняты попытки изучения влияния ExoS на другие части сигнального пути Ras. Опять клетки HeLa были заражены,
лизированы и иммуноблотированы с антителом фосфотирозина. Добавление на 2 минуты ЭФР привело к фосфорилированию по тирозину белка весом в 170кДа, это оказался
ЭФР-рецептор.
Чтобы определить фосфорилируется ли тирозин белков-адаптеров Shc после действия ЭФР, инфецированные клетки HeLa стимулировались
ЭФР, а клеточные лизаты подверглись иммунопреципитации с поликлональными антителами к Shc сразу после иммуноблотинга с 4G10 фосфотирозин-антителами.
Фосфотирозин-белки были обнаружены у всех клеток, которые были стимулированы ЭФР, они отсутствовали только у линии не стимулированных клеток.
Далее было показано, что эти белки оказались Shc-белками, и что их фосфорилироваине не повлияло на способность образовывать комплекс
Shc-Grb2, т.е. его образование никак не зависит от инфецирования экзоэнзимом S.
Ингибирование ExoS дальнейшей передачей сигнала в сигнальном пути Ras.
Первая цель активированного Ras - это Raf, компонент каскада, который приводит к активации MAPK (Erk1/2). Другая цель Ras -
это фосфотиидлинозитол-3-киназа, которая активирует серин/треонин киназу(PKB/Akt). Активированные формы Erk 1/2 и PKB/Akt после стимуляции
ЭФР были обнаружены во вскх линиях клеток. Однако, они исчезали после 60 минут воздействия ЭФР у клеток, инфецированных диким типом ExoS и
ExoS(D98-232). Такого эффекта не наблюдалось у клеток, инфецированных ExoS(E381A) и ExoS(D98-232, E381A), что подтверждает,
что они не могут блокировать фосфорилирование PKB/Akt и Erk1/2 при стимуляции ЭФР.
 Вконтакте
Вконтакте allakarpova@kodomo.fbb.msu.ru
allakarpova@kodomo.fbb.msu.ru vseokeyboss@gmail.com
vseokeyboss@gmail.com