Задание №0
| PDB код | Тип | Какая мембрана | Толщина гидрофобной части мембраны в ангстремах | Медиана числа остатков в одном трансмембранном участке |
| 2yev | Спираль | Внутрення мембрана Грам-положительной бактерии Thermus thermophilus | 31.2 ± 0.8 Å | 24 |
| 4iar | Спираль | Клеточная мембрана эукариотической клетки (Homo sapiens) | 33.6 ± 1.8 A | 24 |
| 3wo7 | Спираль | Внутренняя мембрана Грам-положительной бактерии Bacillus halodurans | 29.0 ± 1.3 Å | 23 |
| 2lhf | Бета-бочонок | Внешняя мембрана Грам-отрицательной бактерии Pseudomonas aeruginosa | 20.6 ± 0.6 Å | 8 |
| 3fid | Бета-бочонок | Внешняя мембрана Грам-отрицательной бактерии Salmonella enterica | 25.6 ± 2.0 Å | 10 |
| 3b07 | Бета-бочонок | Клеточная мембрана Грам-отрицательной бактерии Pseudomonas fluorescens ) | 24.2 ± 1.2 Å | 9 |
Отбор гомологов белка Twin Arginine Translocase Receptor
Код pdb - 4HTS.Бактерия, к которой принадлежит данный белок, относится к филуму Aquificae, поэтому для поиска BLAST были исключены все бактерии из этого филума. Поиск выполнялся по базе данных RefSeq, с порогом e-value 0.01. Были отобраны следующие гомологи: ссылка.
Анализ структуры белка Twin Arginine Translocase Receptor
В базе данных OPM находится мой белок по идентификатору pdb, в информации о белке есть TC-код семейства в базе данных TCDB - 2.A.64.| PDB код | Организм | Тип мембраны | TC-код | Угол наклона спиралей к нормали | Количество трансмембранных спиралей |
| 4HTS | Aquifex aeolicus | Внутренняя мембрана Грам-отрицательной бактерии | 2.A.64 | 17 ± 0° | 6 |
Таблица 1.Описание структуры трансмембранного белка Twin Arginine Translocase Receptor(идентификатор PDB 4HTS, цепь A).
Идентификатор самого белка в TCDB осутствует, зато есть идентификатор семейства, к которому принадлежит данный белок:
2.А.64 - The Twin Arginine Targeting (Tat), семейство
2.A - Porters (uniporters, symporters, antiporters), подкласс
2 - Electrochemical Potential-driven Transporters - Потенциал-чувствительные транспортеры, класс.
Анализ множественного выравнивания трансмембранных белков
Выбранные ортологи и выданный белок были выровнены в JalView с помощью алгоритма Muscle. Последовательность выданного белка была проассоциирована с pdb структурой, на выравнивании новой строчкой были отмечены те аминокислоты, которые образуют трансмембранные альфа-спирали Затем были предсказани трансмембранные спирали одного из ортологов из бактерии Thermodesulfovibrio yellowstonii, предсказанные спирали были отмечены на новой строчке выравнивания. Выравнивание окрашивалось по гидрофобности аминокислот с добавлением By Conversation, красные аминокислоты - гидрофобные, синие - гидрофильные.
Рис.1. Выравнивание ортологов белка Twin Arginine Translocase Receptor с ним же самим, окраска по гидрофобности и консервативности аминокислот, красные аминокислоты - гидрофобные, синие - гидрофильные. В поле TM_REAL отражены трансмембранные спирали последовательности выданного белка, согласно его PDB-структуре. В поле TM_REAL отражены предсказанные трансмембранные спирали, одного из ортологов (ref|YP_002248738.1|[Thermodesulfovibrio yellowstonii DSM 11347])
Окраска распространяется и на PDB структуру, ассоциированную с последовательностью. Белок был расположен так, чтобы наверху была p-сторона (+), внизу - n-сторона(-).
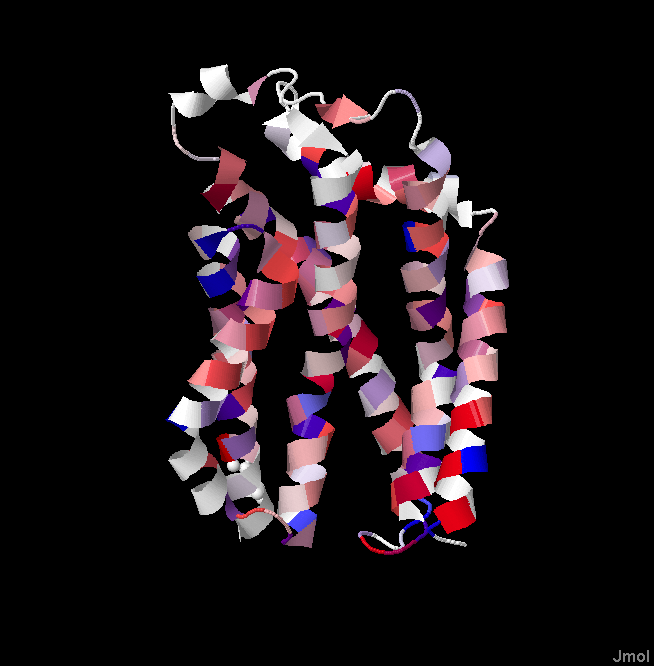
Рис.2. PDB структура белка Twin Arginine Translocase Receptor с окраской по гидрофобности и консервативности. Красные участки - гидрофобные аминокислоты, синие - гидрофильные.
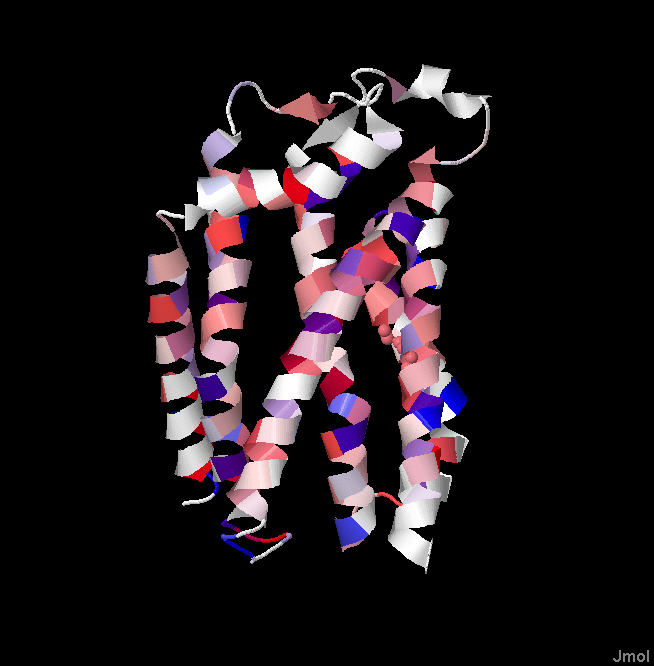
Рис.3. PDB структура белка Twin Arginine Translocase Receptor с окраской по гидрофобности и консервативности, вид с другой стороны. Красные участки - гидрофобные аминокислоты, синие - гидрофильные.
Мой белок является одной субъединицей белкового комплекса транслоказы. Все трансмембранные спирали консервативны в ортологах. Чаще всего встречаются гидрофобные аминокислоты - лейцин, изолейцин, валин, аланин, фенилаланин. Также в каждой спирали обязательно встречаются и гидрофильные аминоксилоты (лизин, аргинин, глутомат, аспартат, триптофан, тирозин), которые ,вероятно, нужны для взаимодействия спиралей между собой и субъединиц белкового комплекса. Обычно гидрофильные аминокислоты в разных спиралях обращены друг на друга, что позволяет стабилизировать пространственное расположение спиралей в мембране. Если гидрофильные аминокислоты торчат в стороны, то, скорее всего, они служат для связи субъединиц. Также в спиралях или сразу после них консервативно присутствует пролин, который нужен для изгиба спирали или петли.
Про консервативность межспиральных участков нельзя однозначно сказать, со стороны p-стороны все петли неконсервативны, но консервативен бета-тяж маленького бета-листа (быть может с этим участком взаимодействует лиганд). Со стороны n-стороны все петли проявляют высокую консервативность, возможно, тоже для взаимодействия с субстратом/лигандом.
Предсказанные альфа-спирали, как правило, меньше реальных, предсказанные накладываются на две реальных, такое ощущение, что предсказанные сдвинуты относительно реальных. Это можно объяснить тем, что программа пытается исключить из трансмембанной спирали гидрофильные участки, она ведь не знает, что это субъединица большого комплекса и полярные а.к. нужны для связывания субъединиц.
 Вконтакте
Вконтакте allakarpova@kodomo.fbb.msu.ru
allakarpova@kodomo.fbb.msu.ru vseokeyboss@gmail.com
vseokeyboss@gmail.com