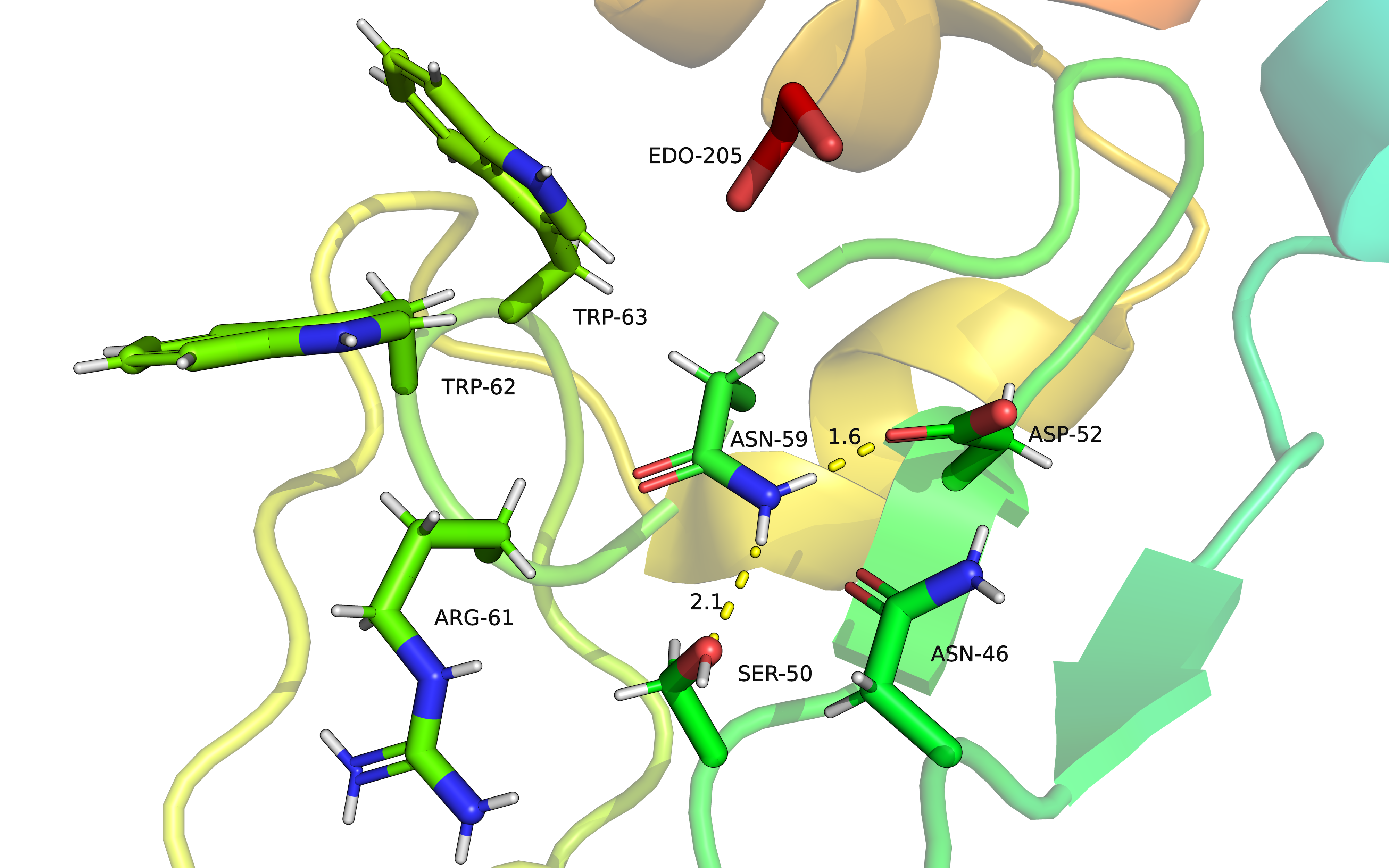
В данном состоянии остаток ASN-59 формирует водородные связи с остатками SER-50 и ASP-52 и является донором связей. Является, вероятно, наиболее стабильной структурой за счет наличия нескольких стабилизирующих взаимодействий.
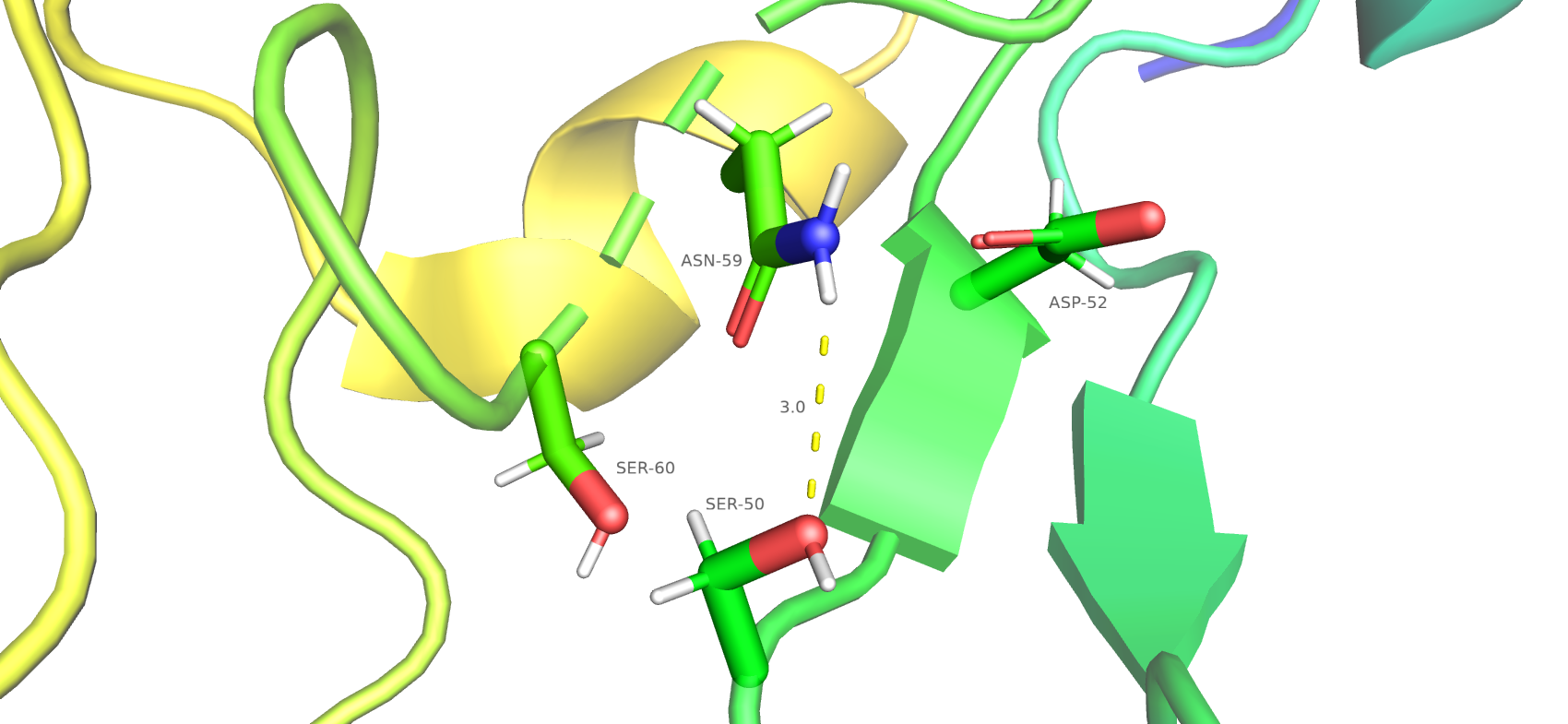
Следующий альт-лок В, на мой субъектиный взгляд, не имеет стабилизирующих взаимодействий. Можно подумать, что возможна водородная связь между ASN-59 и SER-50, углы C-O-H и C-O-N больше 90 градусов, но расстояние от Н аспаргина до О серина равно 3 Å. Все это говорит о том, что водородная связь может быть, а может и не быть, не все условия образования соблюдены.
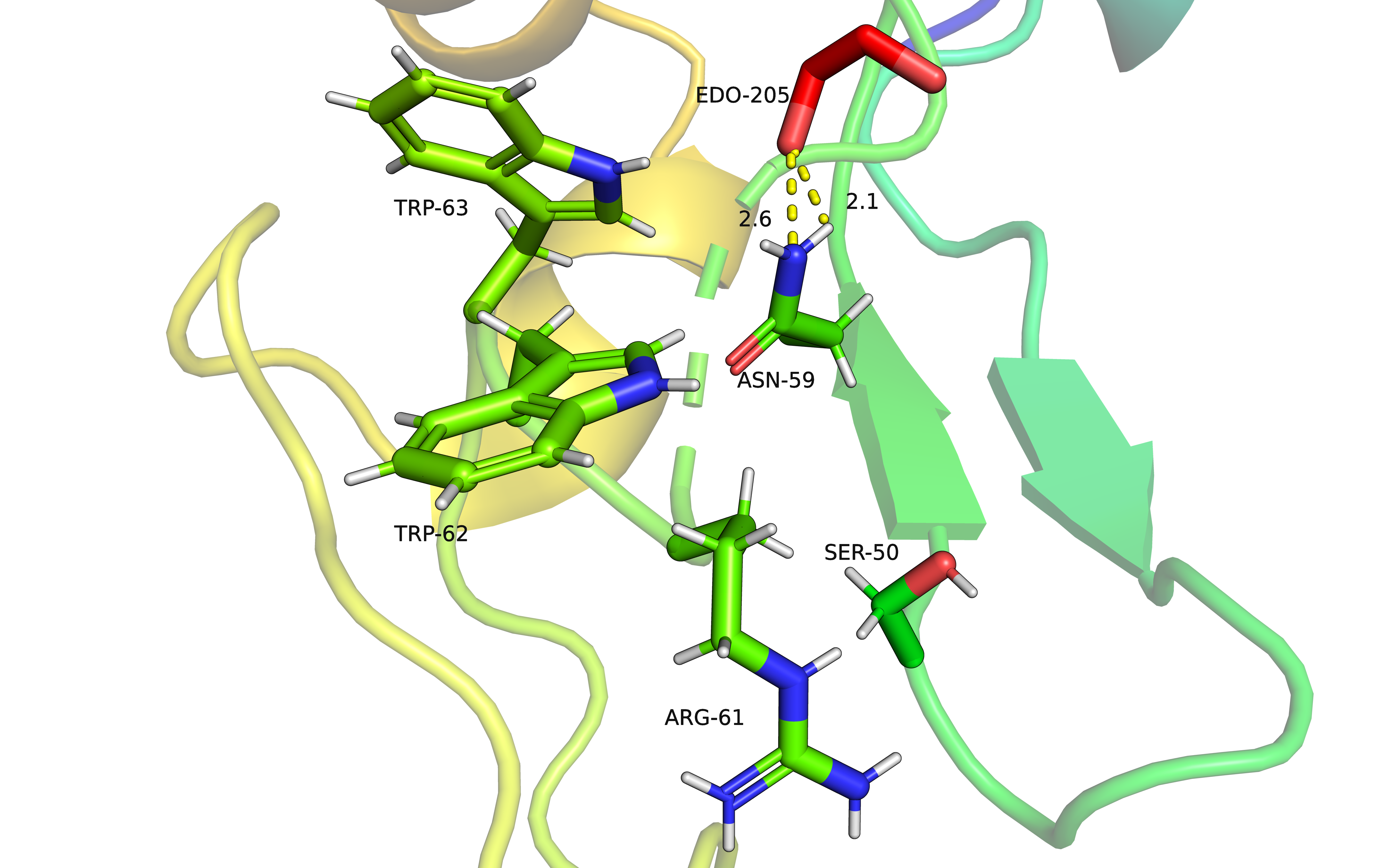
В данной конформации возможно существует водородная связь между ASN-59 и этиленгликолем, расстояния приемлемые и углы C-O-H и C-O-N больше 90 градусов, значит точно есть.
Из данных рисунков становится ясно, что в любой альт-лок стабилизирован малочисленными взаимодействиями, поэтому, возможно, альт-локов для этого остатка много из-за низкой стабилизации каждой конформации. Согласно файлу pdb, населенность альт-локов А, В и С равны 0.29, 0.38 и 0.33 соответственно. Если грубо округлить, то остаток ASN-59 равноверятно принимает одно из альтернативных положений. Это согласуется с наблюдениями, где каждый альт-лок имеет 1-2 водородных связей.
Задание 2
В данном задании нужно было визуализировать распределение В-фактора всего остова лизоцима, а также остатка, в котором можно проследить изменение B-фактора (рис.4 и 5). Я выбрала для визуализации остаток ARG-125.
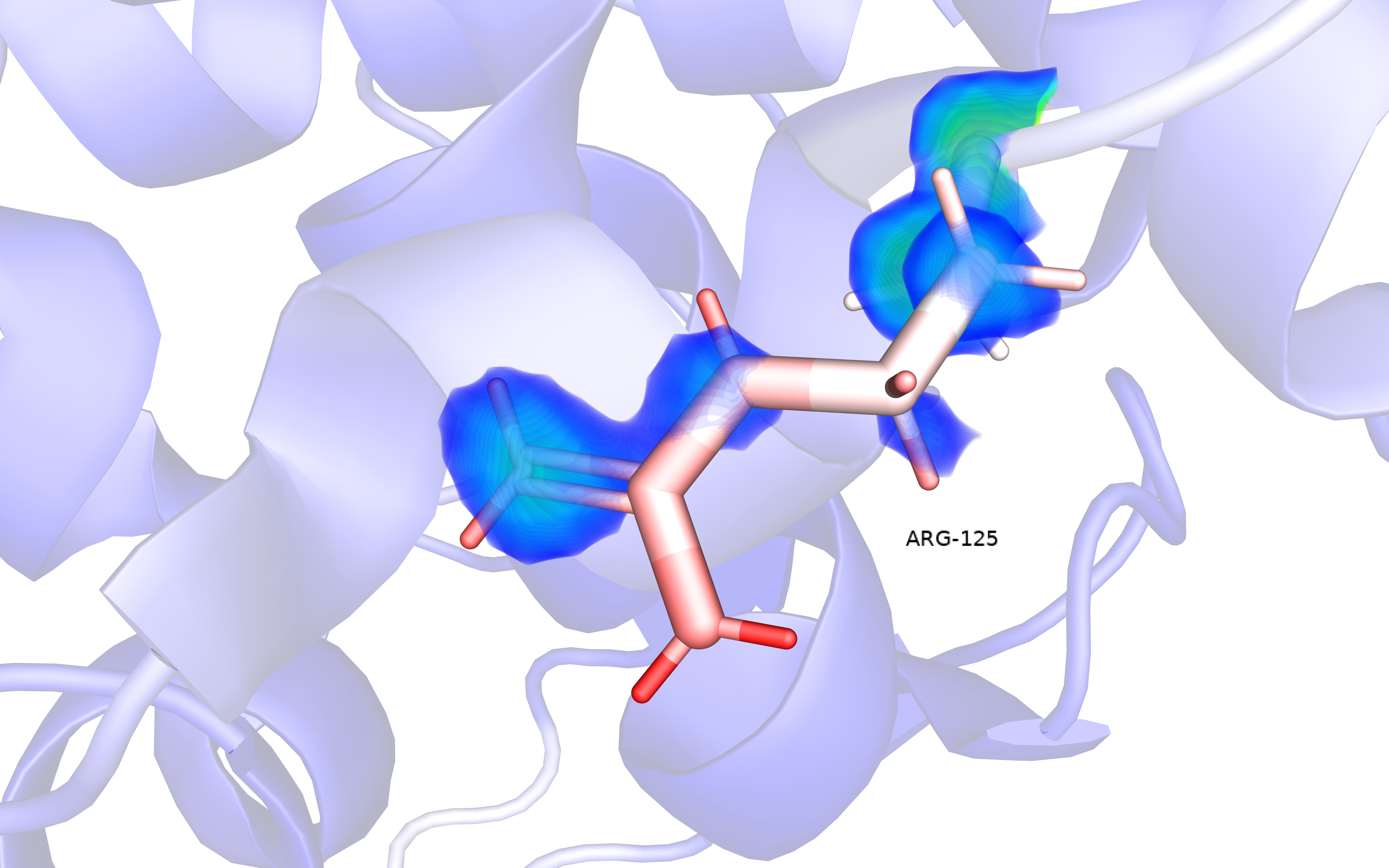
На рис. 4 видно, что высокий В-фактор характерен для нескольких областей: петли, экспонированной на поверхности белка, и С-концевой части белка. В первом случае "хвост" не стабилизирован внутримолекулярными взаимодействиями, примечательно что, N-концевая часть белка имеет низкий B-фактор, потому что связана с коровыми частями белка. Петля же подвижная (высокий В-фактор) поскольку, возможно, отвечает за открытую/закрытую конформацию активного центра лизоцима. На рис. 5 изображен ARG-125, в структуре которого B-фактор повышается от остова до окончания бокового радикала. Так же на рисунке визуализирована ЭП. Видно, что ЭП получается увидеть на атомах со средним B-фактором (белые атомы) ближе к остову, на конце бокового радикала ЭП почти не видно, кроме атомов углерода в sp2 гибридизации из-за наличия p-электронных облаков. Странно, что B-фактор отображен для атомов, для которых нет ЭП, но его распредение логично, т.е. атомы углерода более "четкие", чем атомы водорода, которые почти лишены электронной плотности от взаимодействия с более электроотрицательными атомами.
Задание 3
Для восстановления кристалла была использована команда generate с отсечкой 5 Å. Получившийся кристалл представлен на рис. 6