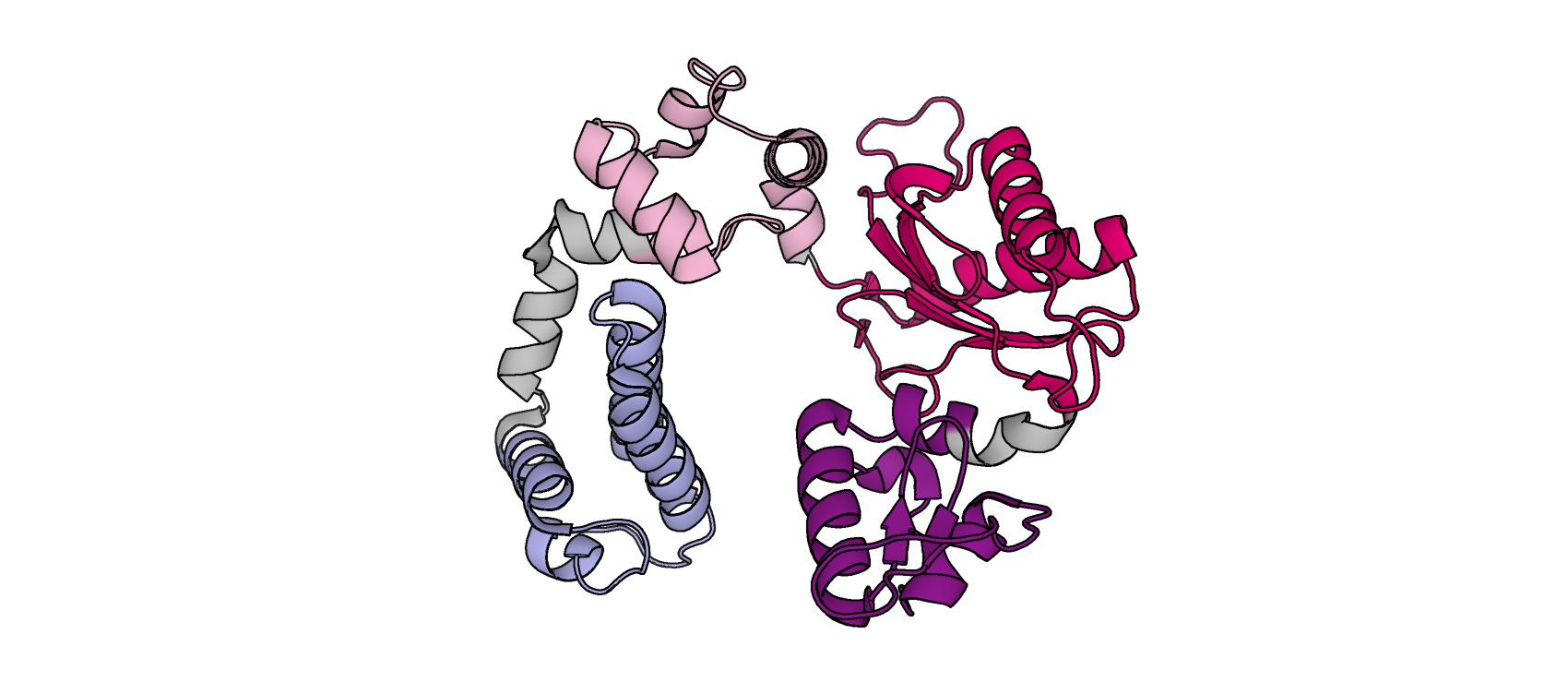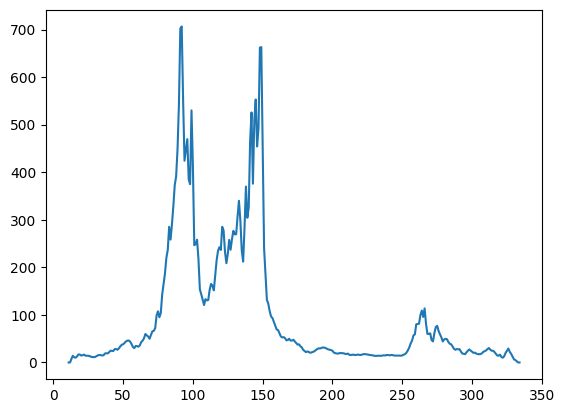
Была дана структура ДНК-полимеразы β крысы (1HUZ), которая участвует в репарации оснований. Далее эта структура была проанализирована алгоритмом DOMAK и был построен график (рис. 1), отражающий разбиение на домены по количеству взаимодействующих остатков.
На графике распределения Split Value можно увидеть два высоких пика, причем пик в районе от 50 до 100 а.о. имеет две вершины на значениях около 80 и 90 а.о, и более низкий в районе 270 а.о. Если принимать во внимение последний пик, то, по данным DOMAK, ДНК-полимераза β имеет 4 домена, если нет – то 3 домена.

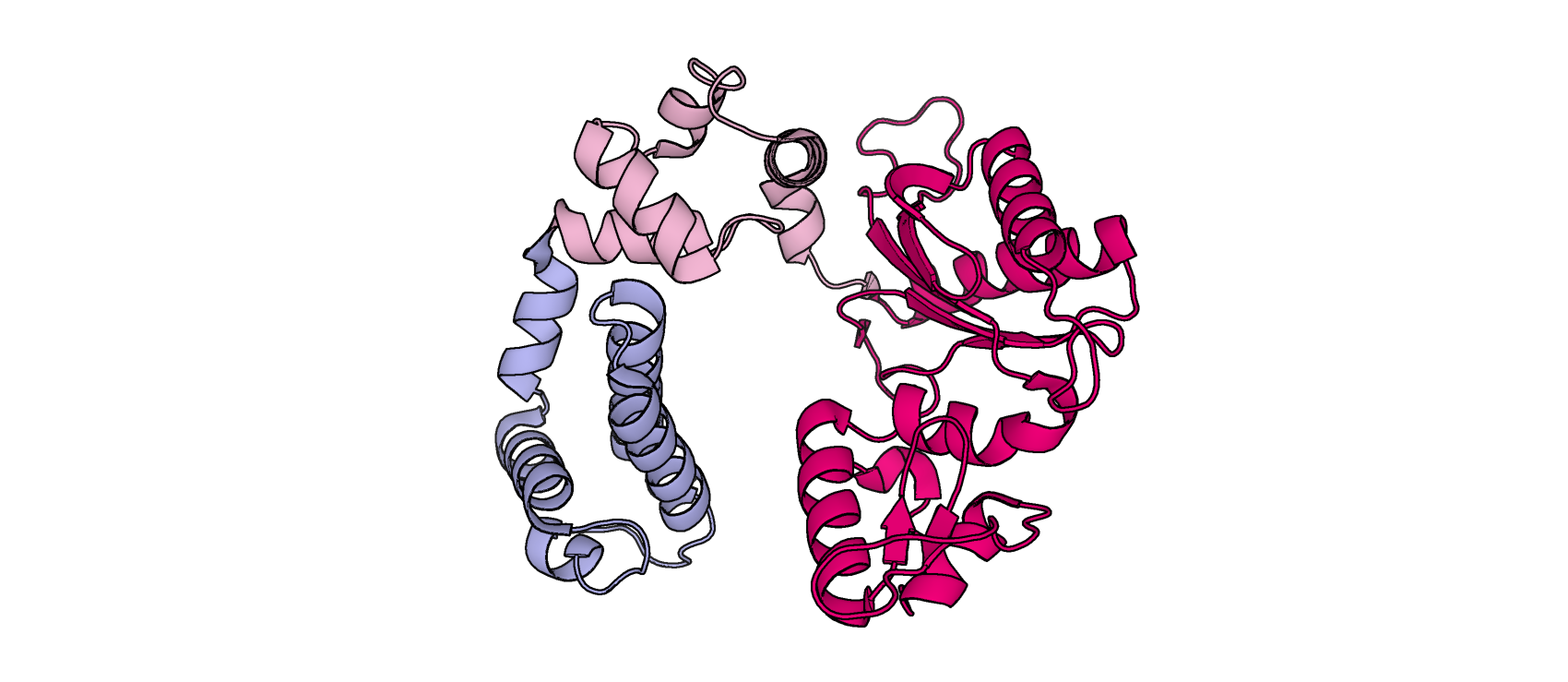
Результаты алгоритма DOMAK соппадают с данными SCOP и CATH. Первый выделяет 3 домена в белке (10-91, 92-148, 149-334 а.о), что почти идентично DOMAK, последний – 4 домена (10-91, 92-148, 149-271, 271-334 а.о), то же самое распределение можно получить, учитывая и не учитывая низкий пик на графике 1.
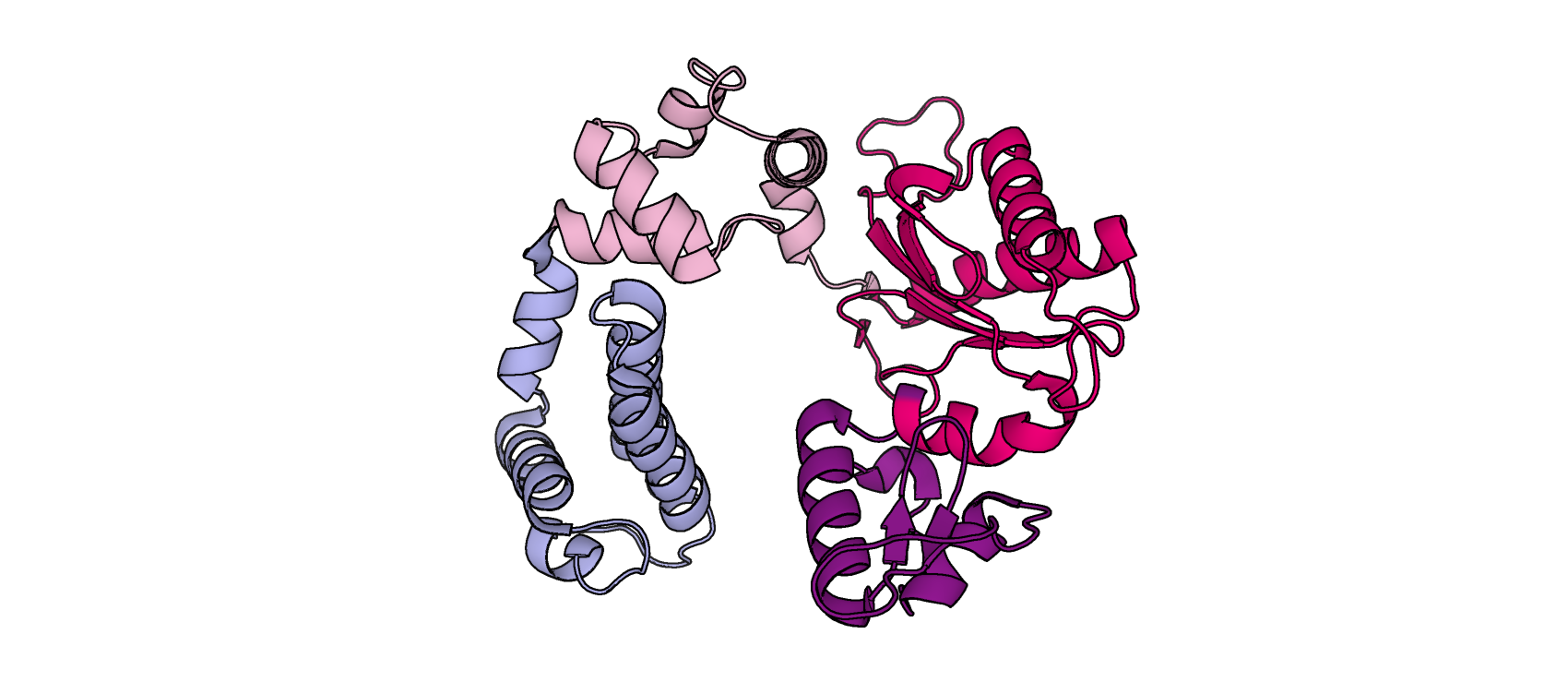
Базы Pfam и InterPro выделяют 4 структурных домена, и их границы DOMAK предсказал лишь частично. Участок 12-78 а.о N-концевым доменом или спираль-шпилька-спираль; 98-147 – ДНК-полимераза λ, "пальцы"; 149-262 – ДНК-полимераза β, "ладонь"; 268-334 – ДНК-полимераза β, "большой палец". Т.о., DOMAK смог предсказать верное количество доменов, но определение границ структурных и эволюционных доменов не вполне корректное.