ЯМР
Задание 1
В этом задании мне предстояло анализировать две структуры небольшого белка SUMO (Small ubiquitin-related modifier), получаенные при помощи ЯМР (6xju) и РСА (1wyw). Для ЯМР было предствлено 20 моделей, РСА структура имеет разрешение 2,1 Å.
По заданию были измерены дистанции в 3 случаях образования водородной связи: в остове, между боковыми радикалами в ядре белка и в наружней петле. Сразу отмечу, что белок SUMO маленький и его ядро преимущественно образовано гидрофобными остатками, поэтому было сложно найти подходящую под условие задачи пару остатков.
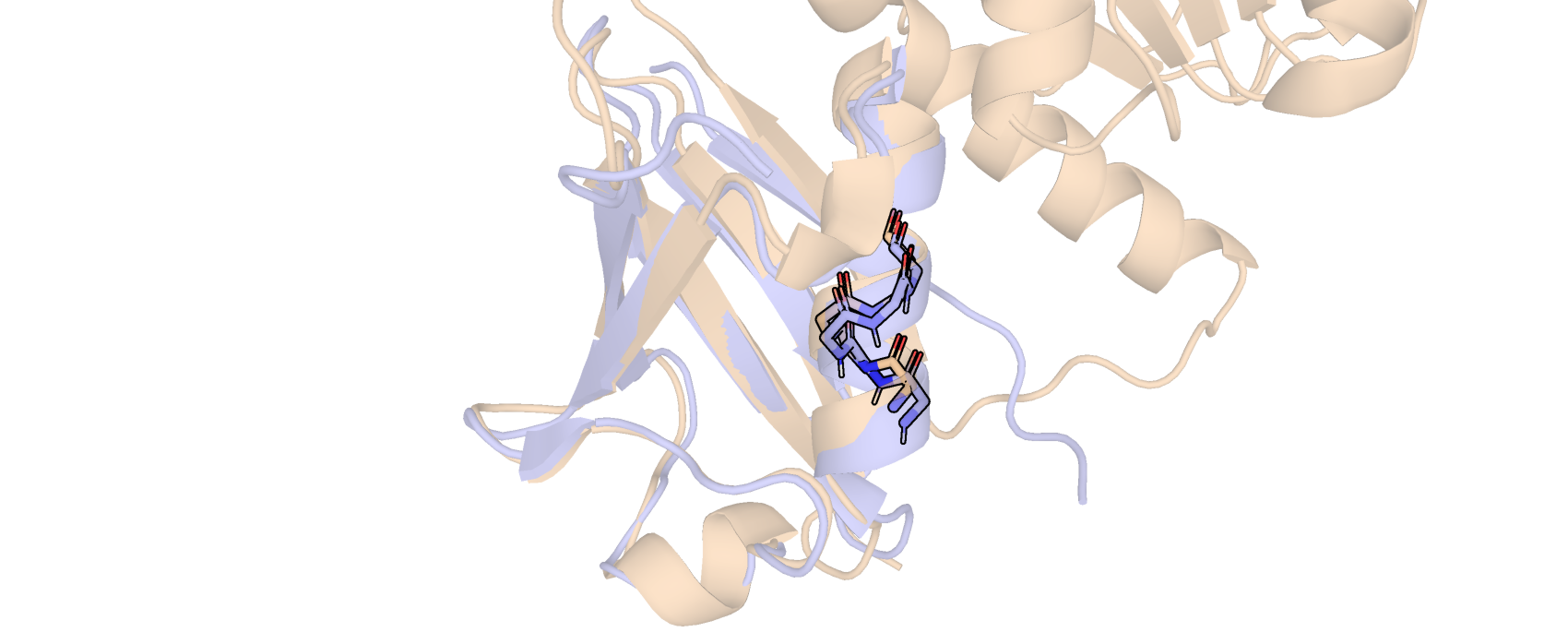
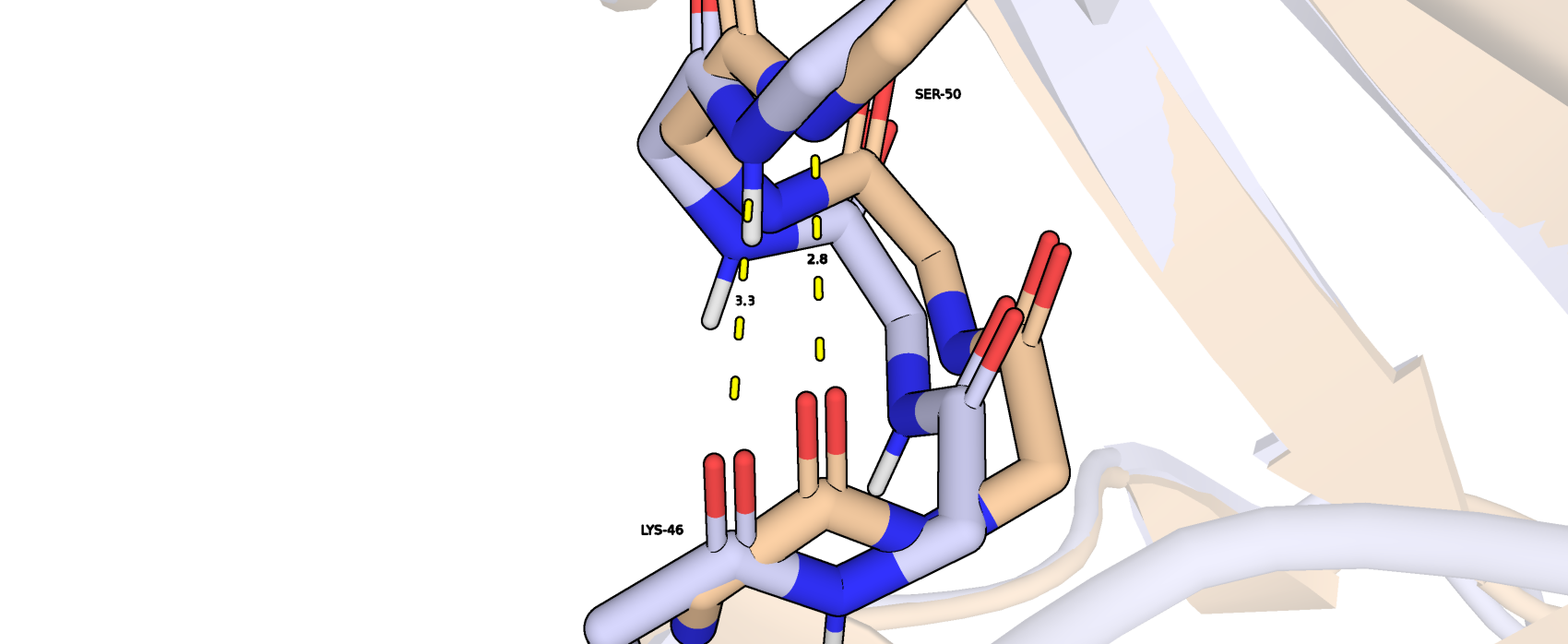
Первая водородная связь находиться между атомом N SER-50 и атомом О LYS-46 (рис. 2). Связь образована внутри остова и стабилизирует альфа-спираль. Данные остатки обращены к поверхности белка (рис. 1).
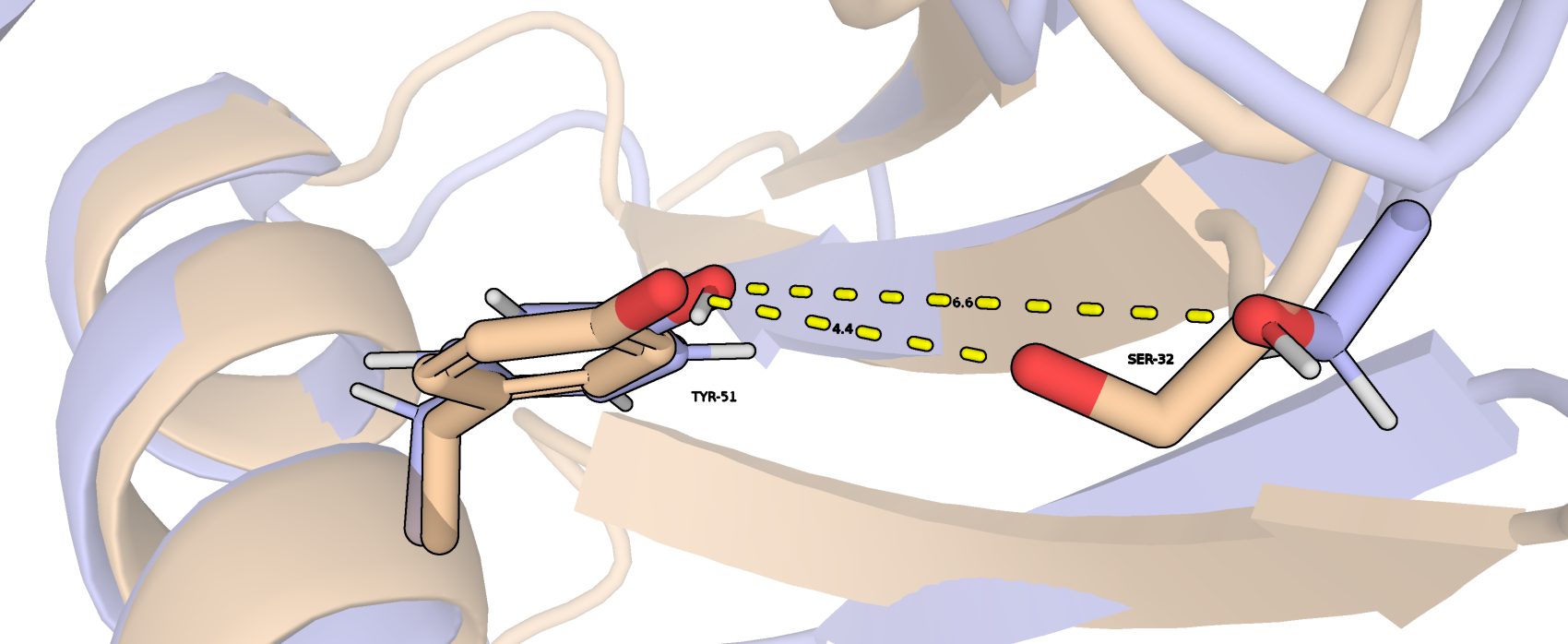
Следующая связь была определена для структуры РСА между остатками SER-32 и TYR-51 внутри глобулы (рис. 3). Так как атомы водорода в структуре отсутствуют, то можно лишь предпологать, кто из них донор связи, а кто акцептор. Протонированная структура ЯМР также не вносит ясности, поскольку растояния между атомами кислорода огромны и связи в данном случае совсем нет.
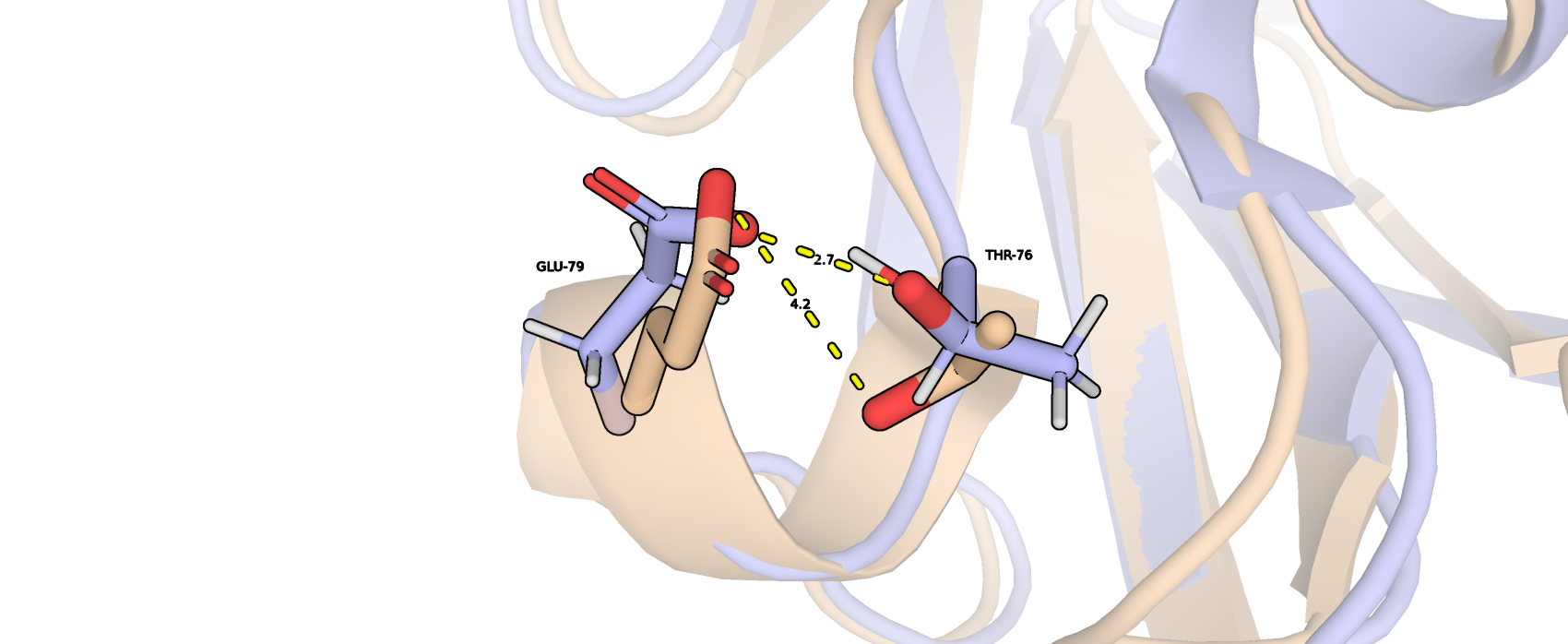
Последняя водородная связь приведена для остатков THR-76 и GLU-79 в петле, которая обращена наружу (рис. 4). Примечательно, что эта петля в РСА структуре аннотирована как короткая альфая спираль, что, вероятно, неверно из-за малого размера и отсутсвия анологичной вторичной структуры в данном месте в ЯМР модели. Также положения радикалов в РСА модели не создают условий для образования водородной связи, а в ЯМР они достаточно сближены.
В таблице ниже представлена сводная таблица по водородным связям в моделях РСА и ЯМР. Данные для ЯМР были получены скриптом. Он анализирует каждое состояние ЯМР модели (states) и выдает следующую информацию для двух остатков: Минимальное, максимальное и медианное заначение дистанции меджду атомами донора и акцептора связи по всем состояниям, а также результат проверки дистанции между атомами (больше ли 3,5 Å) и углов углерод-акцептор-донор и углерод-акцептор-водород (больше ли 90°) для каждого состояния. В целом, в двух ситуациях из трех водородная связь обнаруживается в структуре РСА и ЯМР. Только водородная связь в ядре белка между боковыми радикалами имеет место в РСА модели и ни в одной ЯМР.
| Остатки | Расстояние Å | Число моделей | Mин Å | Макс Å | Медианное Å |
|---|---|---|---|---|---|
| SER-50, LYS-46, остов альфа-спирали | 2,8 | 19 (95%) | 2,83 | 3,51 | 3,12 |
| SER-32 и TYR-51, ядро глобулы | 4,4 | 0 | 5,28 | 6,87 | 6,30 |
| THR-76 и GLU-79, наружняя петля | 4,2 | 19 (95%) | 2,56 | 3,94 | 2,66 |
Подводя итог, можно сказать, что данные РСА и ЯМР не всегда согласуются. Сложно оценить правильность того или иного предположения на счет наличия водородной связи, так как для РСА существует разрешение и определенный набор метрик, связанных с ЭП, а ЯМР модели можно подвергнуть статистической обработке.
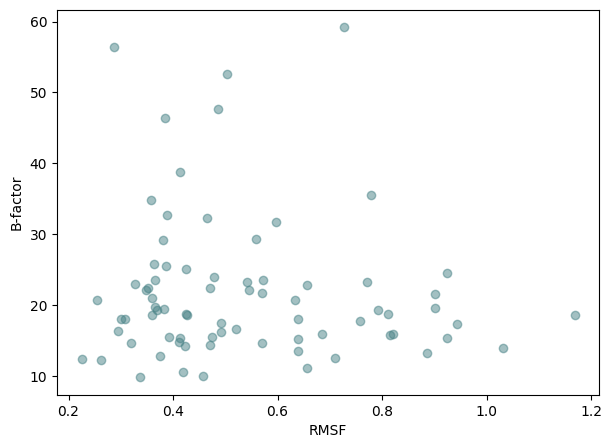
Задание 2
График ниже показывает зависимость В-фактора РСА модели от RMSF ЯМР модели по остаткам. На глаз видно, что облако точек находится в пределах 10-0 RMSF и размазано по шкале B-фактора. Это говорит о том, что B-фактор РСА в данном случае не коррелирует с флуктуациями в ЯМР моделях. Это подтверждается статистически, коэффициент корреляции Пирсона равен -0.0875, а это почти ноль, с pvalue=0.45. Вероятно, разброс B-фактора связан с невысоким разрешением модели