Мне дана структура HSP90 (белок теплового шока) со связанным ингибитором (2XDX). Согласно записи на сайте PDB, разрешение модели составляет 2.42 Å,что хорошо, а R-free – 0.33, R – 0.203. Значения набора метрик представлены на рис.1. Разрешение модели можно считать хорошой, однако R-free высокий, как у всех моделей с такими же разрешением.

Большая часть метрик, кроме RSRZ-выбросов, лежат в красной области (плохие), однако средние значения метрик для структур с таким же разрешения немногим лучше. На рис. 2 представлен график, демонстрирующий распределение остатков по их значениям RSRZ.
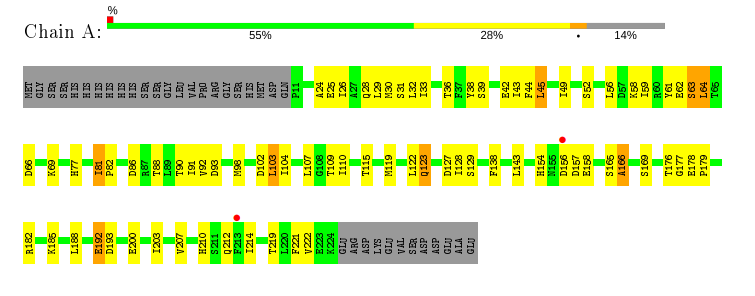
Данный рисунок наглядно показывает, что у структуры не определены концевые аминокислотные остатки. Красная точка над остатком означает плохое соответствие электронной плотности (RSRZ > 2), их всего две, поэтому, несмотря на невысокое разрешение, ЭП большинства аминокислотных остатков хорошо вписываются в экспериментальную ЭП.
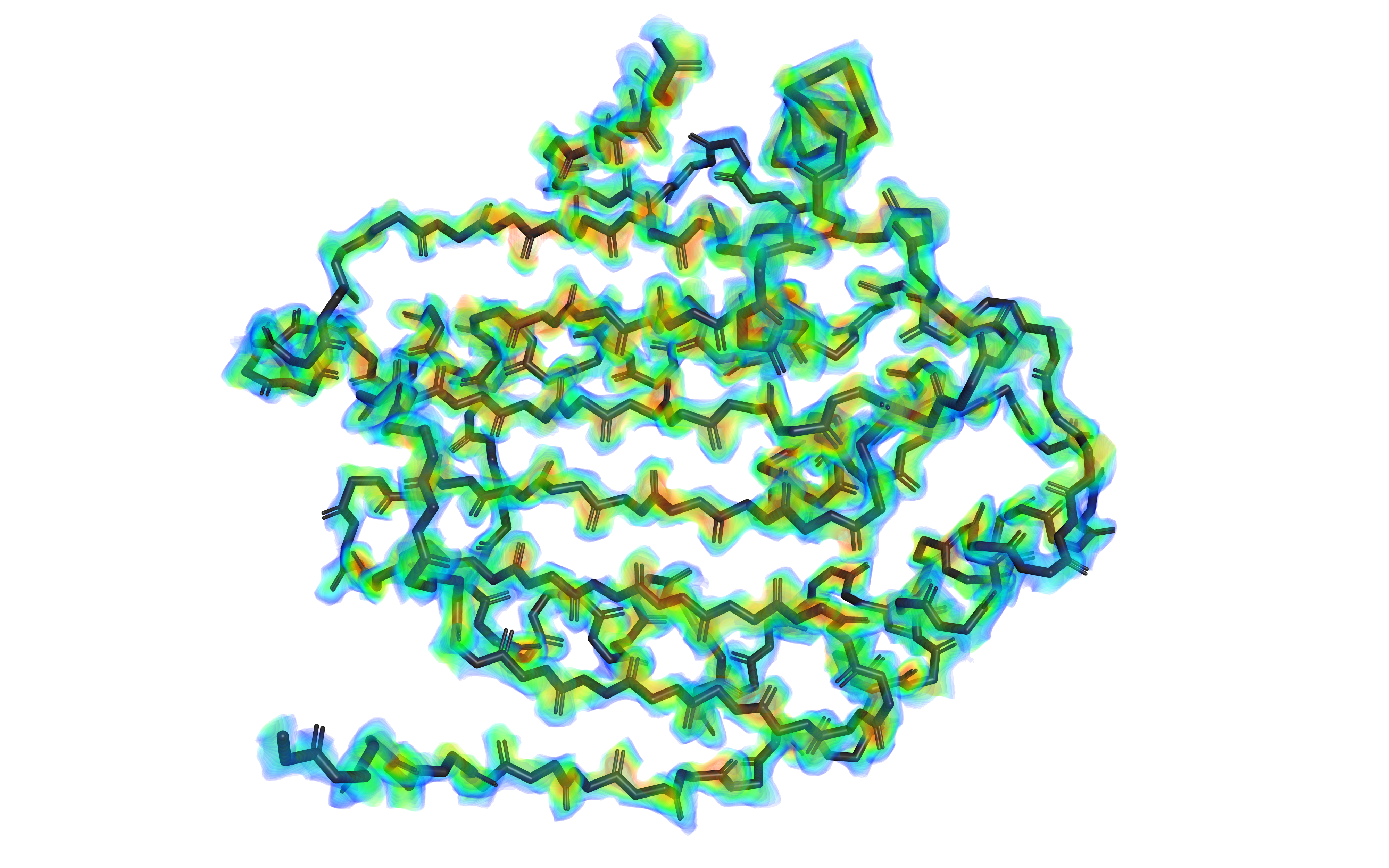
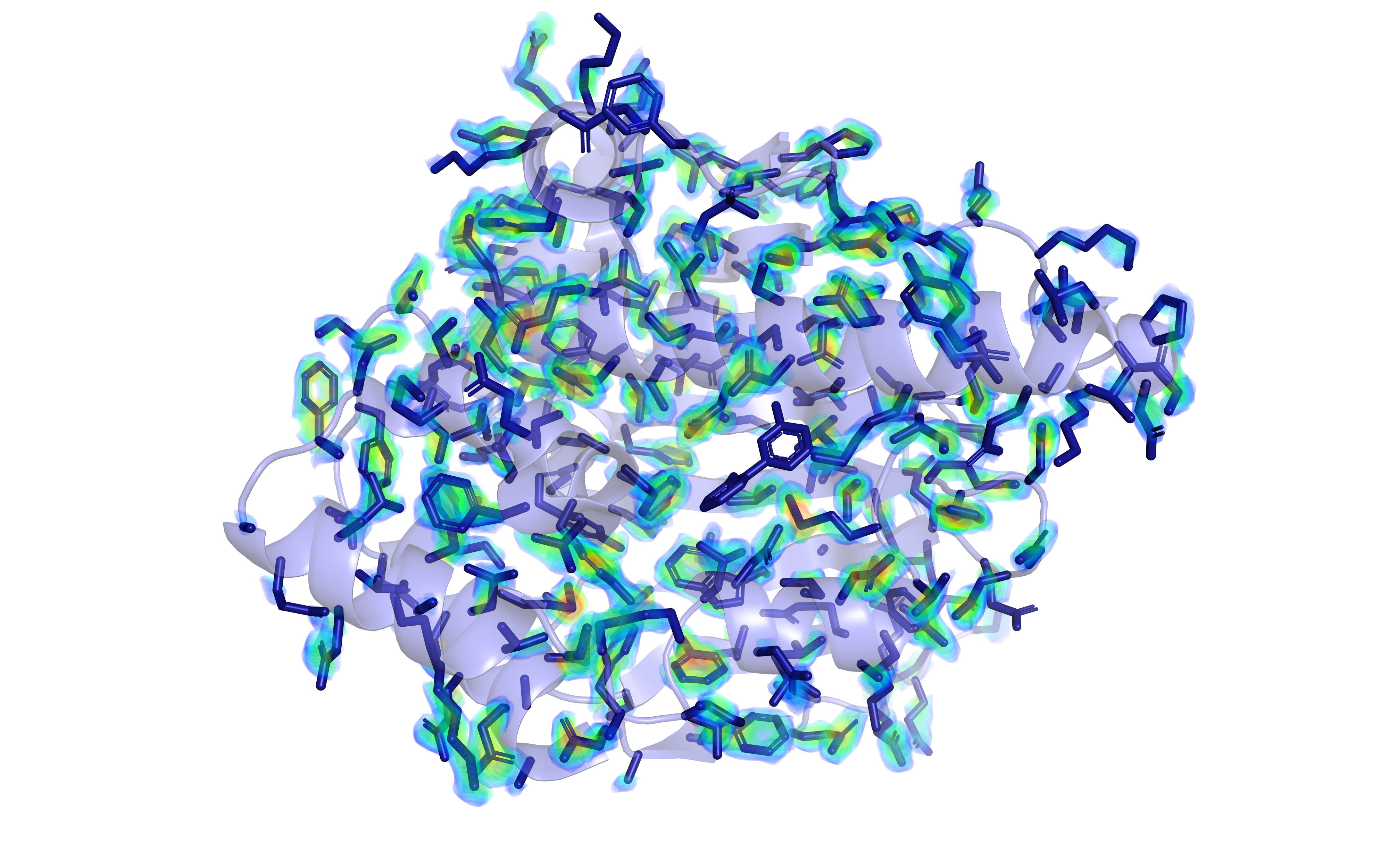
Из рис. 3 и 4 следует, что ЭП определена для всех участков белка, на отдельных остатках ЭП не визуализируется. Это характерно для тех, кто экспонирован на поверхности белка. Остатки, находящиеся вблизи лиганда, имеют хорошую визуализацию ЭП.
Модель 2XDX лишь одна из многих, на странице PDB macromolecules для этого белка представлен огромный список возможных моделей белка из 336 наименований. Из данных валидации я делаю вывод, что хоть модель имеет не самое высокое разрешение (другие модели предлагают около 1,5 Å), но среди структур со схожим разрешением она обладает хорошим качеством:хорошо вписан лиганд в свою плотность, весь остов имеет подтверждающую ЭП, а также остатки, вероятно вовлеченные в взаимодействия с лигандом, тоже имеют подтверждающую ЭП. Альтернативные модели можно использовать, если требуется структура с большим количеством доменов, такие тоже есть в базе.
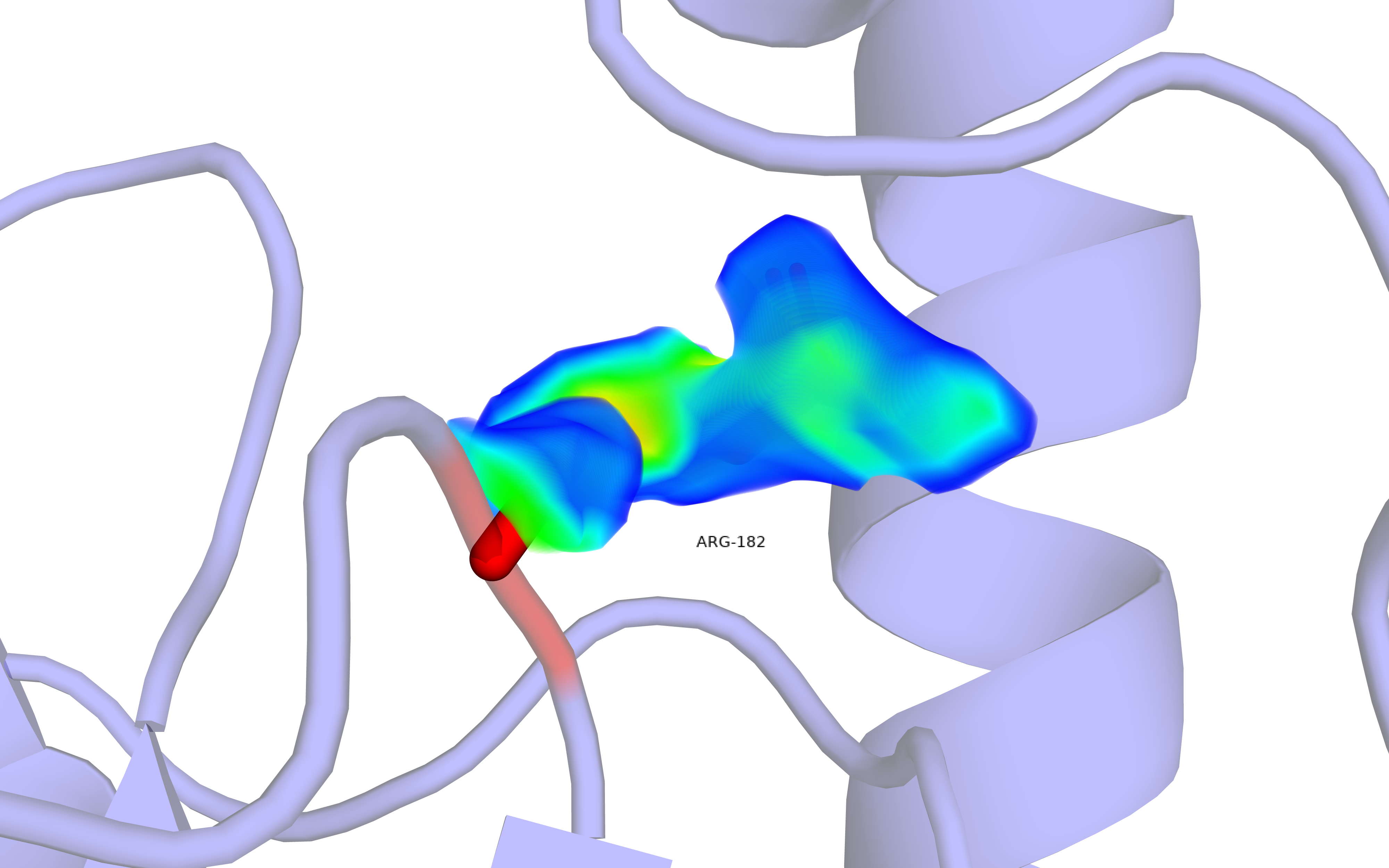
Первым будет расмотрен маргинальный остаток ARG-182 с неверным углом NE-CZ-NH1, который равен 117.66° вместо идеальных 120.30°. Рисунок 5 демонстрирует визуализацию его ЭП. Так как разрешение модели невысокое, увидеть четкие ЭП облака атомов невозможно. ЭП высокой плотности сконцентрирована на CZ, поэтому сложно определить истинный угол в NE-CZ-NH1, не имеея точных данных положении атомов азота.
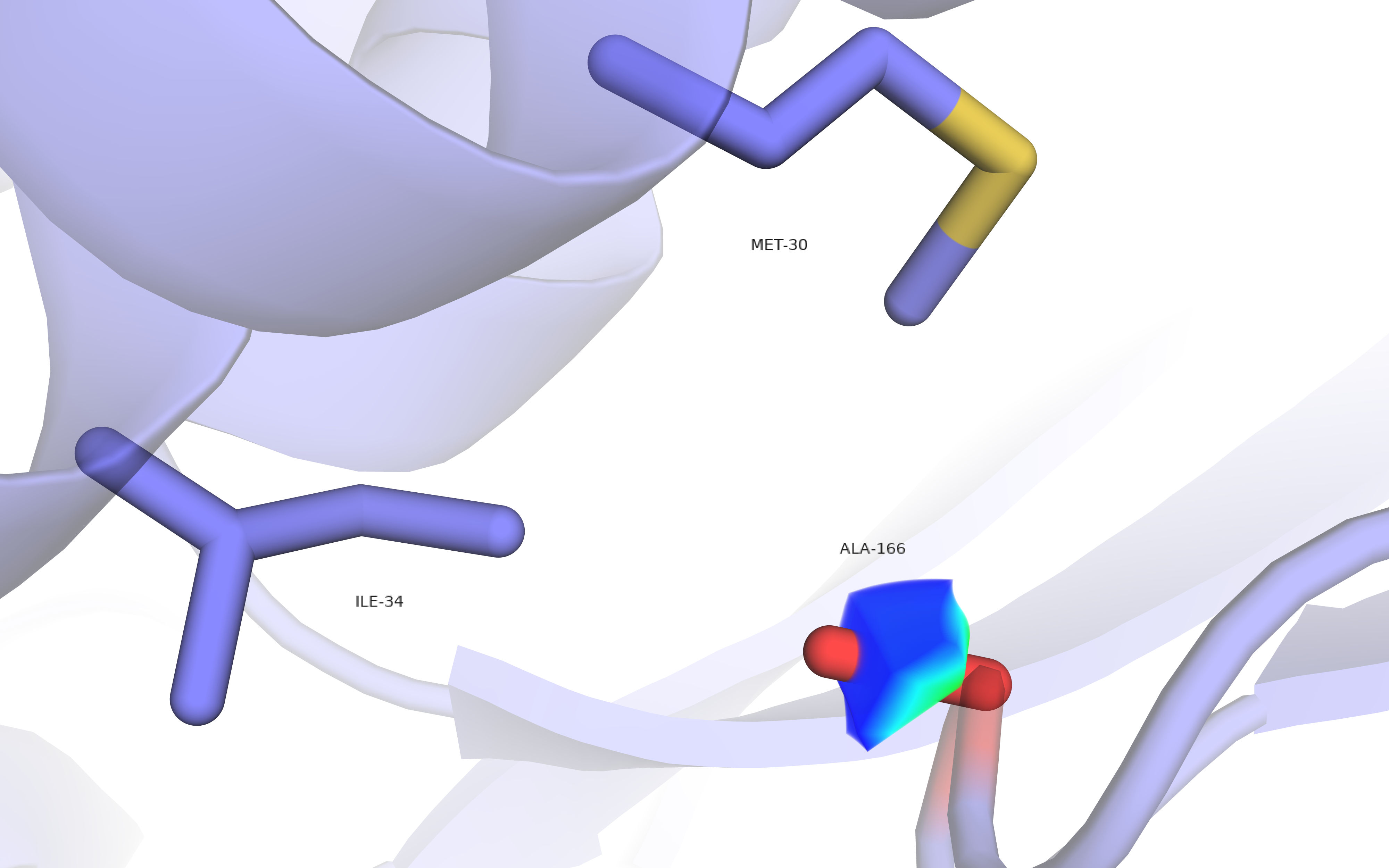
Остаток ALA-166 обозначен как маргинальный из-за неправильного угла поворота бокового радикала (область низкой вероятности на карте Рамачандрана). На рис.6 видно, что данный радикал окружен гидрофобными остатками и возможно вступает с ними во взаимодействие, что может объяснить аномальное положение бокового радикала ALA-166. ЭП говорит об однозначном положении метильной группы аланина.
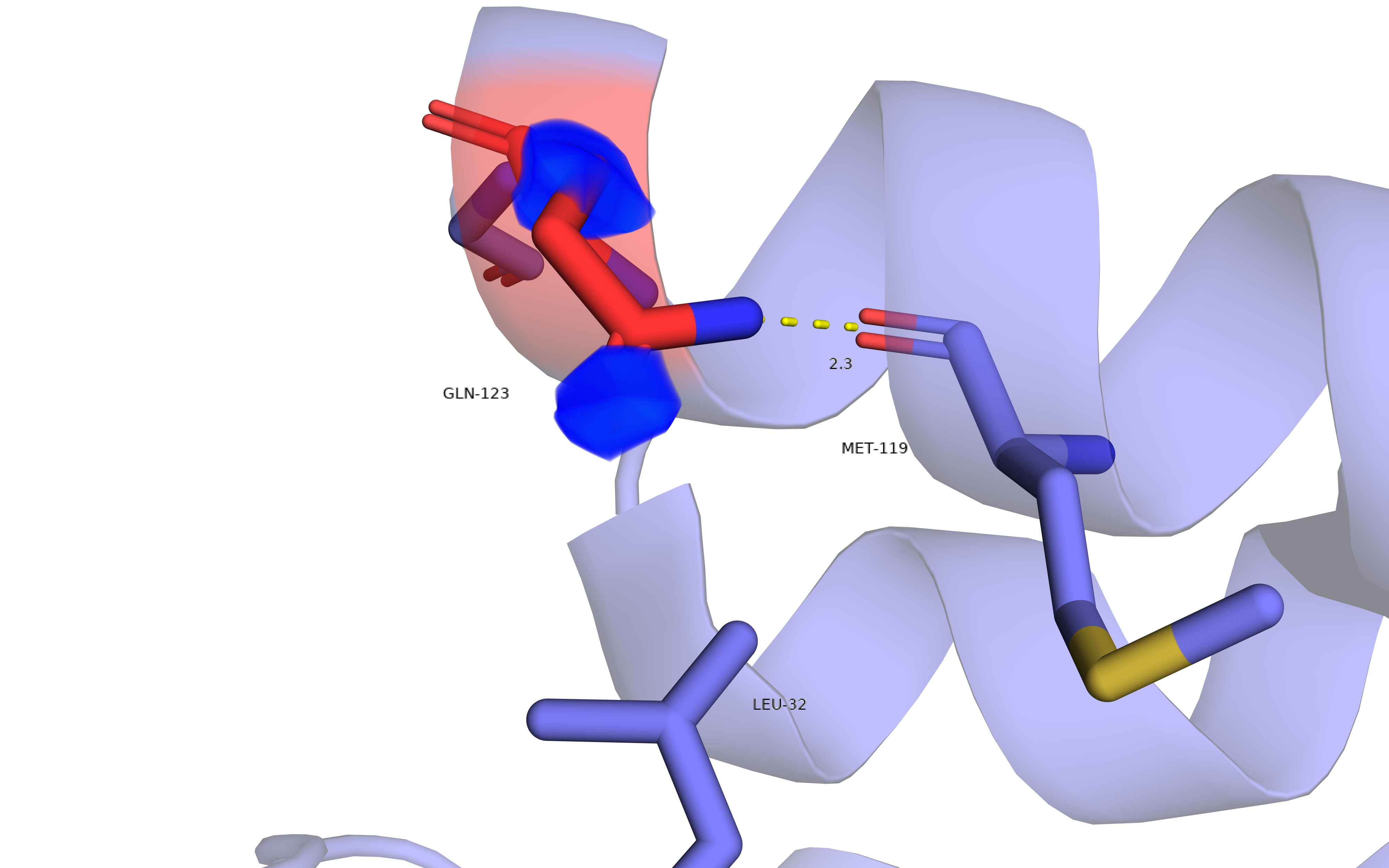
GLN-123 обозначен как non-rotameric и имеет рекомендацию к развороту. На рис. 7 этот остаток представлен вместе с подтверждающей ЭП. Низкое покрытие ЭП не дает ясности в том, в какую сторону должна быть повернута аминогруппа бокового радикала. Однако данную конформацию поддерживает водородная связь между аминогруппой GLN-123 и атомом кислорода остова MET-119.
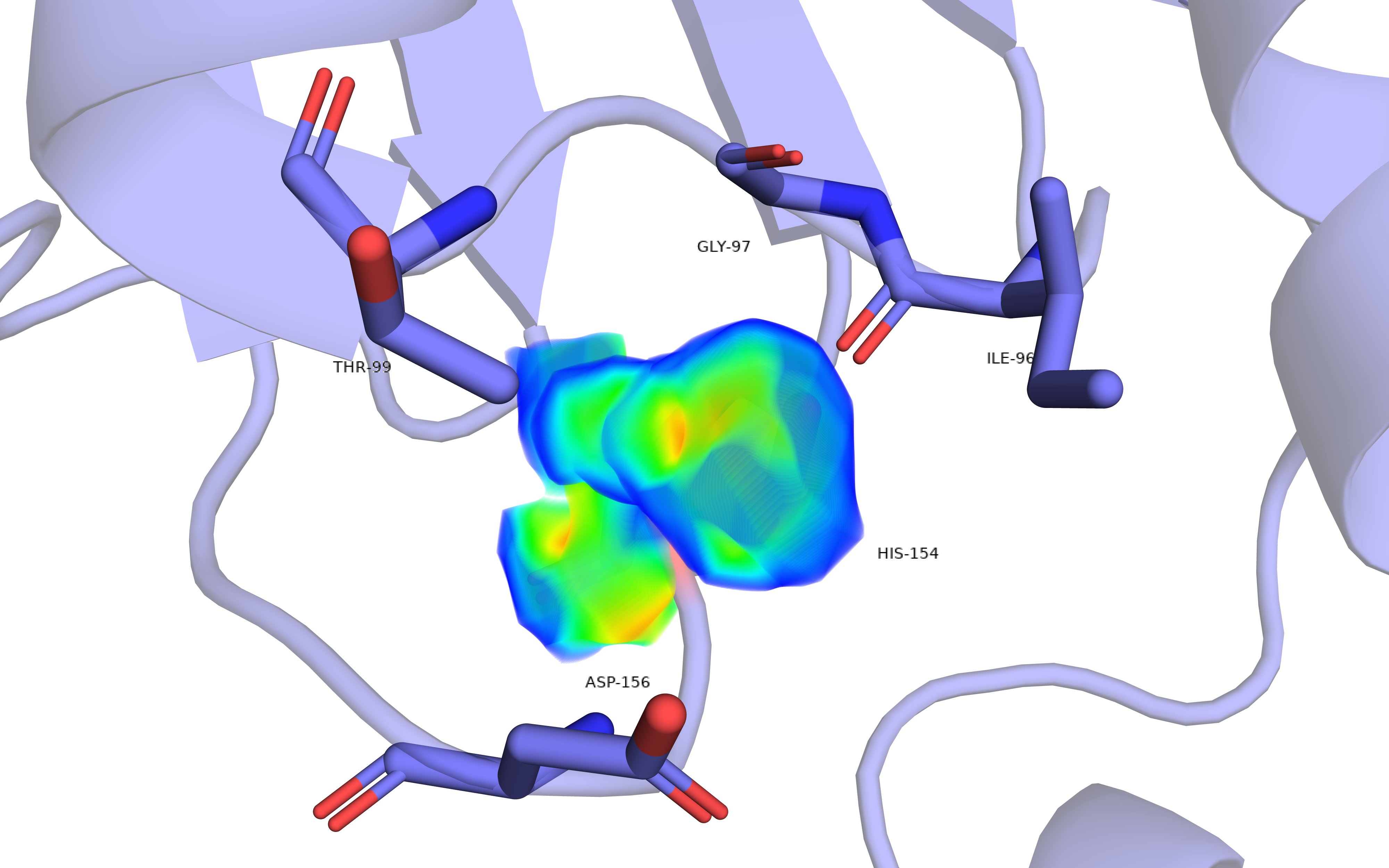
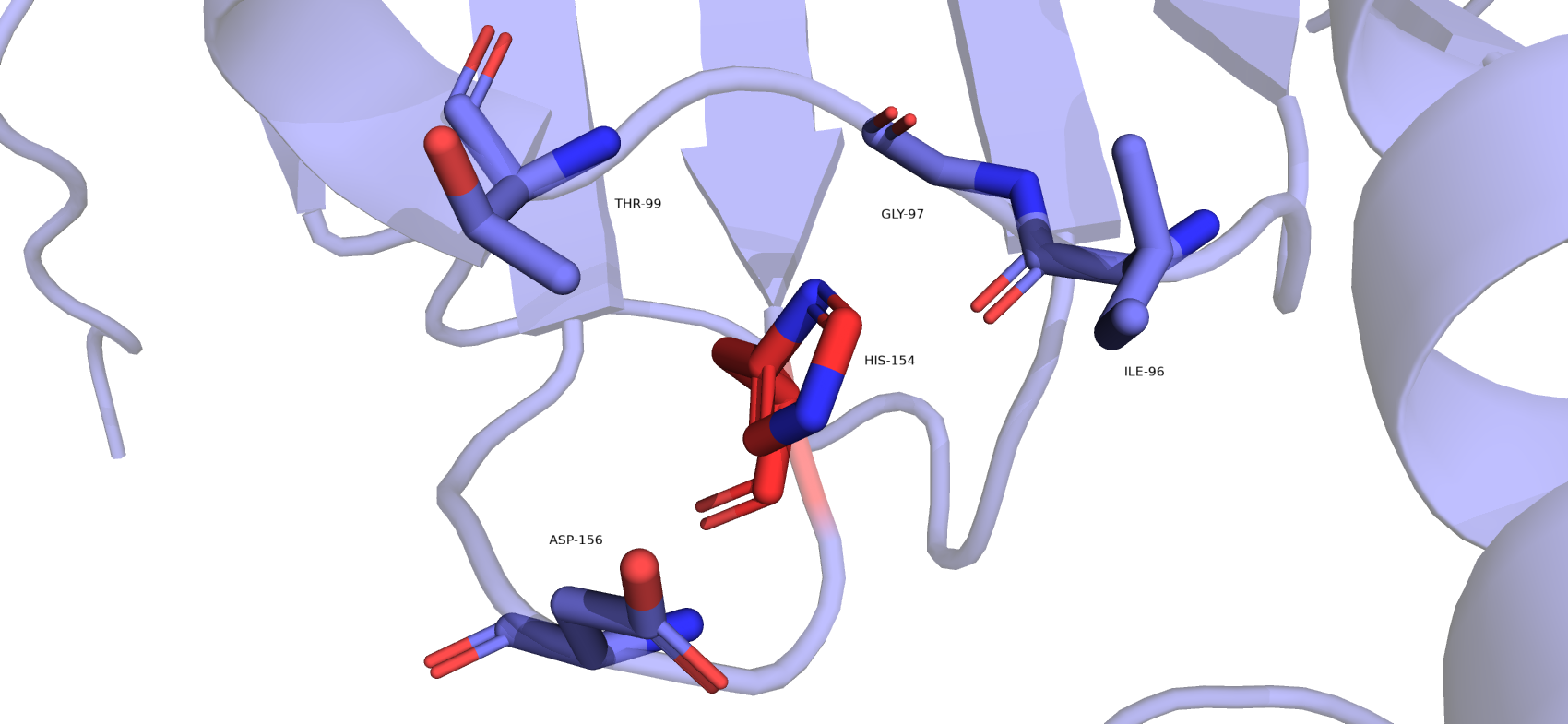
Похожую историю имеет остаток HIS-154, его тоже возможно нужно перевернуть. Остаток показан на рис.8 и рис.9. ЭП хорошо визуализирована для всего остатка и наиболее плотная как раз находится возле электроотрицательных атомов азота. Т.е. по ЭП не очевидно, что нужно как-то повернуть гистидин. Если брать во внимание окружение, то может показаться, что тут есть каталитическая триада THR-HIS-ASP. Действительно, шапероны обладают АТФазной активностью, однако ни один из представленных остатков: THR-99, ASP-156, HIS-154, – не является важным для катализа (по данным сайта UbiProt). Т.о. мы имеем фактически странное положение HIS, и нет способов обосновать другие положения.
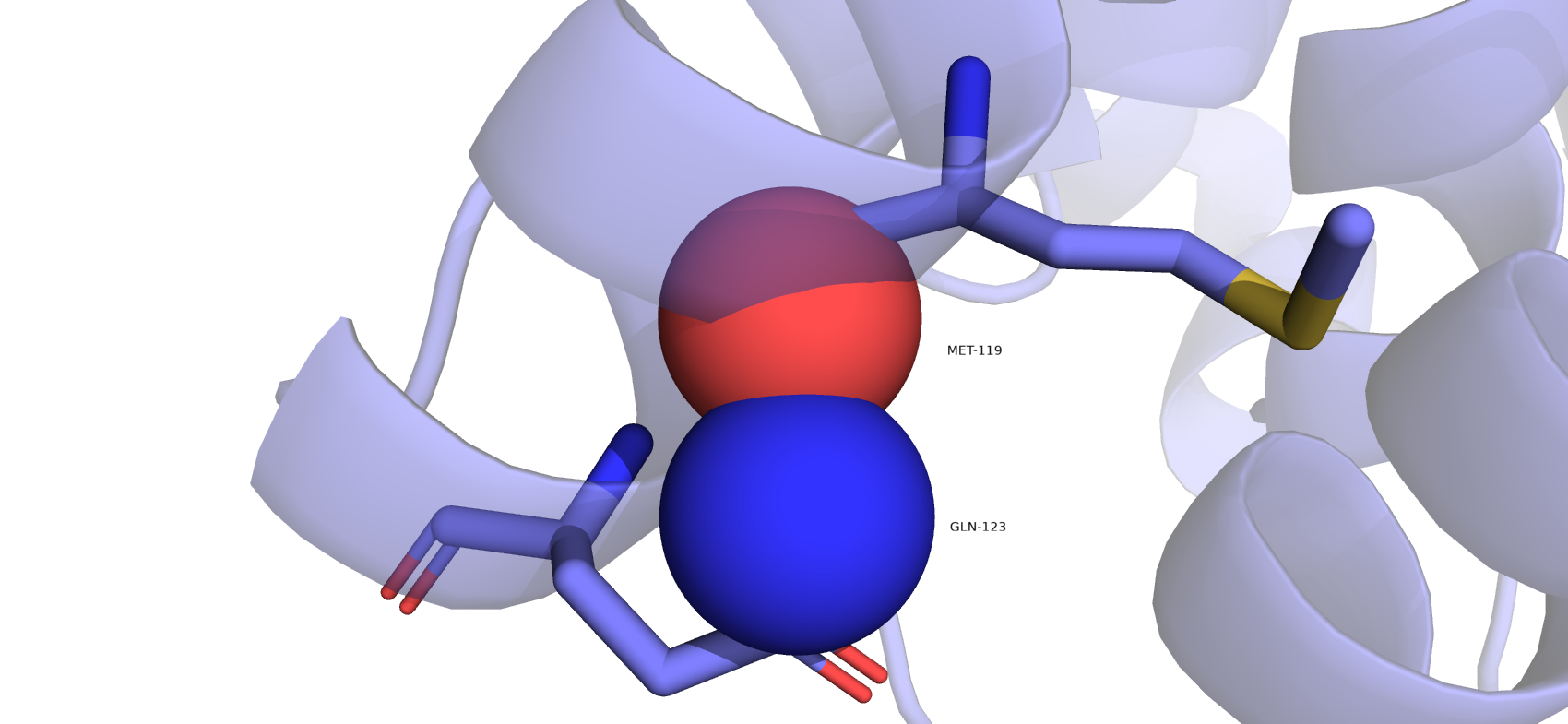
В отчете по валидации был приведен большой список пар атомов, у которых есть перекрытия радиусов (55 пар). Я выбрала одну пару не водородов с самым большим перекрытием, это атомы остатков MET-199 и GLN-123. По рис. 10 видно, что Ван-дер-Ваальсовые радиусы перекрываются, что не должно происходить при не ковалентных взаимодействиях. Следовательно, вывод сделанные ранее неверный. Остаток GLN-123 должен быть развернут, чтобы его атомы не накладывались на окружающие его остатки.