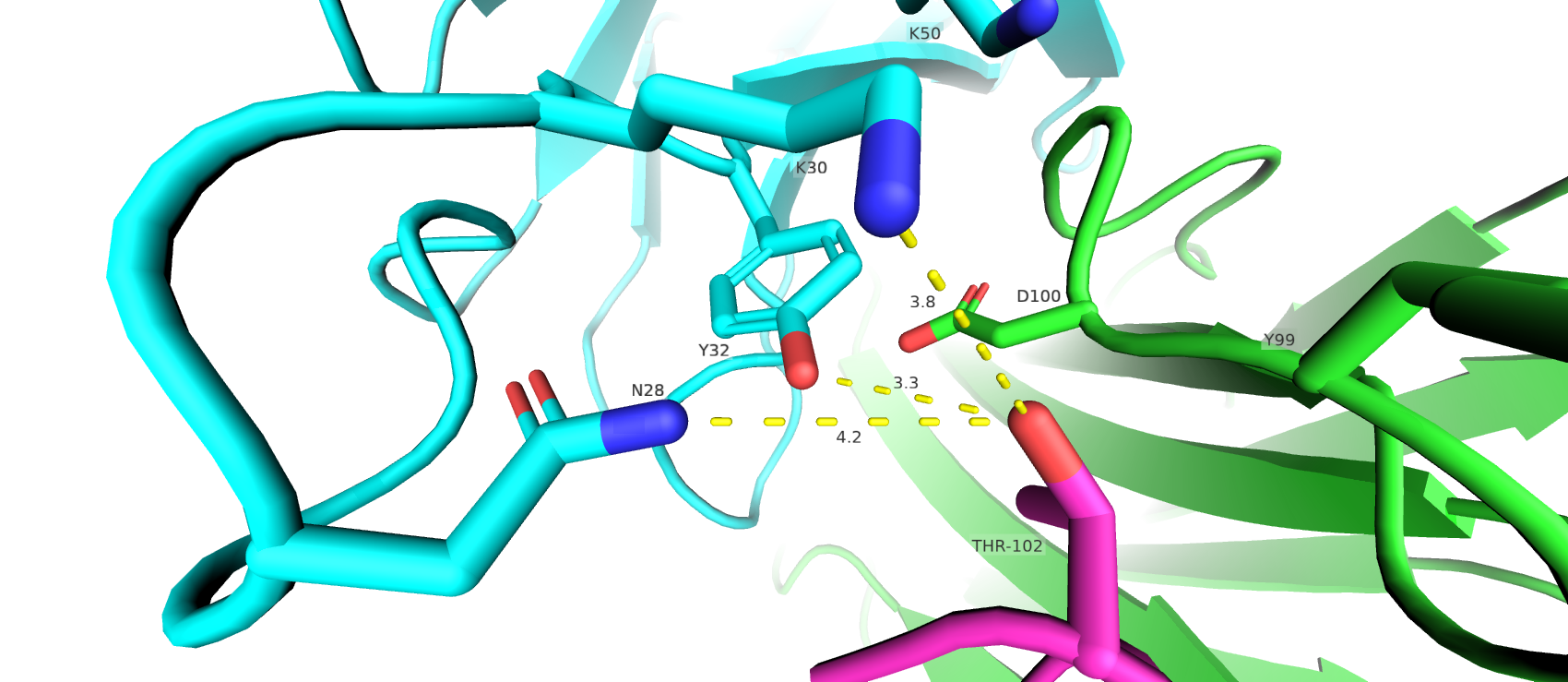
Структура глутоматного рецептора 2 (GluR2), представленного связывающим ядром, в комплексе с лигандом бромо-вилардиином имеет код PDB 1MQH. На картинке, представленной ниже, показана визуализация окружения лиганда на расстоянии 4 Å. Файл сессии можно скачать по ссылке.

В данной структуре были определены 2 взаимодейтвия между белком и лигандом типа стэкинга:
В расматриваемой структуре точечная замена на GLY была внесена в 102 остаток цепи антигена. Визуализация окружения остатка GLY-102 показана на рис.2, остатки показаны в виде сфер.
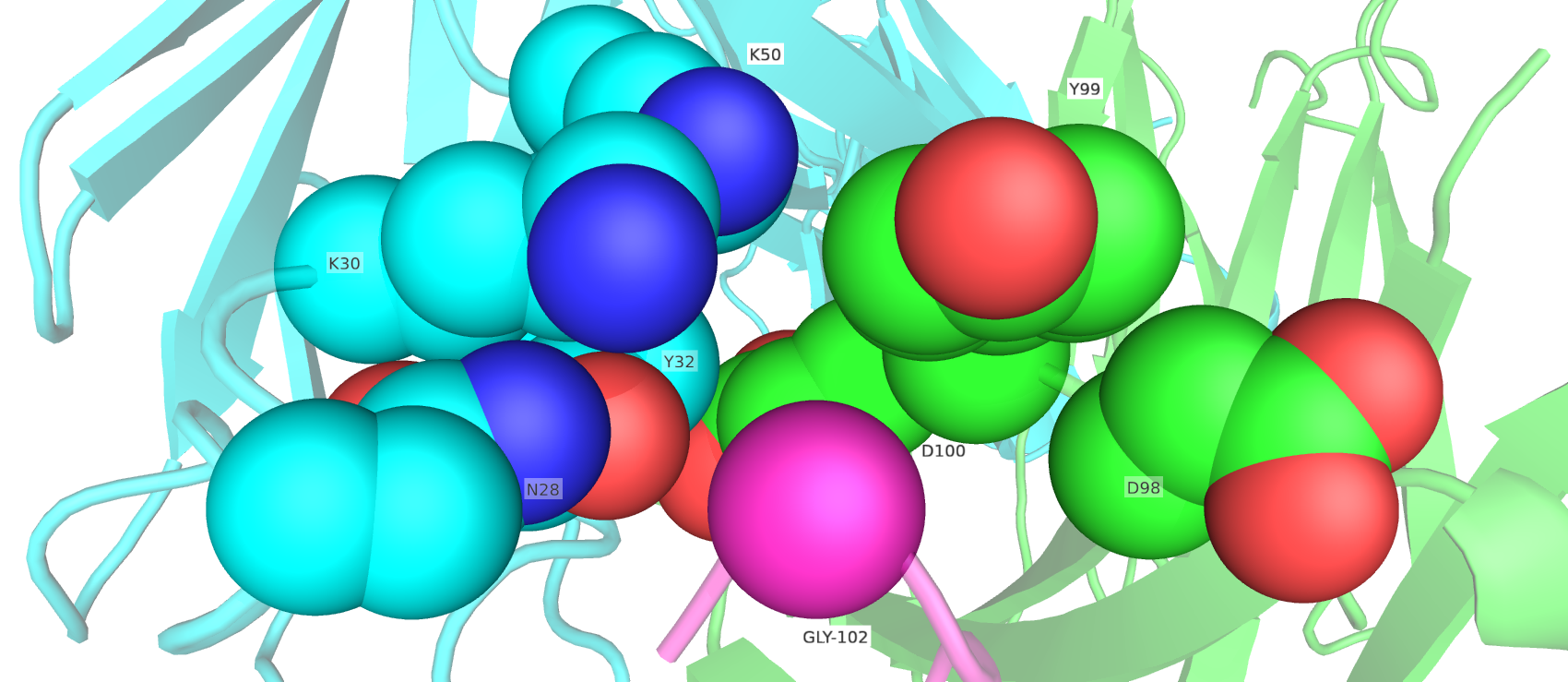
На рис. 2 видно, что 102 остаток антигена окружают полярные группы остатков N28, K30, Y32, K50, D98, D99 и D100. Таким образом, изначальная аминокислота с высокой вероятностью не является алифатической. Выбранный способ визуализации с помощью сфер наглядно показывает стерические наложения атомов. Сферы имеют радиусы равный ван-дер-ваальсовым радиусам, т.е. минимальному расстоянию между атомами, не имеющих химическую связь. В данной работе я приняла предположение, что искомая аминокислота антигена не должна иметь перекрытий сфер с окружающими остатками антитела, поскольку мы ожидаем наблюдать только следующие типы взаимодействия: стэкинг, солевые мостики и водородные связи, – без образования более коротких химических связей.
Предварительный анализ (результаты не показаны) показал, что ароматические аминокислоты в 102 позиции имеют имеют большое перекрытие сфер с окружающими остатками, поэтому в дальнейшем они не были рассмотрены. Далее были сделаны замены в 102 позиции на ARG, HIS, LYS (рис. 3), и GLU, GLN (рис. 4), и ASN, ASP (рис.5 и 6), и SER, THR (рис. 7 и 8).
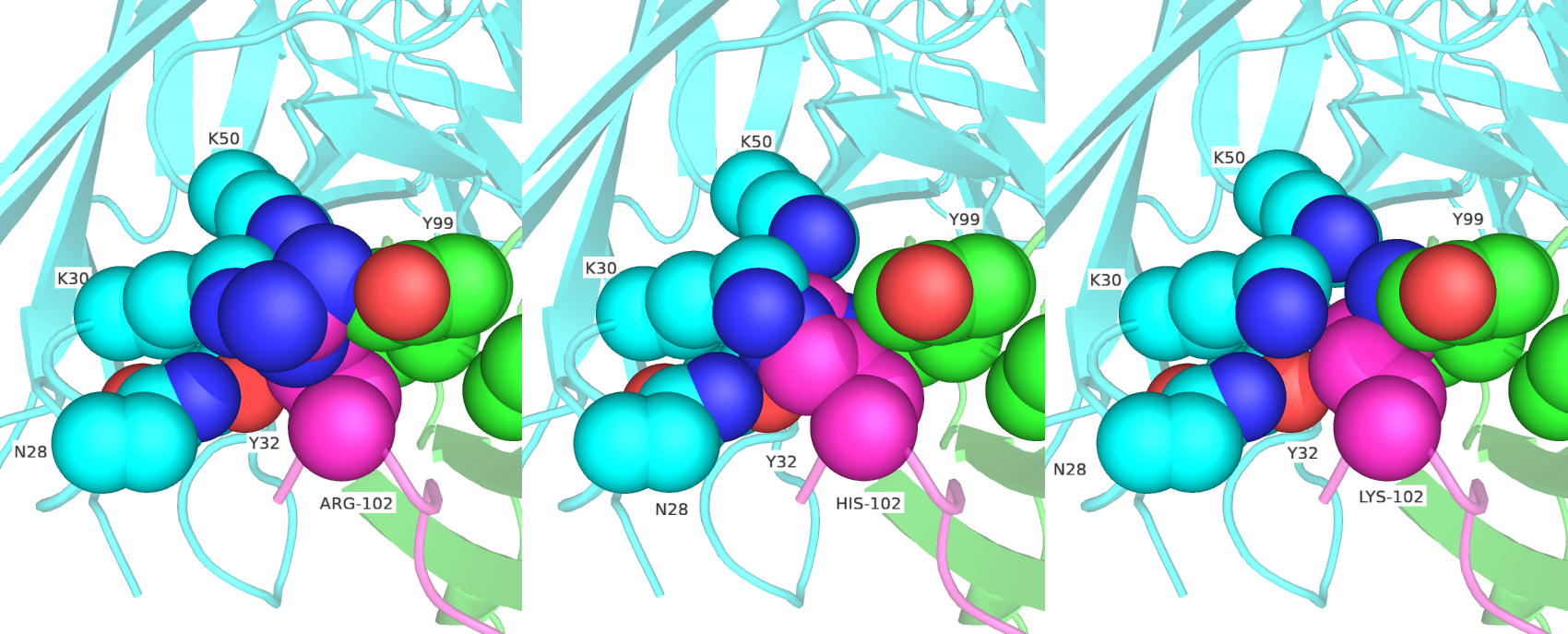

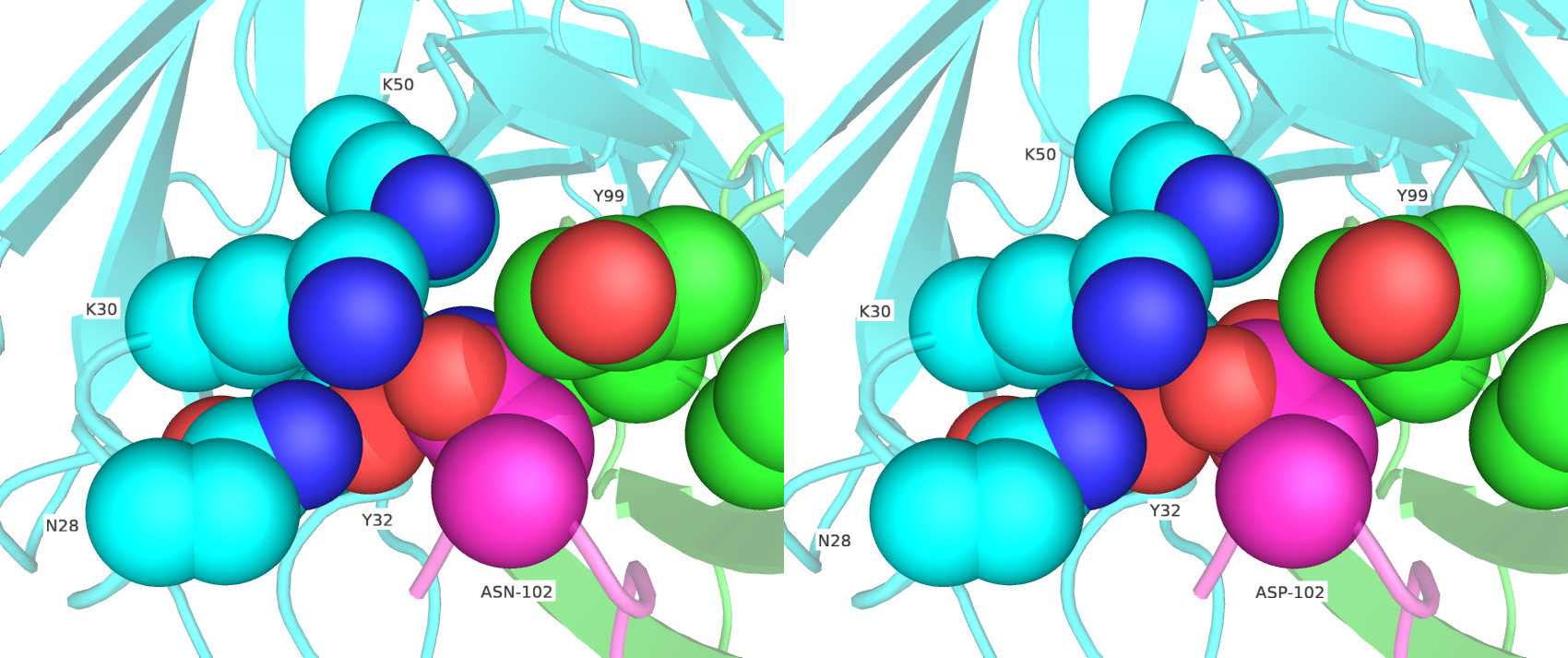
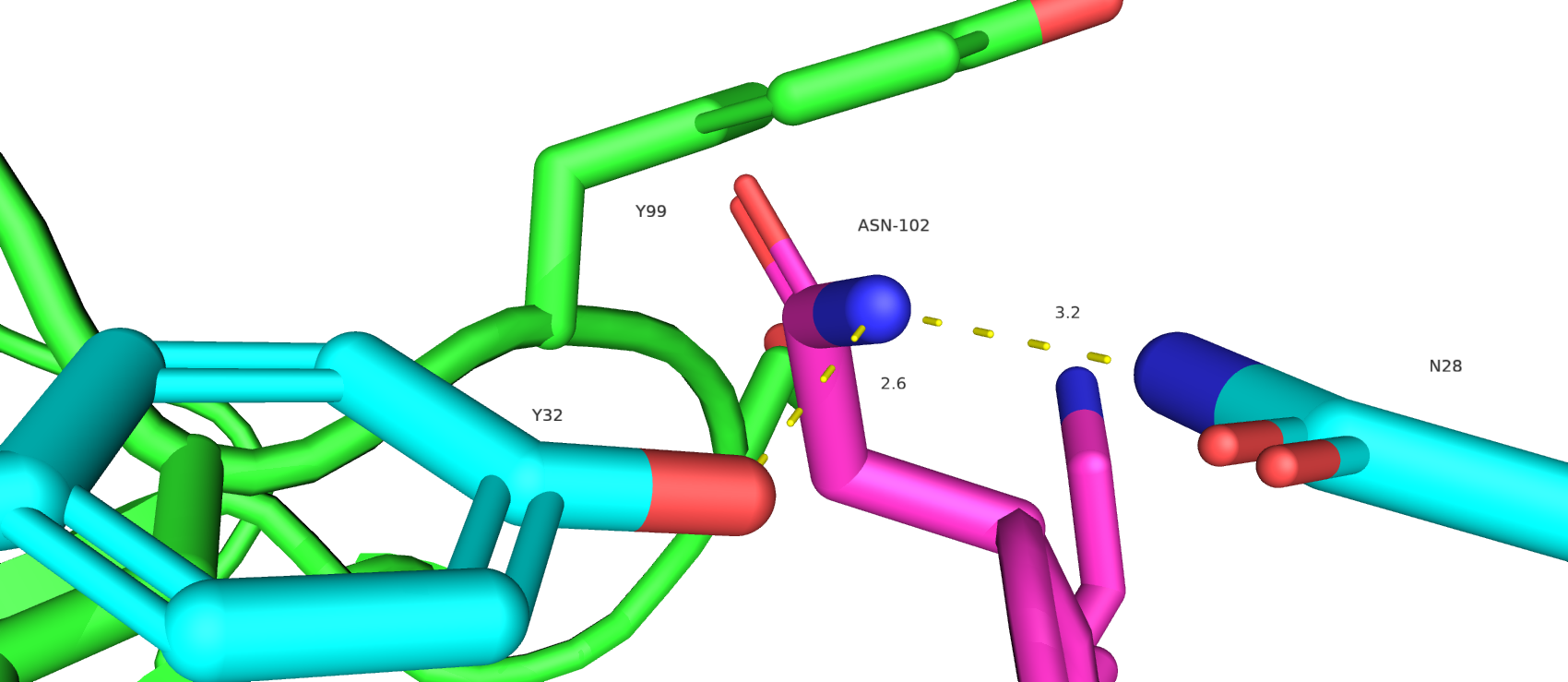
Исходя из данных перебора, исходными остатками в 102 позиции с наибольшей вероятностью были ASN при условии поворота, SER, THR. Они демонстрируют оптимальную удаленность от атомов окружающих их остатков, а также положение бокового радикала, позволяющее вступать в энергетически выгодное взаимодействие с окружением. На рисунке ниже представлены возможные взаимодействия THR-102 и ASN-102 с окружающими его остатками.