Визуализация молекул в JMol
Пожалуйста, терпеливо дождитесь загрузки страницы. Первый скрипт выполняется довольно долго. Запускайте скрипты по порядку, иначе ничего не работает. Если сделать так, чтобы все работало в любом порядке, то сильно снижается скорость.
|
|
Тексты скриптов:
Скрипт 1 Скрипт 2 Скрипт 3 Скрипт 4Изучение гидрофобного ядра белка
I При помощи сервиса CluD нашли гидрофобное ядро анаэробной рибонуклеотид редуктазы бактерии Thermotoga maritima (PDB ID: 4COI ).
В гидрофобном ядре данного белка 2873 атома. Программа выдала несколько гидрофобных ядер, но только одно крупное. Всего в белковой цепи 9995 атомов. (Не считаем атомы лиганда и окружающие молекулы воды). То есть гидрофобное ядро составляет 28,74% белка.
Гидрофобное ядро раскрашено в зеленый, остальные атомы белка в серый. Как видно гидрофобное ядро не полностью погружено внутрь глобулы, а выходит на поверхность. Возможно, это нужно для стабилизации конформации белка, или же по-другому – более компактно упаковать неполярные остатки не получается.
Наличие плотного гидрофобного ядра типично для глобулярных белков. [1: T.1 c.195]
Гидрофобные аминокислотные остатки в значительной мере убраны внутрь белковой молекулы для минимизации контакта с водой.
Чистая вода представляет собой сеть связанных водородными связями молекул Н2О. Любые «посторонние» молекулы нарушают эту структуру. Гидрофобные молекулы в воде окружаются сольватной оболочкой (структурированной оболочкой из молекул воды), возникающей в результате оптимальной организации водородных связей. Упорядоченность молекул воды возрастает, следовательно понижается энтропия, что неблагоприятно с точки зрения термодинамики. Но если неполярные молекулы в воде образуют компактные кластеры, то размер сольватной оболочки уменьшается и энтропия понижается не так сильно. Энтропия является главной силой, заставляющей гидрофобные молекулы ассоциировать в растворе. Вспомните, как масло собирается в воде в компактный шарик.
Гидрофобный эффект в водных растворах простых неполярных веществ был хорошо известен физикохимикам, когда Каузман в 1959 г. Обнаружил его большое значение для белковой структуры. [2 c.254]. Неполярные боковые цепи белков ведут себя в растворе как масло – им не выгодно взаимодействовать с водой. Из всех слабых взаимодействий гидрофобные взаимодействия вносят самый значительный вклад в стабильность белковой молекулы.
Как следствие гидрофобного эффекта заряженные остатки практически исключаются из внутренностей белковой молекулы. Однако важно, чтобы все полярные и заряженные боковые группы имели подходящих партнеров для образования водородных связей. Наличие в гидрофобном ядре полярной или заряженной боковой группы, не имеющей партнера для образования водородной связи может оказать настолько сильное дестабилизирующее воздействие, что данная конформация белка будет термодинамически невыгодной. [1 c.173-174] То есть, внутри глобула не полностью подобна капле масла. В то же время не вся поверхность белка несет заряженные или полярные атомы: примерно половина всех ее остатков неполярны [2 c. 254]. Неполярные участки на поверхности глобулы фермента могут быть нужны для взаимодействия с субстратом или для стабилизации четвертичной структуры.
II Исследовали плотность упаковки атомов в гидрофобном ядре.
На каком минимальном расстоянии от остатка расположены атомы, которые полностью покрывают его поверхность (так, что практически не видно атомов этого остатка)?
Атомы, расположенные на расстоянии 4 Å, закрывают исследуемый остаток с одной стороны. Но сколько бы дальше мы ни увеличивали расстояние (5, 6, 7, 10Å), исследуемый остаток не полностью закрыт окружающими атомами – он виден.
Может ли между соседними атомами поместится еще один, молекула воды, например?
Молекулу воды можно считать одним атомом кислорода, диаметром ≈ 2,8 Å. Пусть молекула находится в окружении атомов кислорода – у них самый маленький ван-дер-ваальсов радиус, среди всех органогенных элементов, не считая водород. То есть, еще + 2,8Å. Итого 5,4 Å. Учитывая, что характерное расстояние между соседними, не связанными ковалентно атомами 4 Å, можем сделать вывод, что молекула воды внутри гидрофобного ядра не поместится.
Источники:
[1] Д. Нельсон, М. Кокс. Основы биохимии Ленинжера. Изд. Бином. 2011 г.
[2] А. Леск. Введение в биоинформатику. 2-ое издание.
Изучение ДНК-белкового комплекса
Скрипт 3 демонстрирует комплекс ДНК с белком (с ДНК-полимеразой)
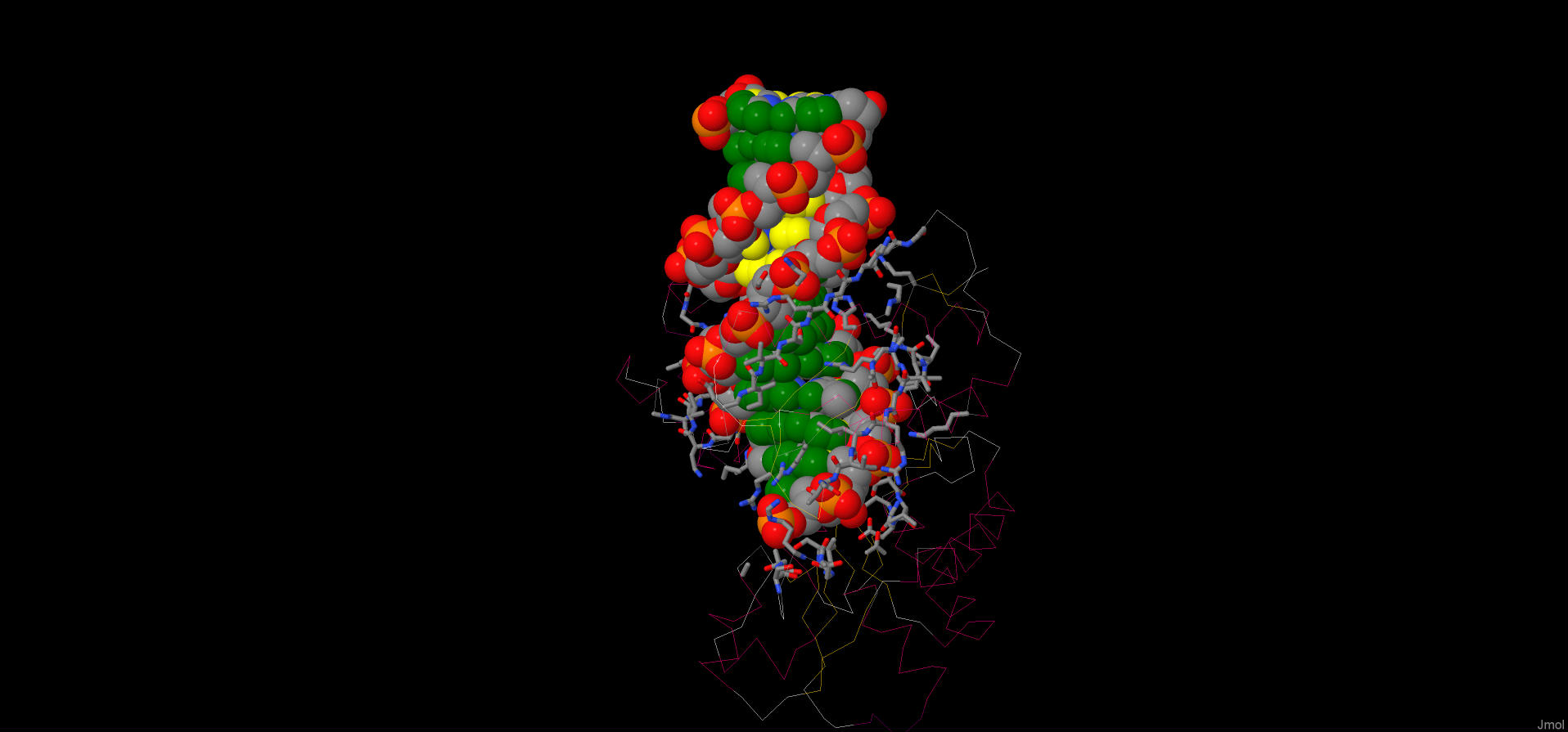
Первое изображения: ДНК и белок в виде картонной модели с раскраской по вторичной структуре.
Мы можем видеть участок молекулы ДНК, с одним из концов которого взаимодействует белок.Участок полипептидной цепи, представляющий собой β-тяж лежит в большой бороздке молекулы ДНК. С противоположной стороны несколько α-спиралей белка взаимодействует с малой бороздкой.
Рассмотрим поподробнее.
Второе изображение: ДНК в виде шариковой модели с раскраской по элементам; белок в виде остовной модели с раскраской по вторичной структуре; боковые цепи белка, взимодействующие с ДНК, в виде wireframe с раскраской по элементам.
Палочками показаны остатки находящиеся на расстоянии 7,0 Å от ДНК, другими словами, остатки непосредственно взаимодействующие с ДНК.
Для того чтобы узнать, с какой частью ДНК взаимодействует белок запустим скрипт 4 . Он определит атомы различных частей ДНК и покрасит их в разные цвета: атомы большой бороздки в зеленый, атомы малой - желтым, сахаро-фосфатный остов – по химическим элементам. Теперь видно, что аминокислотные остатки белка, в основном, взаимодействуют с сахарофосфатным остовом ДНК. Некоторые остатки взаимодействуют с атомами большой бороздки или малой бороздки.
 |
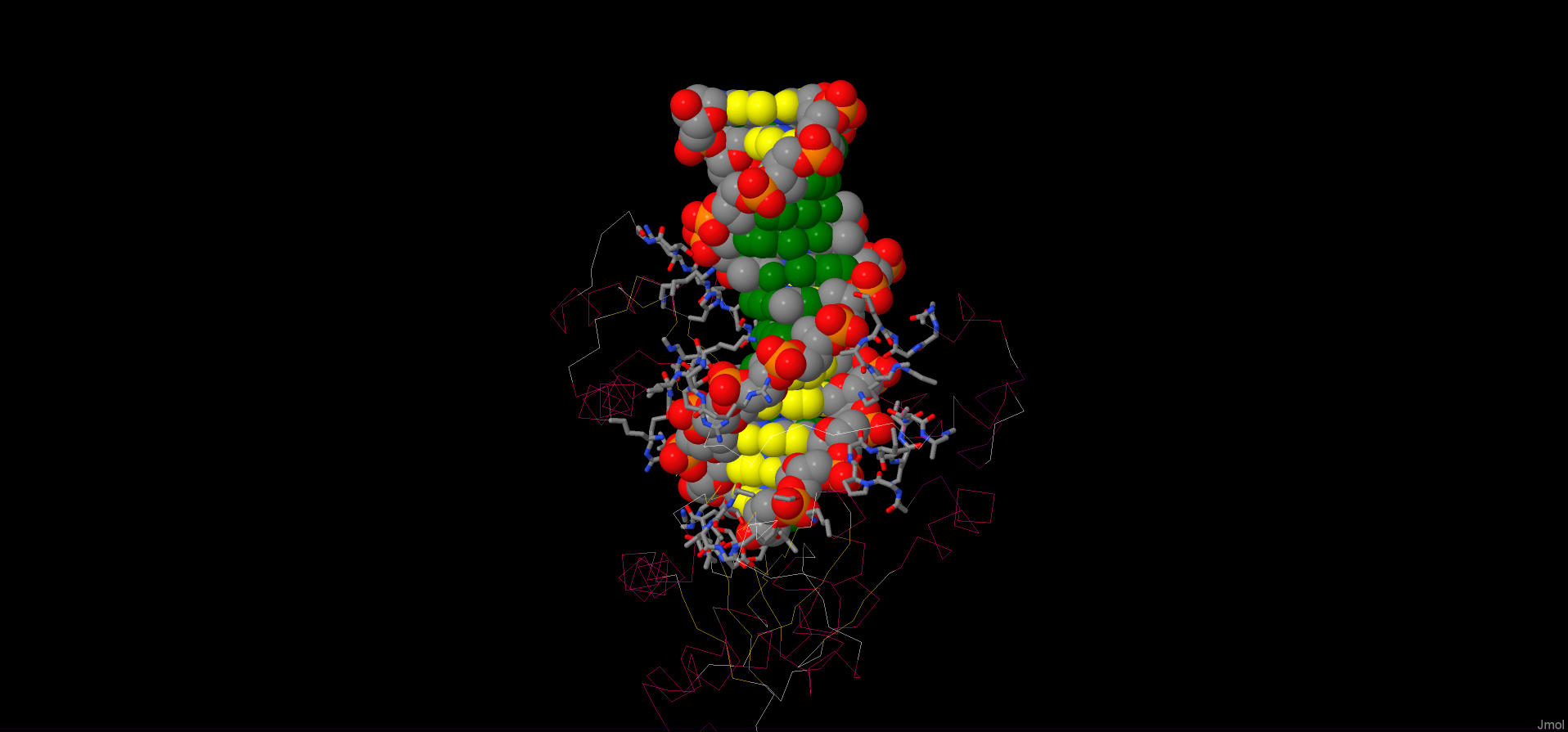 |
Рис.1 Взаимодействие белка с ДНК
Вообще существует довольно много белков, взаимодействующих с ДНК. Гистоны участвуют в компактной упаковке длинной молекулы ДНК. Полимеразы участвуют в репликации и транскрипции. Есть белки регулирующие репликацию и транскрипцию, белки расщепляющие ДНК (эндо- / экзо- нуклеазы) и белки с другими функциями.
Водородные связи белка с сахаро-фосфатым остовом ДНК
calculate hbondsВодородные связи были обнаружены только между аминокислотными остатками. Между сахарофосфатным остовом ДНК и белком нет водородных связей.
Покрасила аминокислотные остатки на расстоянии не менее 7.0 Å в светло-зеленый цвет. Полярные остатки перекрасила в розовый, положительно заряженные – в красный. Видно, что таких остатков довольно много. Рис.2.
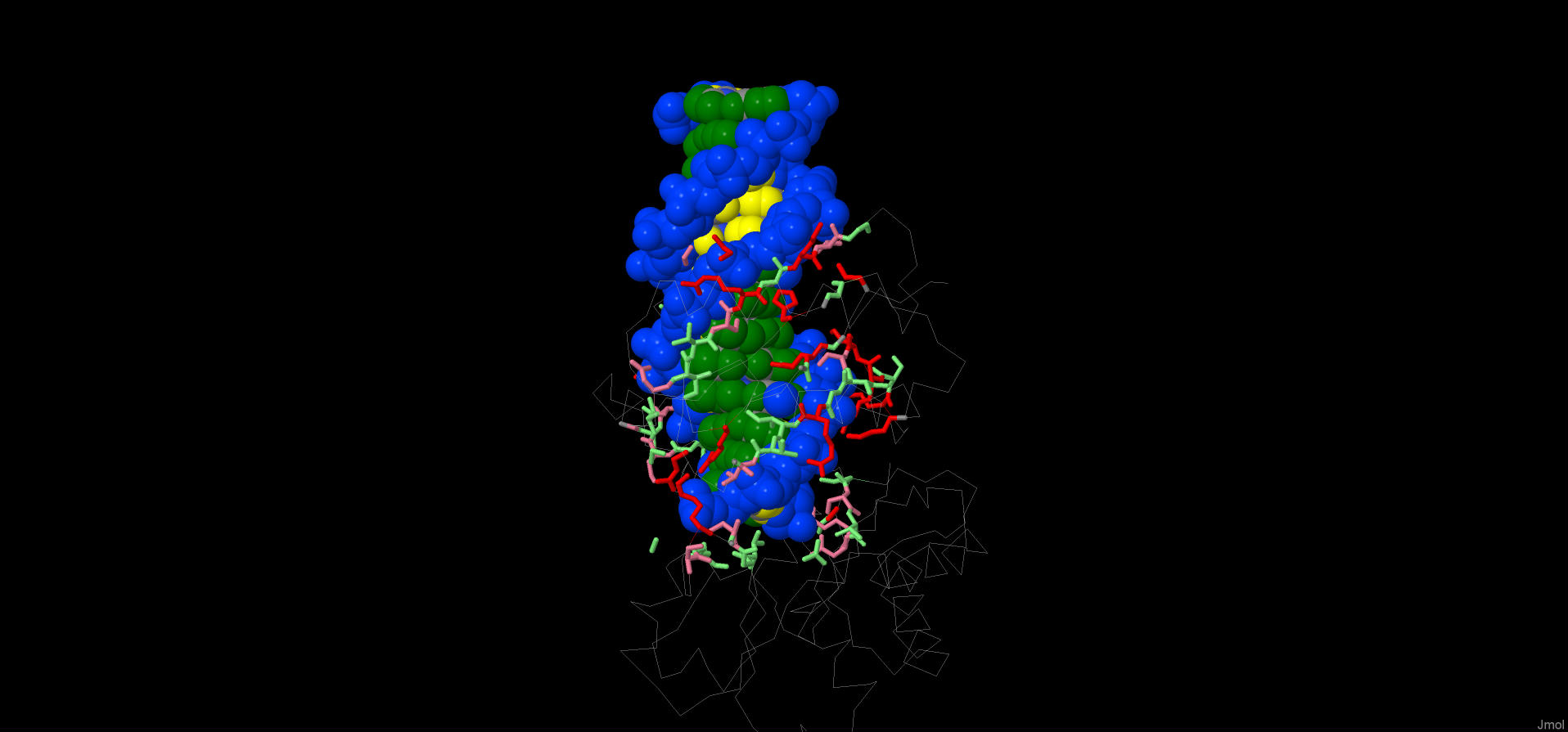
Рис.2 Взаимодействие ДНК и белка
Вспомним, что фосфатные группы имеют рКа = 0 и полностью ионизированы при рН = 7. Их отрицательные заряды могут компенсироваться взаимодействием с положительно заряженными аминокислотными остатками белка. [1]
Водородных связей между ДНК и белком не образуется. Взаимодействие ионное.
[1] Основы биохимии Ленинджера т.1 с 396
