Лиганды в белке β-лактамаза
Данная β-лактамаза имеет три различных лиганда - ионы кальция, хлора и 4-(2-гидроксиметил-1-пиперазин этансерная кислота. Я решил подробнее рассмотреть область контакта белка с ионами кальция в биологической единице белка, которая является димером ассиметрической единицы. На рисунке 1 видно, что ионы кальция равномерно распределены по поверхности белка, что связано, скорее всего, с большим количеством отрицательно-заряженных остатков на поверхности белка (см. общее описание белка).
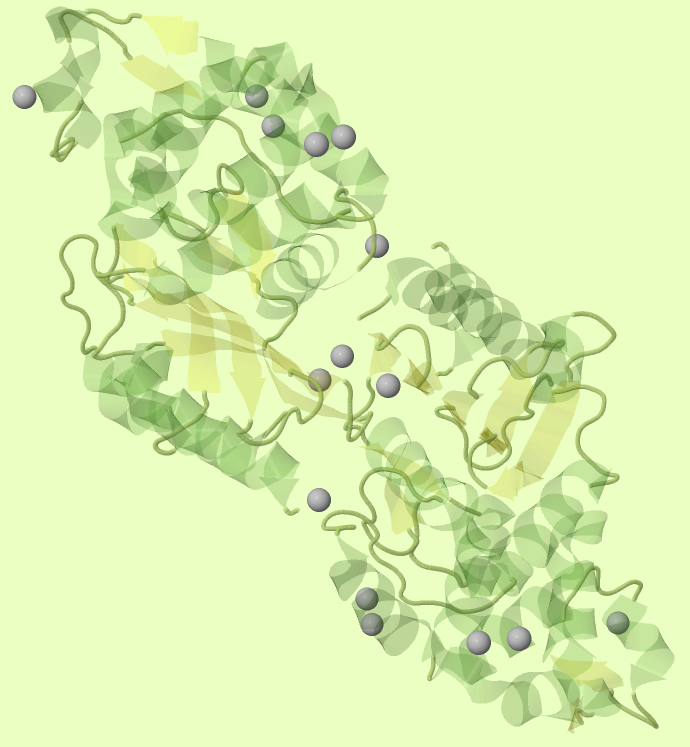 Рис.1.Изображение всех ионов кальция, связанных с биологической единицей белка. Белок показан полупрозрачным цветом в модели "cartoon", атомы кальция - серыми шариками.
Рис.1.Изображение всех ионов кальция, связанных с биологической единицей белка. Белок показан полупрозрачным цветом в модели "cartoon", атомы кальция - серыми шариками.
Далее я более подробно рассмотрел место связывания одного иона кальция с белком. Я выбрал кальций, расположенный между двумя субъединицами белка и связанный с симметричными аминокислотными остатками обеих субъединиц. Как видно из рисунка 2 ион кальция связывается с 6 кислородными атомами, принадлежащими остатку Аспарагиновой кислоты, треонина и воды. Скрипт, с помощью которого сожно получить данное изображение можно скачать по этоой ссылке.
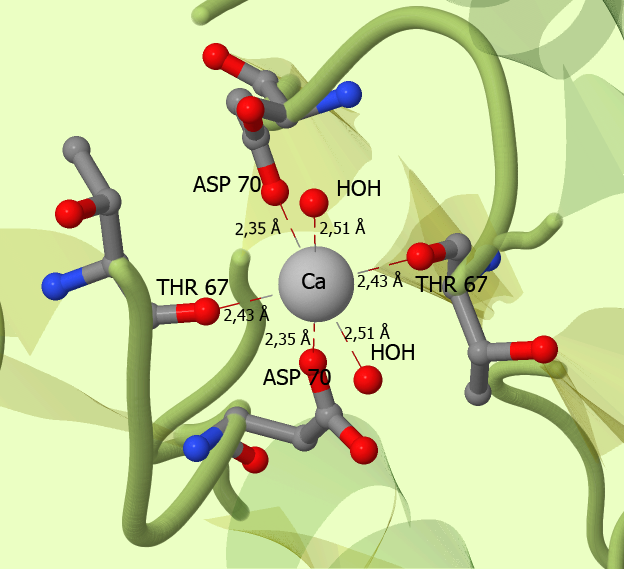 Рис.2.Область контакта белка и лиганда. Белок покрашен полупрозрачным цветом в модели "cartoon", аминокислотные остатки и вода, с которыми связывается кальций показаны в шариковой и проволочной модели. Их атомы раскрашены в соответствии со своей химической природой. Кальций показан в шариковой модели серебристым цветом. Водородные связи - пунктирные линии.
Рис.2.Область контакта белка и лиганда. Белок покрашен полупрозрачным цветом в модели "cartoon", аминокислотные остатки и вода, с которыми связывается кальций показаны в шариковой и проволочной модели. Их атомы раскрашены в соответствии со своей химической природой. Кальций показан в шариковой модели серебристым цветом. Водородные связи - пунктирные линии.
То есть за связывание с кальцием отвечают аминокислотные остатки, содержащие в своём радикале атомы кислорода и замена, например, треонина или аспартата на глутамин или серин не сильно повлияла бы на способность белка связывать кальций. Меньше всего "ущерб" в связывании, я думаю, принесла бы замена треонина на серин, так как в обоих случаях расстояние между кислородом и Cα-атомом, то есть атом кислорода мог бы даже находиться на том же месте, как он находится в белке с треонином. Замена же любого из этих четырёх остатков на положительно-заряженную аминокислоту (лизин, аргинин) или же просто на аминокислоту, которая может занять довольно много места (например, триптофан, или те же лизин и аргинин), приведёт к потере способности белка связывать кальций. Если исходить из того, что мешать может как положительный заряд, так и размер радикала аминокислотного остатка, то "идеальной" кандидатурой является аргинин.
- То есть:
-
- Для сохранения способности белка связывать лиганд нужно чтобы новый аминокислотный остаток:
- имел такой же заряд, как и исходный
- имел такое же (или близкое к исходному) расположение атомов, связывающих лиганд
-
- Для потери способности связывать лиганд необходимо, чтобы новый аминокислотный остаток:
- имел другой заряд, чем исходный (противоположный или смена нейтральный/заряженный)
- имел размеры или структуру, которая может мешать лиганду встать на своё место
- связывал другие аминокислотные остатки, которые могут взаимодействовать с этим лигандом