Остовные водородные связи, вторичная структура белка
Элементы вторичной структуры белка β-лактамазы
Как известно, в геноме с помощью генетического кода закодирована информация о первичной структуре белка - то есть о последовательности аминокислот. Но при этом белок это не неупорядоченная масса, а молекула, имеющая сложную и строгую структуру. Причём белок всегда сворачивается именно в "свою" стркутуру, следовательно информация о вторичной структуре заложена ещё в последовательности аминокислот. Вторичная структура белка - это α-спирали и β-складчатые листы. Эти структуры поддерживаются водородными связями. Водородная связь намного слабее ковалентной, но за счёт их большого количества α-спирали и β-листы являются прочными структурами.
Водородная связь образуется за счёт того, что на некоторых электроотрицательных атомах (в данном случае это будут атомы кислорода и азота) образуется избыток электронной плотности, а на атомах водорода - недостаток. Таким образом происходит слабое донорно-акцепторное взаимодействие. Также атом, имеющий избыточную электронную плотность приобретает небольшой отрицательный заряд, атом с дефицитом электронной плотности - положительный, и донорно-акцепторный механизм "подкрепляется" электростатическим взаимодействием. Отдельно такая связь очень слабая, но так как их образуется много, то они позволяют поддерживать вторичную структуру белка.
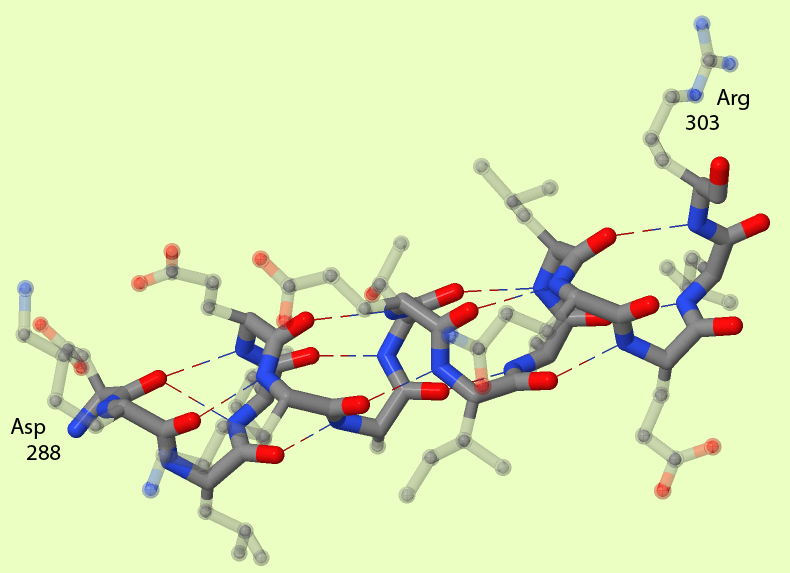
Одним из элементов вторичной структуры белка является α-спираль. Эта структура поддерживается за счёт водородных связей, возникающих между кислородом "остова" аминокислоты и водородом, присоединённым к азоту "остова" другой аминокислоты. Водородная связь соединяет аминокислоты, расположенные в 4 аминокислотных остатках друг от друга (как это и видно на рисунке 1).
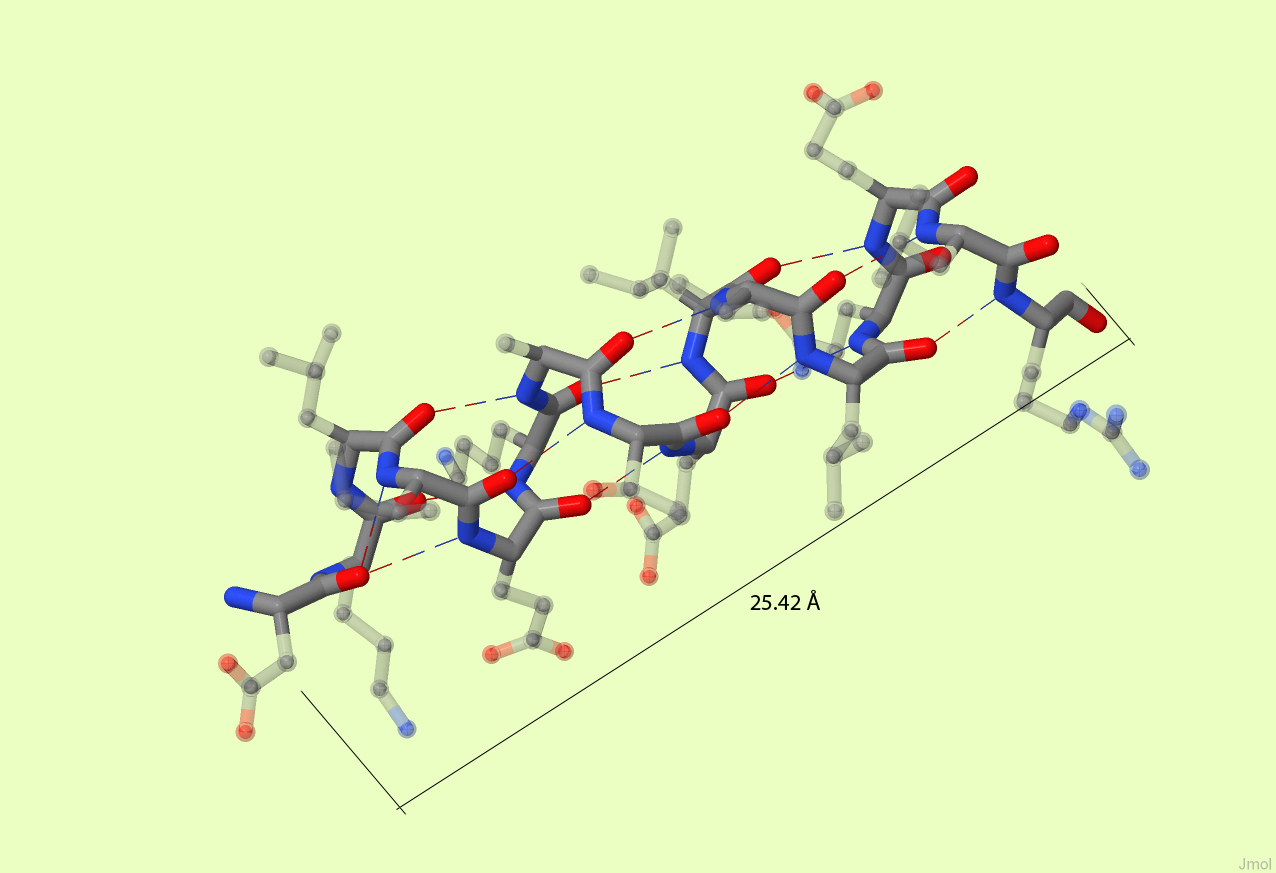
Как видно из рисунка 1б, длина α-спирали примерно равна 25.42 Å. на том же рисунке видно, что спираль делает 4 витка. Следовательно шаг спирали - это 6.355 Å. Число аминокислотных остатков, входящих в эту α-спираль равно 16, следовательно на каждый виток спирали приходится по 4 аминокислотных остатка.
 |
 |
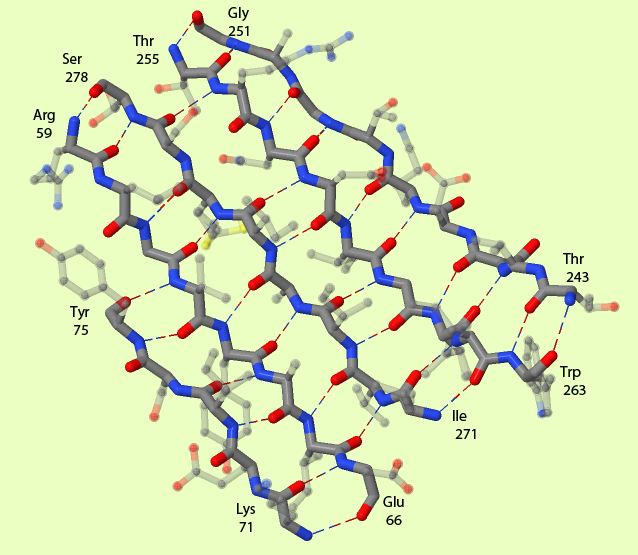
В β-складчатых структурах белковые цепи располагаются практически прямо, водородные связи образуются с соседними цепями, а радикалы аминокислотных остатков располагаются с одной из сторон получившейся структуры. несколько таких цепей образуют β-складчатый лист. Различают параллельныепараллеьное и антипараллельное расположение цепей. Параллельное - когда у соседних цепей N и C - концы располагаются одинаково, антипараллельно - в противоположных концах. Как видно из рисунка 2, все цепи расположены антипареллельно друг-другу.
 |
 |
б). Градиентом - от жёлтого к зелёному и стрелками показано направление от N-конца цепи к C-концу цепи.