Описание структуры РНК-связывающего белка, TiaS-tRNA(Ile2)-AMPCPP-agmatine complex
1) Структура в целом
Кристаллические структуры TiaS-тРНК(Ile2) Archaeoglobus fulgidus в комплексе с АТФ или с AMPCPP и агматином раскрывают модуль киназы, необходимый для активации C34 путём фосфорилирования, и демонстрируют молекулярный механизм, с помощью которого TiaS различает тРНК(Ile2) и тРНК(Met).
Тип макромолекул - белок, в нем присутствует одна уникальная А-цепь. Белок состоит из одной биологической единицы (рис.1, 3d конструкция), в нее входит одна полимерная цепь. Биологическая единица идентична ассиметричной.
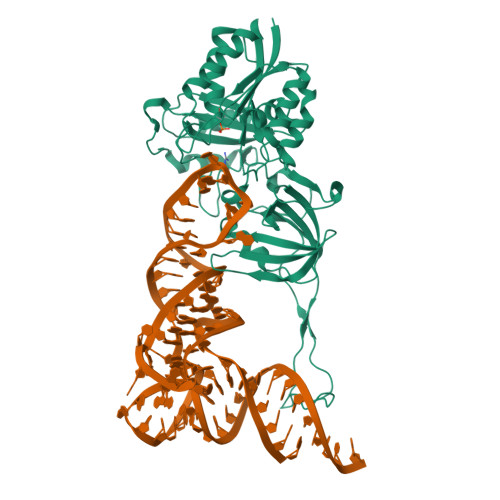
В структуре имеется одна белковая цепь А и одна цепь нуклеиновых кислот В. На рис.2 розовым цветом обозначена цепь А, оранжевым - В.
2) Отдельные цепи
Цепь А
Данная цепь транслируется у Archaeoglobus fulgidus - сульфатредуцирующая архея-термофил. Это первая архея с метаболизмом, основанным на серосодержащих соединениях, геном которой был секвенирован. Он состоит из одной хромосомы, плазмид не обнаружено.
UNIPROT_ID: O28025
Название белка: тРНК (Ile2) 2-агматинилцитидинсинтетаза TiaS
Функция: АТФ-зависимая агматинтрансфераза, которая катализирует образование 2-агматинилцитидина (agm2C) в позиции «колебания» (C34) тРНК(Ile2), изменяя специфичность кодона с AUG на AUA.
В последователтности относительно референса 0 мутаций
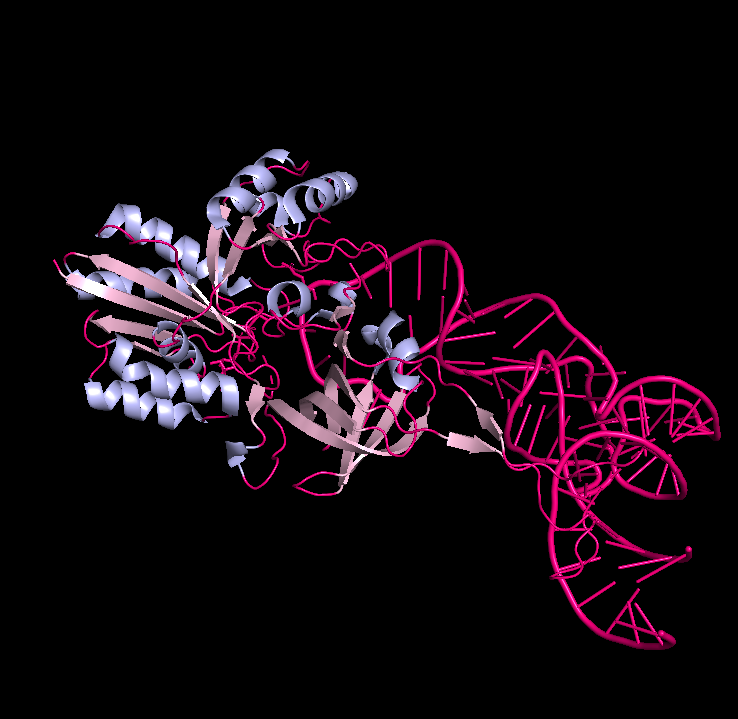
Вторичная структура белка представлена преимущественно альфа-спиралями. На рис.3 изображены бетта-листы светло-розовым цветом, альфа-спирали - голубым.
3) Малые молекулы
1. APC - DIPHOSPHOMETHYLPHOSPHONIC ACID ADENOSYL ESTER
2. AG2 - AGMATINE
3. TRO - L-PEPTIDE LINKING.
На рис.4 показано изображение белкового окружения, название аминокислот, а такаже наименование лиганда
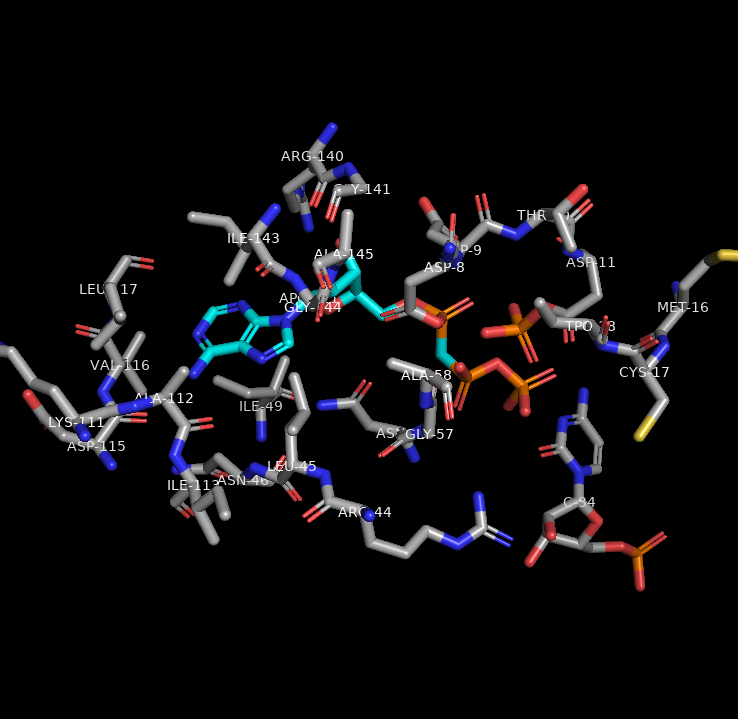
Взаимодействия между аминокислотными остатками
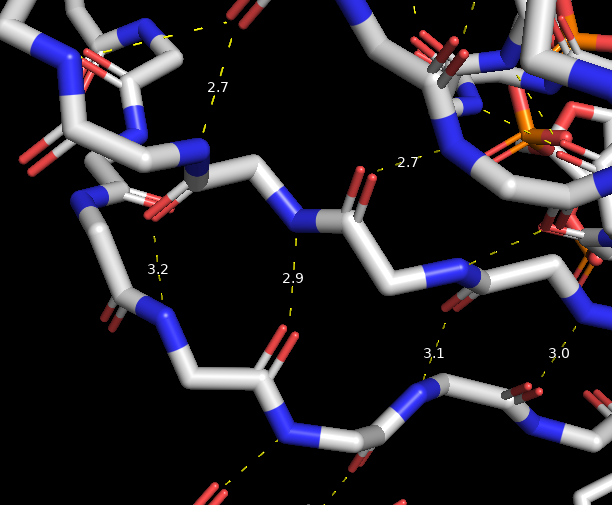
На рисунках 5,6 проиллюстрированы водородные связи, найденные в анализуемом белке. Расстояние между атомами от 2,5 до 3,5 ангстрема.
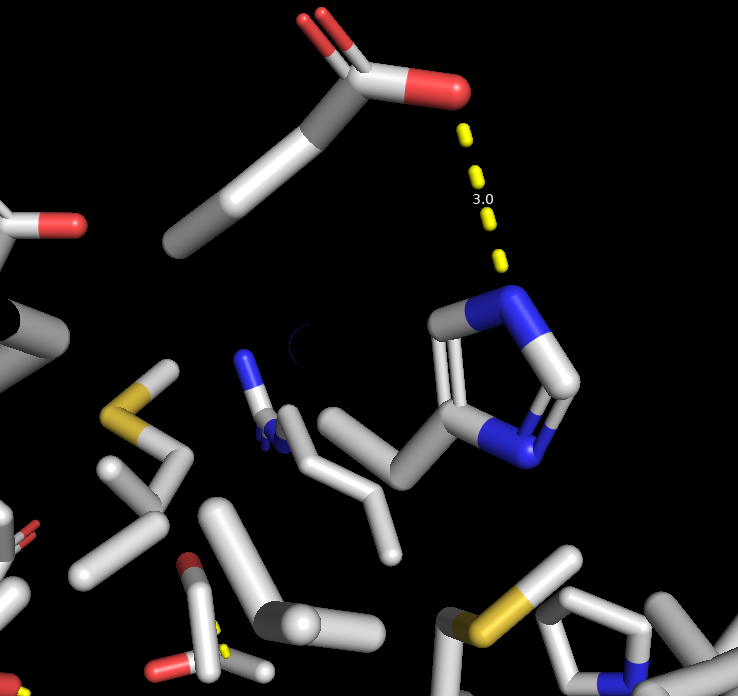
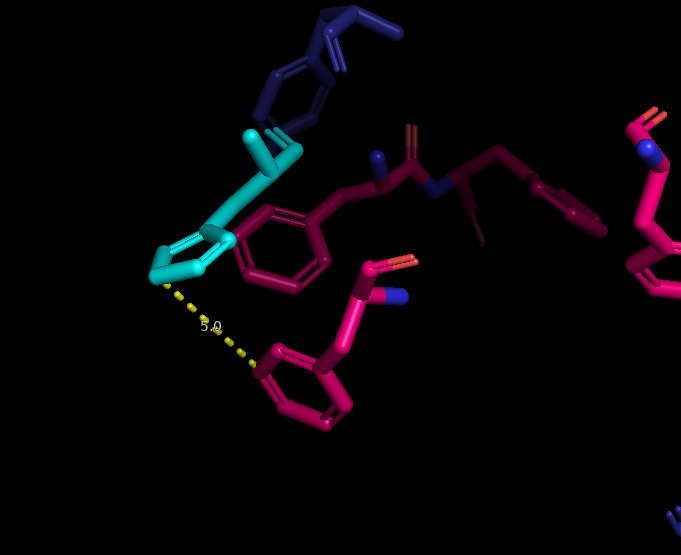
Далее были обнаружены солевые мостики. Один из примеров представлен на рис.7.
Дисульфидных связей не было обнаружено, на рис.8 можно увидеть расположение Cys(C). Как видно, аминокислоты расположены достаточно далеко, что приводит к невозможности образования связи
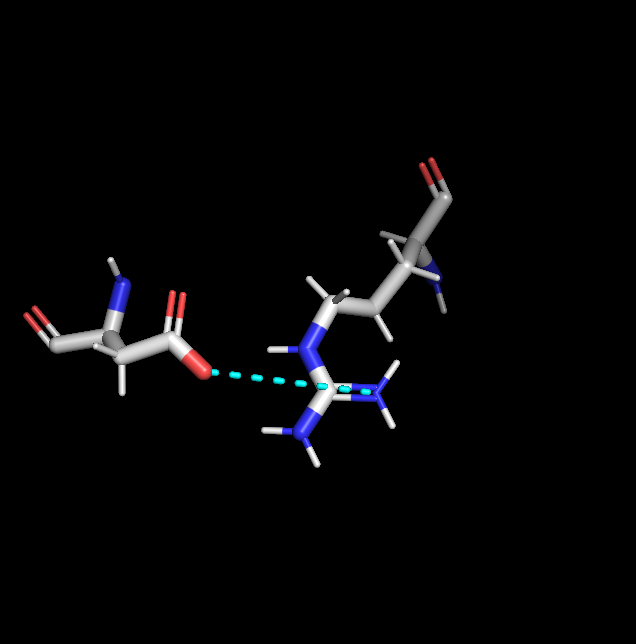
На рис.9 приведен пример стэкинговых взаимодействий