Мембранные белки
База данных OPM
 |
| Рис. 1. Структура белка 3L1L |
Он был найден в базе данных OPM (Orientation of Proteins in the Membrane), которая содержит предсказания о положени белков относительно мембраны.
Затем с помощью поиска по уровням классификации было необходимо найти любой белок, в трансмембранной части которого находятся не α-спирали, как в нашем белке, а β-листы, и описать оба белка по заданным параметрам.
В качестве белка с β-листами был выбран 2HDF - рецептор колицина I из того же организма (Escherichia coli).
В таблице ниже приведены описания белков, а также изображения их расположения по отношению к мембране. Красным цветом показана внешняя часть мембраны, а синим - внутренняя.
| Белок | 3L1L (цепь A) | 2HDF |
| Название | Arginine/agmatine transporter (AdiC) | Colicin I receptor |
| Классификация | Тип: 1. Трансмембранный Класс: 1.1. Альфа-спиральный политопный Суперсемейство: 1.1.026. APC (Amino acid-Polyamine-organoCation) Семейство: 1.1.26.05. APC (Amino acid-Polyamine-organoCation) |
Тип: 1. Трансмембранный Класс: 1.3. Бета-бочонковый трансмембранный Суперсемейство: 1.3.020. Лиганд-зависимые белковые каналы (n=22,S=24) Семейство: 1.3.20.01. Рецепторы внешней мембраны |
| Толщина гиброфобной части мембраны | 28.8 ± 1.4 Å | 23.4 ± 0.9 Å |
| Трансмембранные спирали/ β-тяжи (а.о.) |
1(30-53), 2(142- 176), 3(196- 218), 4(255- 280) | 1(164-173), 2(184-192), 3(199-208), 4(235-243), 5(250-258), 6(275-283), 7(288-296), 8(315-323), 9(330-338), 10(362-371), 11(376-384), 12(395-403), 13(408-415), 14(455-463), 15(471-477), 16(531-538), 17(543-550), 18(573-579), 19(587-593), 20(615-624), 21(627-634), 22(655-662) |
| Среднее количество остатков в одной спирали/тяже | 26 | 7-8 |
| Мембрана локализации | Внутренняя мембрана Грам-отрицательной бактерии | Внешняя мембрана Грам-отрицательной бактерии |
| Изображение | 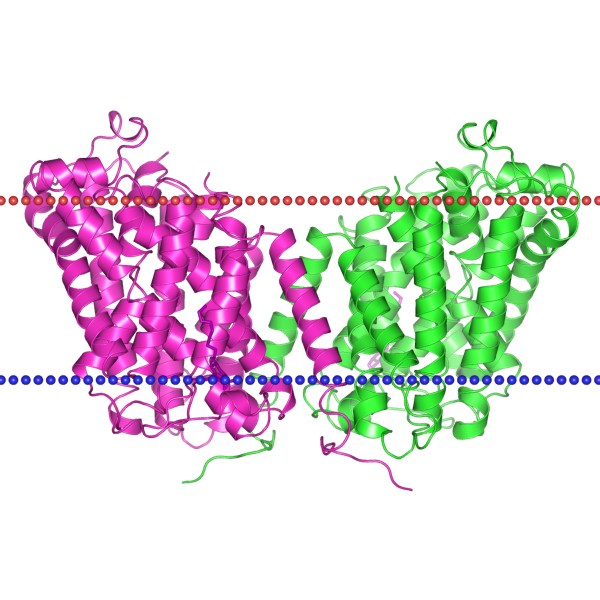 |
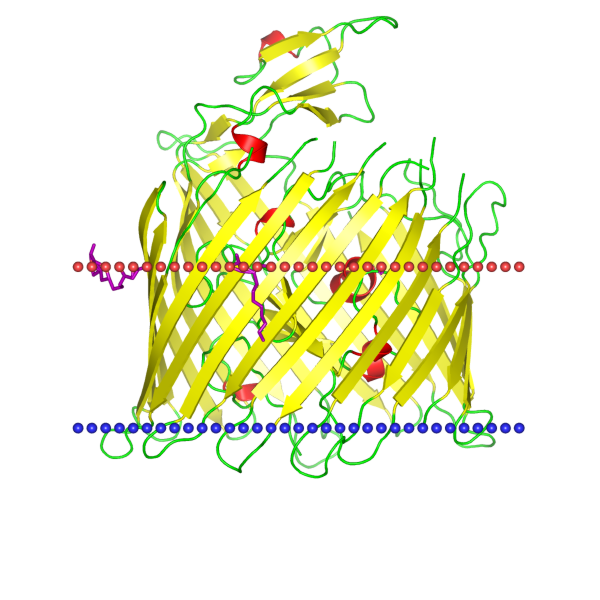 |
Анализ предсказания трансмембранных спиралей
В данном задании было необходимо оценить корректность работы сервисов
TMHMM и
Phobius, предназанченнных для предсказания трансмембранных
участков белков. Для этого оба сервиса были запущены для белка 3L1L (цепь A), и полученные результаты
были сохранены в текстовом и графическом видах.
На рисунках ниже представлена выдача программы Phobius. Рассмотрим для начала текстовый формат.
В нем установлена следующая система обозначений: TMhelix - трансмембранная часть белка,
inside - часть белка, обращенная в цитоплазму, outside - часть белка, обращенная наружу.
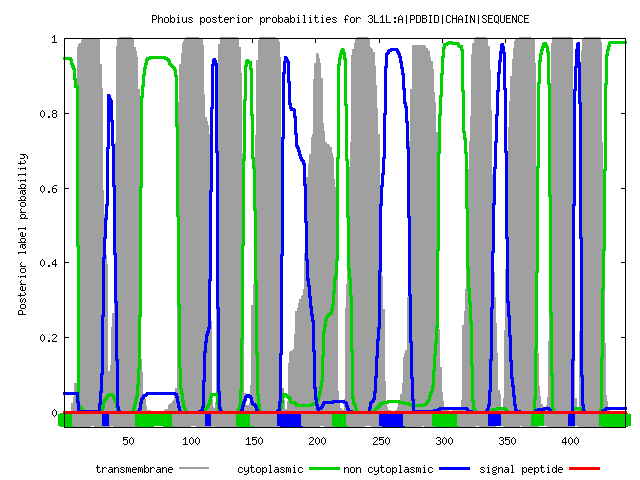
Графическое представление отражает вероятности того, что та или иная часть белка
находится в определенном взаимоотношении с мембраной. На оси Y отображены соответсвующие вероятности,
а на оси Х - аминокислотные остатки белка. Красным цветом показаны предполагаемые трансмембранные
части, розовым - части, обращеннные наружу, синим - части, обращенные внутрь.
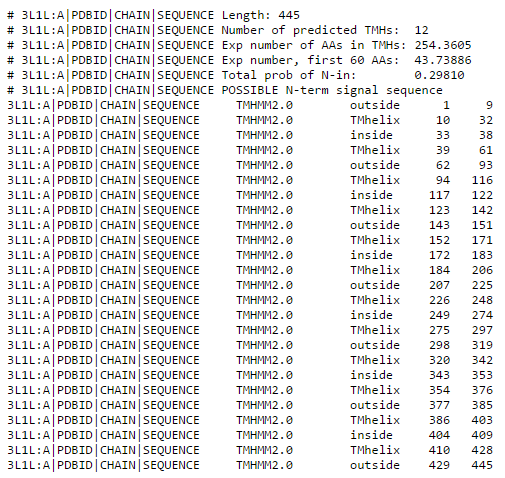
Для нашего белка TMHMM предсказал 12 трансмембранных частей, 7 наружних и 7 внутренних.
На деле же трансмембранных частей всего 4. Получается, что программа ошиблась в целых 3 раза.
Более того, координаты "верно" предсказанных трансмембранных спиралей совпадают с настоящими
лишь приблизительно с погрешностью в среднем 8-10 а.о.
 |
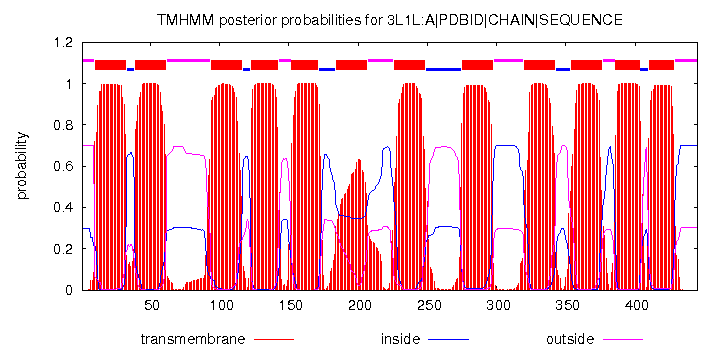 |
| Выдача программы TMHMM для белка 3L1L в текстовом виде | Выдача программы TMHMM для белка 3L1L в графическом виде |
Рассмотрим теперь выдачу Phobius. В тестовом формате заданы следующие обозначения: TRANSMEM - трансмембранная часть, CYTOPLASMIC - часть белка, обращенная в цитоплазму, NON CYTOPLASMIC - часть белка, обращенная наружу. В графическом формате все аналогично предыдущей программе с некоторым изменением цветовой схемы: серый - трансмембранная часть белка, зеленый - цитоплазматическая, синий - наружняя.
Как и TMHMM, Phobius предсказал 8 лишних трансмембранных спиралей. "Верные" спирали вновь имеют не совсем правильные координаты примерно с такой же погрешностью.
 |
 |
| Выдача программы Phobius для белка 3L1L в текстовом виде | Выдача программы Phobius для белка 3L1L в графическом виде |
Таким образом, для исследуемого белка обе программы сработали одинаково плохо. "Незамеченных трансмембранных спиралей выявлено не было, однако оба сервиса предсказали в три раза больше трансмембранных частей, чем указано в БД OPM.
База данных TCBD
В следующем задании было необходимо найти описания исследуемых белков в базе данных
TCBD (Transporter Classification Database).
Эта база предоставляет детальную классификацию мембранных транспортных белков, объединяя
как функциональные, так и филогенетические данные. В ней представлена информация для более чем
600 семейств транспортных белков. Транспортные системы классифицируются на основе 5 критериев,
каждому из которых соответсвует один из 5 символов TC-кода.
В норме TC-код состоит из 5 компонентов: V.W.X.Y.Z. V (число) указывает на класс транспортера
(например канал, первичный активный транспортер и т. п.), W (буква) указывает на подкласс,
X (число) - на семейство, Y (число) - на подсемейство, а Z соответсвует собственно
транспортеру со специфическими субстратами.
Белок 3L1L в этой базе данных не представлен, но зато там есть информация по второму белку, 2HDF.
2HDF имеет следующий TC-код: 1.B.14.1.4.
Расшифровка:
- 1: Класс каналы/поры (Channels/Pores)
- 1.B: Подкласс β-бочонковые порины (β-Barrel Porins)
- 1.B.14: Семейство рецепторов внешней мембраны (The Outer Membrane Receptor (OMR) Family)
В базе данных приводится подробное описание всех крупных систематических групп до семейства включительно. Белок 3L1L является CirA Fe3+-катехолат рецептором, а также рецептором колицина, и принадлежит к семейству рецепторов внешней мембраны.
Семейство рецепторов внешней мембраны (The Outer Membrane Receptor (OMR) Family) включает обширную группу отсеквенированных Грам-отрицательных бактериальных белков внешней мембраны, формирующих мембранные поры и транспортирующих относительно крупные молекулы из внешней среды в периплазму в энергитическом процессе. Энергетизации процесса обеспечивается специфическим для данного семейства белков гетеротримерным комплексом TonB-ExbB-ExbD (в некоторых случаях TolA-TolQ-TolR) и требует наличия протон-движущей силы по разные стороны мембраны.
Субстраты, транспортируемые семейством OMR включают железо-сидерофорные комплексы, витамин В12, Cu2+, колицины и ДНК всевозможных фагов. OMR белки также важны для утилизации железа из эукариотических белков, таких как трансферин, гемоглобин и гемин.