Восстановление кристалла из PDB файла
В PDB файле для структуры Fis1 (PDB ID: 3o48)
в поле CRYST1 можно найти параметры элементарной ячейки кристалла.
| CRYST1 46.020 46.020 139.220 90.00 90.00 90.00 P 43 21 2 8 |
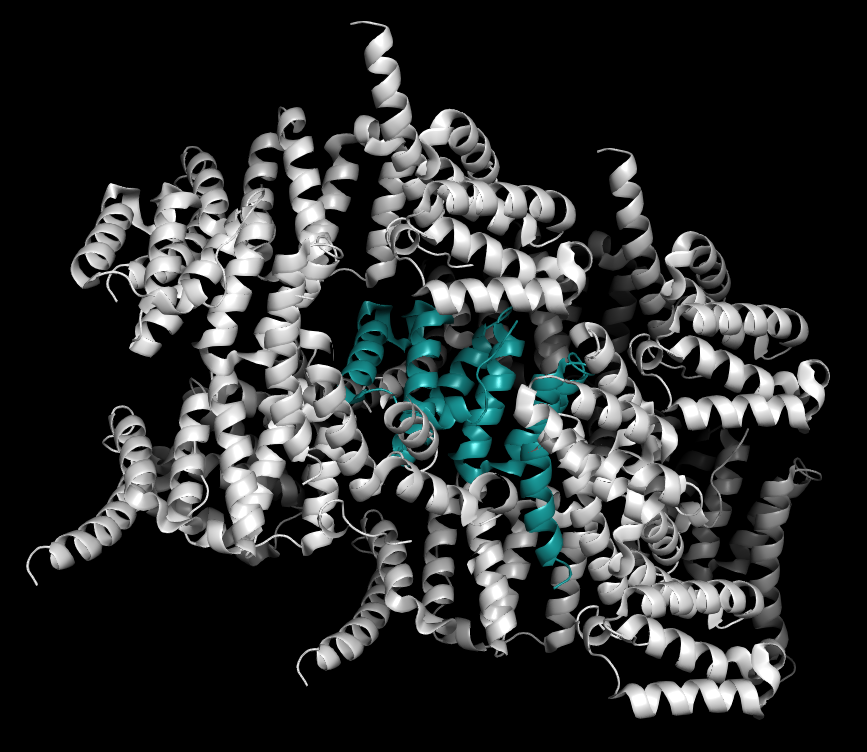 |
| Рисунок 1. Изображение соседних асимметрических единиц в пределах 5Å |
P 43 21 2 - тип симметрии кристалла по символике Германа-Могена (кристаллографическая группа). В нашем случае это примитивная группа (P) c двумя осями винтовой симметрии типов 43 и 21 и поворотной осью типа 2.
Последняя цифра (8) - число молекул в элементарной ячейке.
C помощью команды sympex было получено изображение соседних асимметрических единиц. Сначала были рассмотрены ближайшие соседи на малом расстоянии (Рис. 1). Для получения представления об общей структуре кристалла максимальное расстояние было увеличено до 18Å, а также были изображены границы элементарной ячейки (Рис. 2).
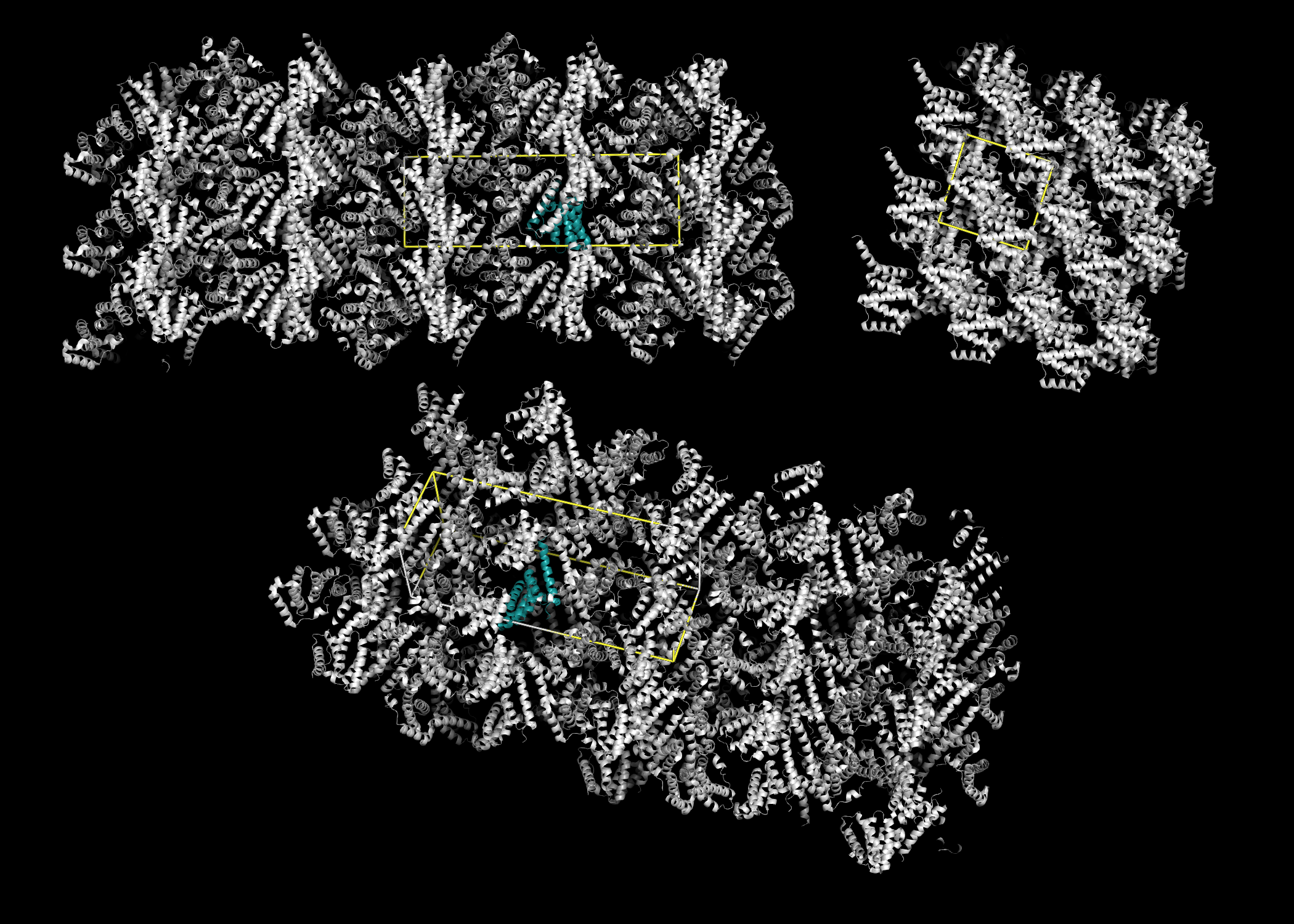 |
| Рисунок 2. Структура кристалла с изображением границ элементарной ячейки в разных проекциях |
Далее было необходимо исследовать зоны контакта между белками из соседних ячеек. В PDB-файле для Fis1 указано, что в элементарную ячейку входит 8 молекул, однако при визуализации структуры оказалось, что ни одна из них не попадает в ячейку полностью. Каждая молекула лежит сразу как минимум в двух ячейках, поэтому говорить о зонах контакта белков соседних ячеек не предаставляется возможным. Тем не менее, можно рассмотреть контакты одного белка с соседними молекулами. Fis1 является мономером, поэтому все такие контакты будут более менее функционально равносильны.
Для начала были исследованы водородные связи между Fis1 и каждой из контактирующих с ним молекул кристалла (со всех сторон). Для этого в исходной молекуле и поочередно в каждом из ближайших объектов Sym* были определены множества полярных аминокислот, и те из них, которые находились не далее 3.5 Å от соседней молекулы, были изображены в виде sticks. Также были изображены молекулы воды в пределах 3.5 Å от предположительно контактирующих а.о. (желтые шарики), поскольку они могут участвовать в образовании водных мостиков. После этого были изображены водородные связи.
С первым "соседом" было найдено 23 водородные связи, однако среди них только 6 являлись связями между аминокислотными остатками. Остальные связи осуществлялись через молекулы воды (Рис. 3).
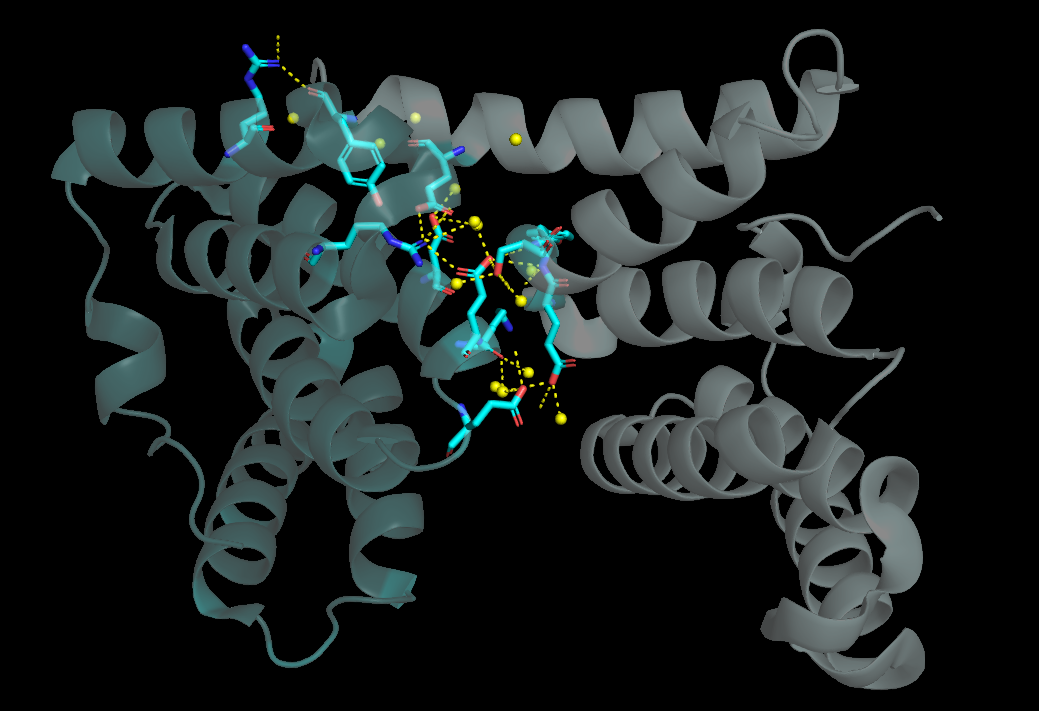 |
| Рисунок 3. Водородные связи между Fis1 и "первым соседом" |
Зона контакта со вторым соседом оказалась совсем не большой. Было найдено лишь 5 связей, среди которых только одна между двумя а.о. (Рис. 4).
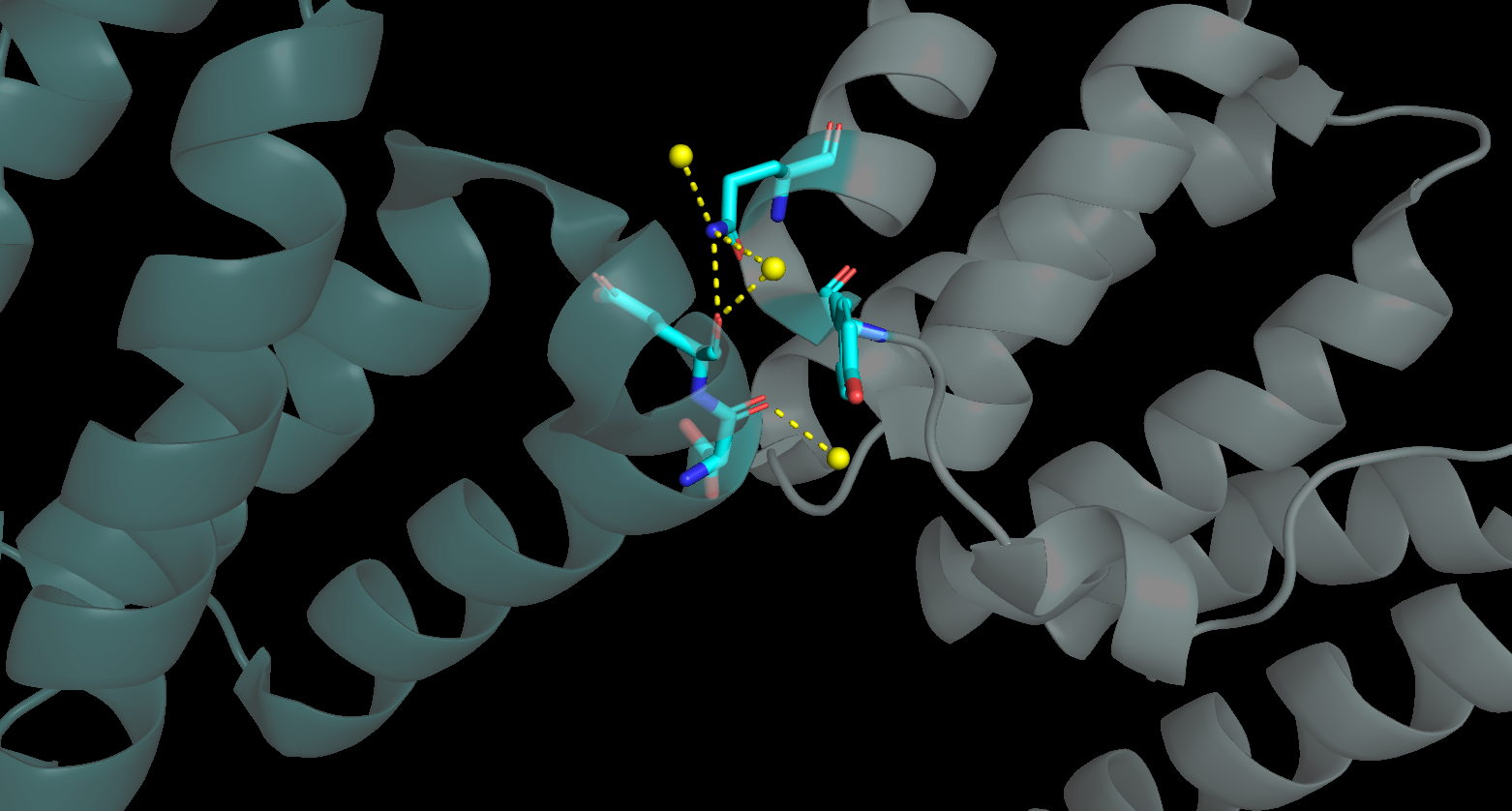 |
| Рисунок 4. Водородные связи между Fis1 и "вторым соседом" |
Для третьего соседа было найдено 4 связи, из них 2 между а.о. (Рис. 5).
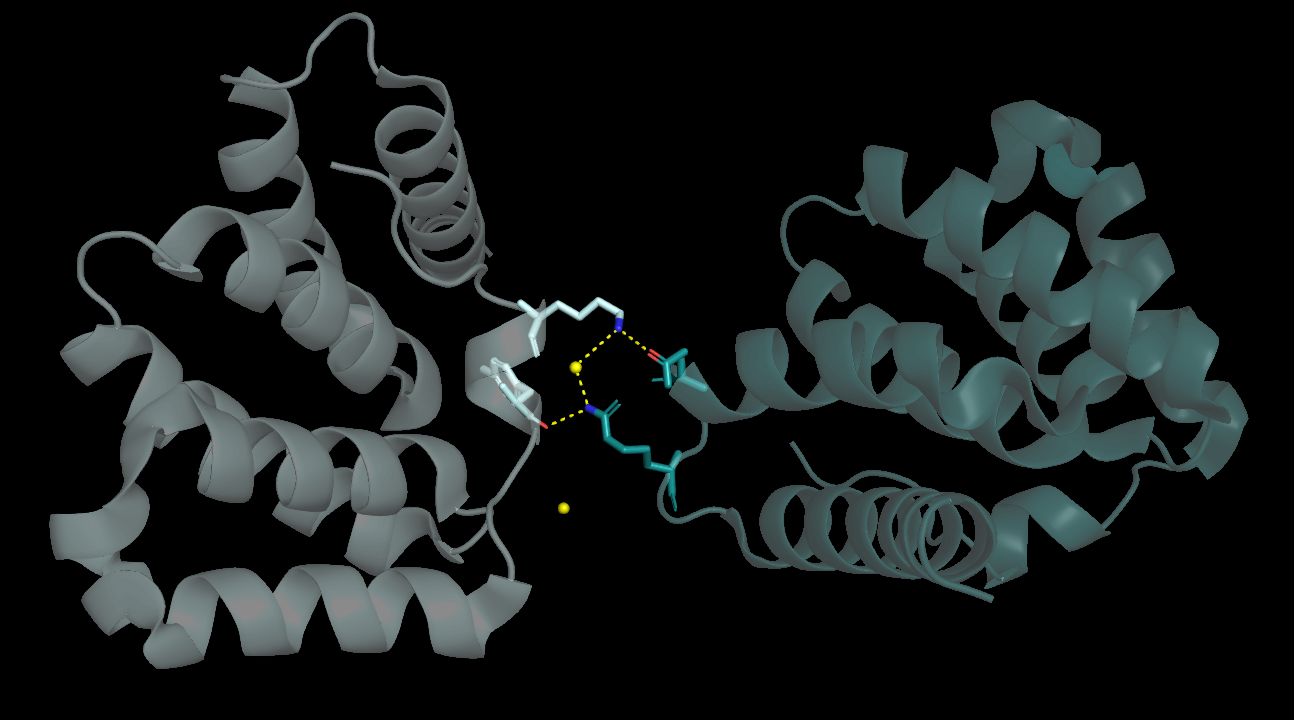 |
| Рисунок 5. Водородные связи между Fis1 и "третьим соседом" |
C четвертым соседом была найдена 1 водородная связь (Рис. 6).
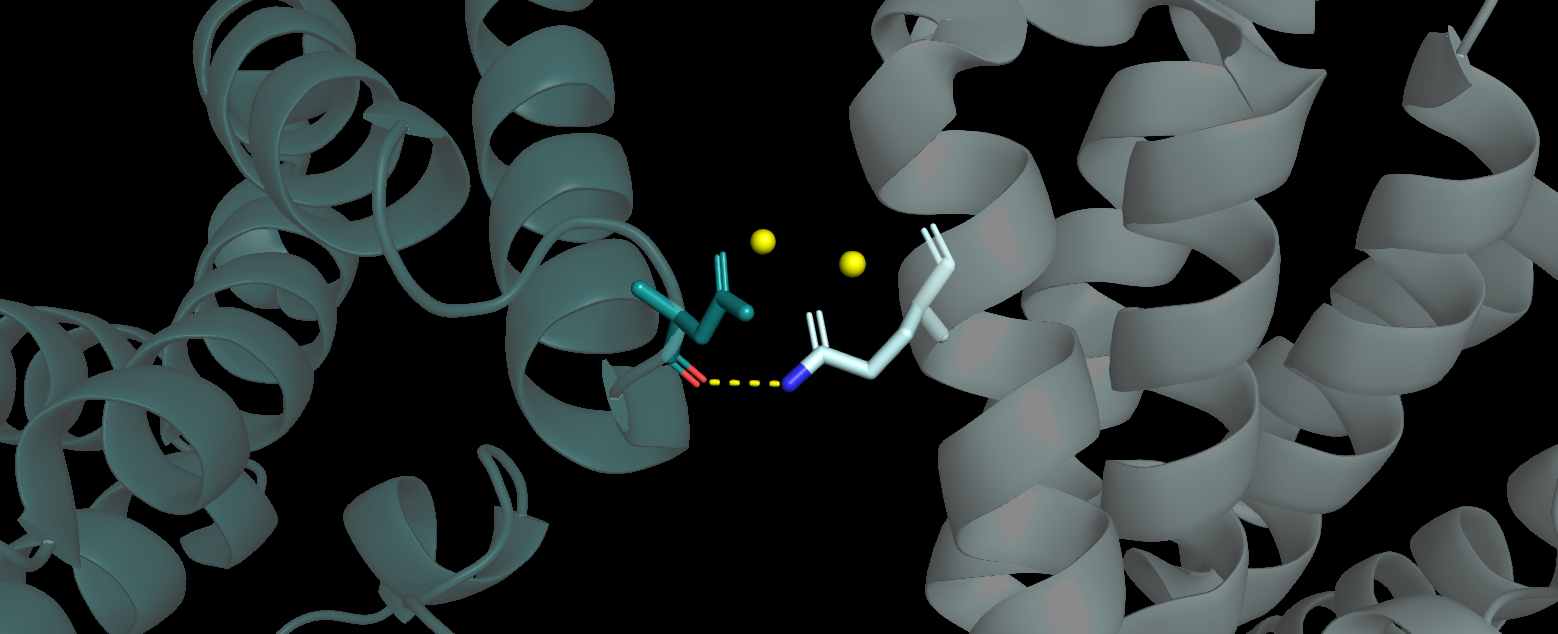 |
| Рисунок 6. Водородные связи между Fis1 и "четвертым соседом" |
C пятым соседом 23 связи, из них 6 между а.о. (Рис. 7). Такую ситуацию мы, вообще говоря, уже наблюдали с соседом 1, только теперь сосед и исходная молекула поменялись местами. Для оставшихся трех соседей подобная ситуация повторилась, поэтому изображения не приведены.
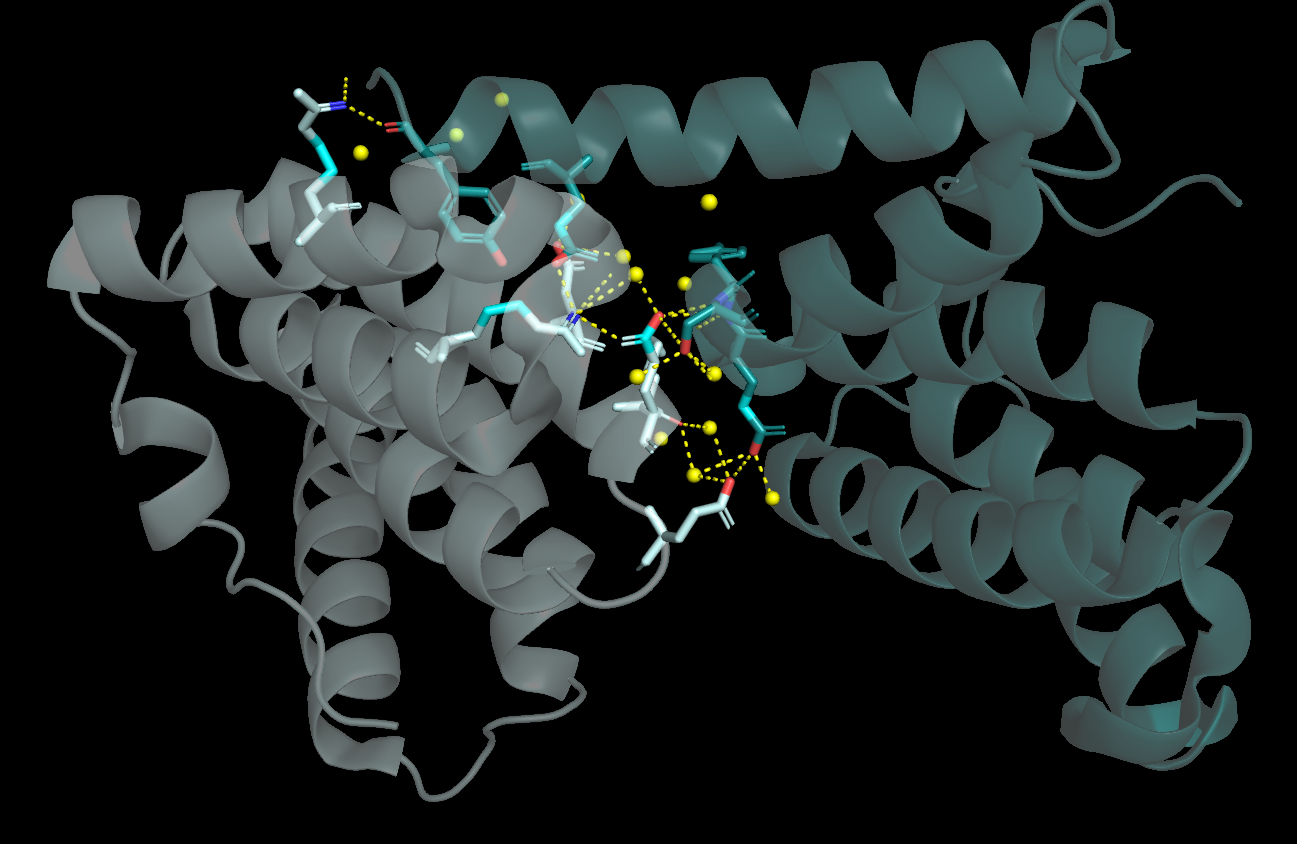 |
| Рисунок 7. Водородные связи между Fis1 и "пятым соседом" |
Из приведенных рисунков видно, что контактов между соседними молекулами крайне мало. К тому же, большинство из них возникают между остатками, экспонированными в растворитель. Скорее всего, они являются артефактом кристаллизации и не отражают природных взаимодействий белков при ди- или олигомеризации.
Помимо полярных контактов, между молекулами белка могут существовать гидрофобные взаимодействия. Чтобы узнать, так ли это для нашей структуры, для Fis1 и соседей были определены множества гидрофобных аминокислотных остатков и построены поверхности (Рис. 8). Гидрофобные участки поверхности окрашены темно-бирюзовым цветом. Молекулы воды показаны желтыми шариками.
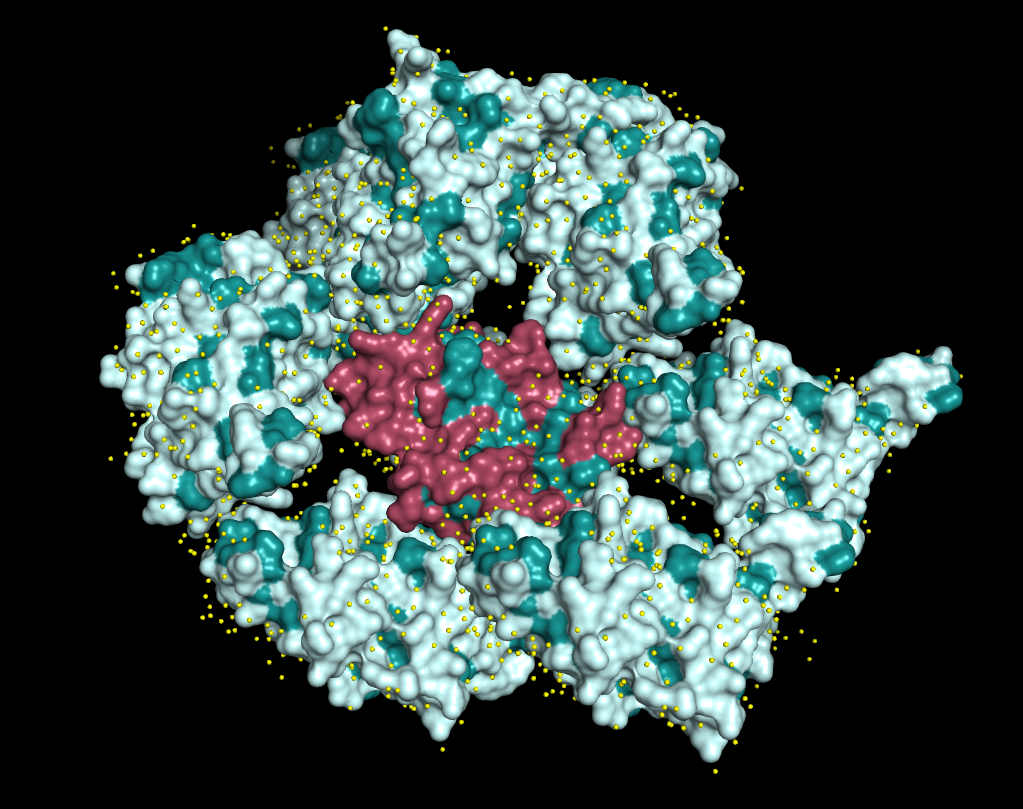 |
| Рисунок 8. Гидрофобные взаимодействия между Fis1 и соседями |
Видно, что белковые молекулы не имеют чётко выделяющихся областей с преобладание гидрофобных остатков. Вода равномерно покрывает белок, включая области контактов. Поэтому гидрофобные контакты между соседними молекулами, скорее всего, отсутствуют.
Объяснение странного расположения белковых цепей в структуре ДНК-белкового комплекса 3hdd
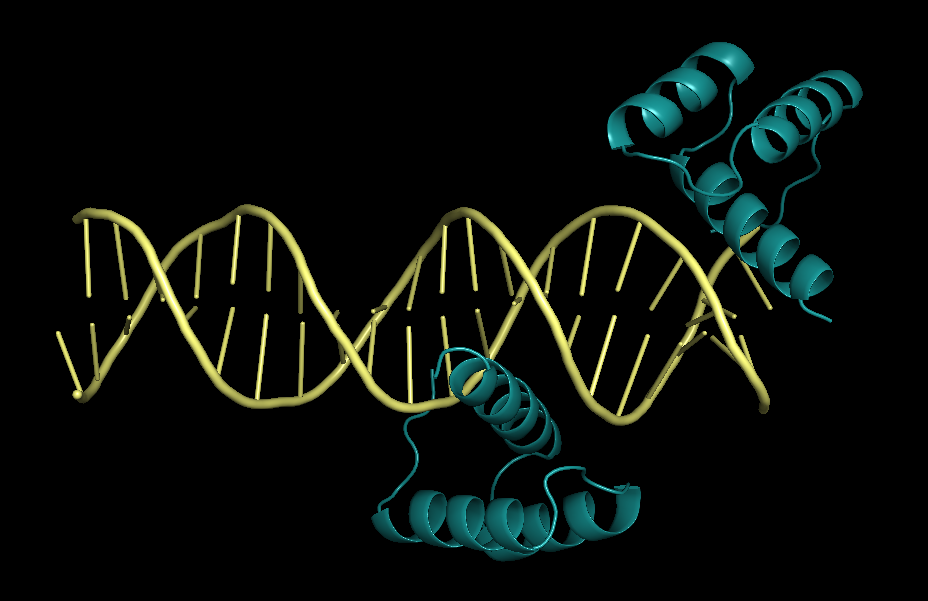 |
| Рисунок 9. Структура 3hdd |
Чтобы понять, в чем дело, была восстановлена ячейка, соседняя со странностью (Рис. 10).
При внимательном рассмотрении можно заметить, что концы ДНК в 3hdd являются липкими. На каждой из цепей есть одно неспаренное азотистое основание, которое может принимать участие вo взаимодействиях между соседними структурами (Рис. 11)
Молекула белка, зависающая на краю при рассмотрении только одного комплекса, на самом деле взаимодействует с ДНК сразу двух соседних структур.
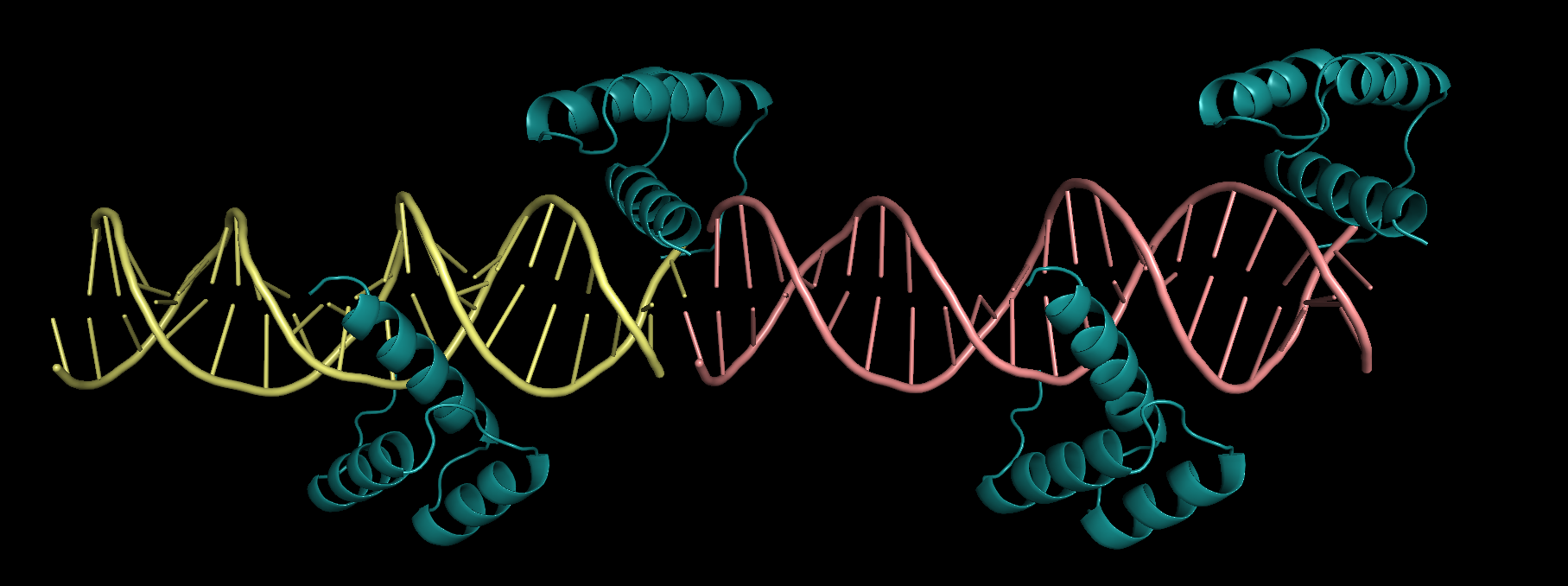 |
| Рисунок 10. 3hdd и соседняя со "странностью" ячейка |
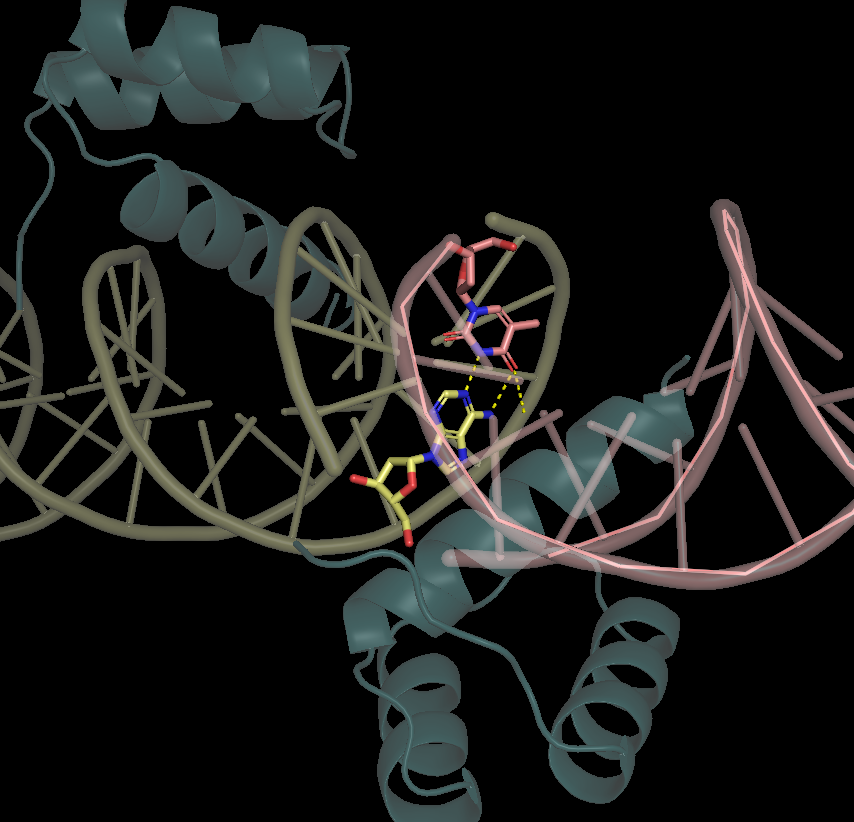 |
| Рисунок 11. Полярные взаимодействия между неспаренными нуклеотидами соседних структур |
Примеры PDB файлов, в которых асимметрическая единица не совпадает с биологической
Примером, когда асимметрическая единица меньше биологической, может послужить структура 6F04 - N-ацетилглюкозамин-2-эпимераза из Nostoc sp. Биологическая единица - гомодимер, а асимметрическая мономер (Рис. 12).
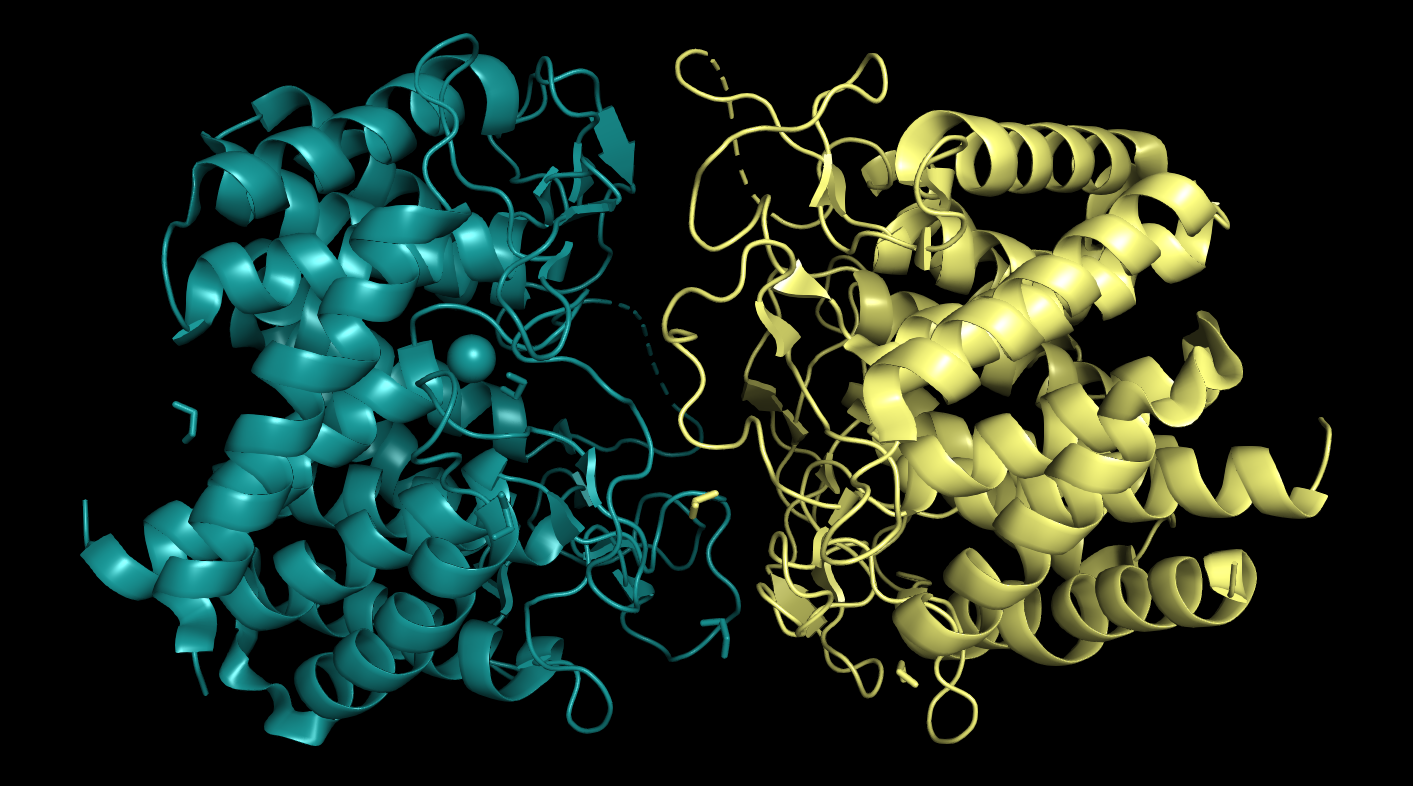 |
| Рисунок 12. Биологическая единица 6F04. Одна асимметрическая единица показана бирюзовым |
Случай, когда асимметрическая единица больше биологической - структура 5YLN - цинк-зависимая алкоголь дегилдрогеназа из Streptococcus pneumonia. Одна асимметрическая единица здесь представляет собой 4 молекулы, в то время как биологическая единица - гомодимер (Рис. 13)
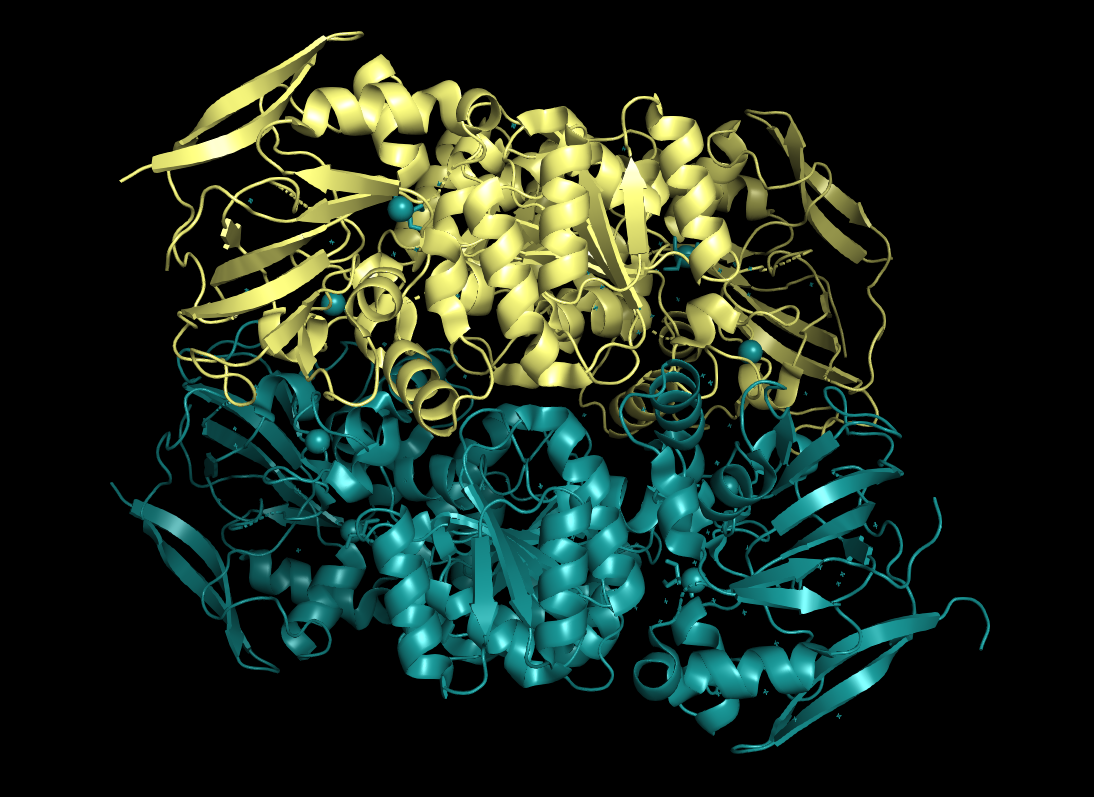 |
| Рисунок 13. Асимметрическая единица 5YLN. Одна биологическая единица показана бирюзовым |