Электронная плотность
Для работы был выбран белок Fis1 (PDB ID: 3o48).
из Saccharomyces cerevisiae.
Длина: 129 a.o.
Разрешение: 1,75 Å
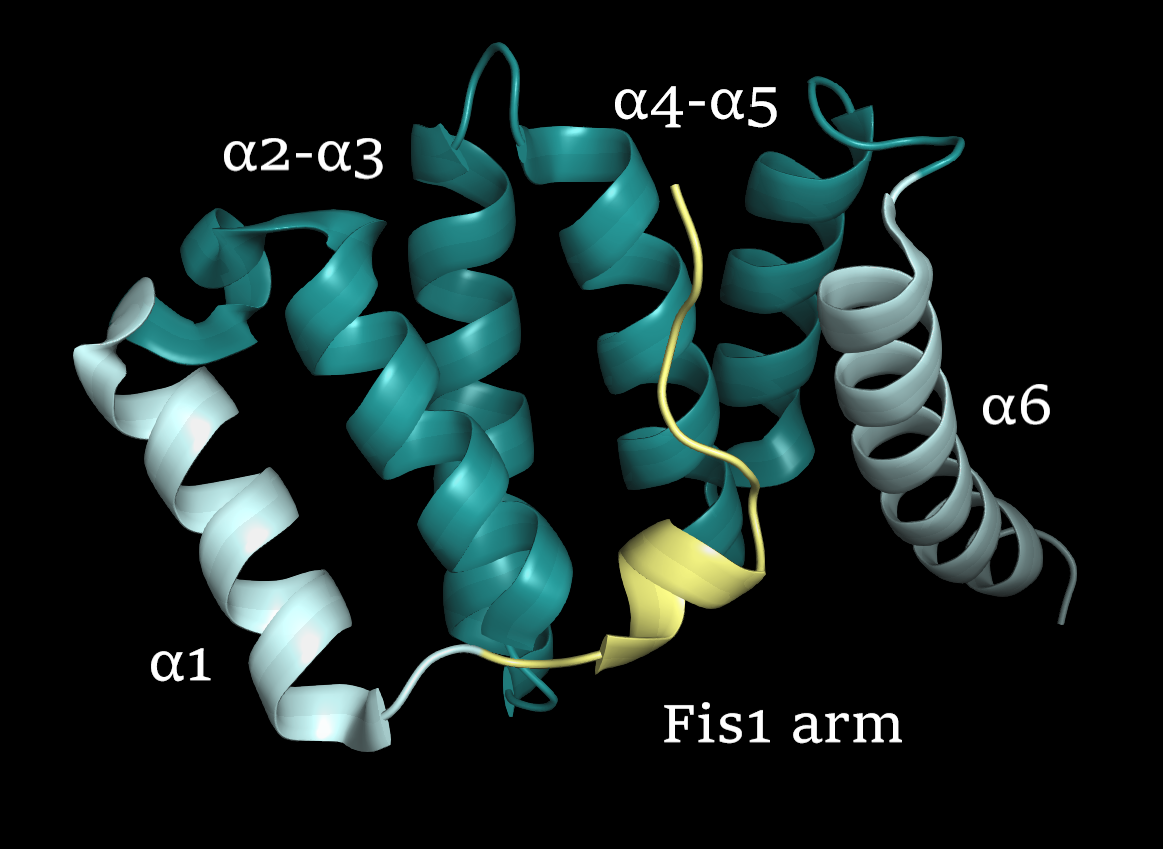 |
| Рисунок 1. Структура белка Fis1 |
Fis1 (Рис. 1) - белок, играющий одну из ключевых ролей в процессах дробления митохондрий и пероксисом. Он заякоривается в мембране митохондрии/пероксисомы своим C-концевым "хвостом"(α6), выставляя наружу цитоплазматический N-концевой домен с TRP-подобным фолдом из 2 пар антипараллельных альфа-спиралей (α2-α3, α4-α5). TRP-фолд образует впадину, выстланную консервативными аминокислотными остатками, и участвует в белок-белковых взаимодействиях. Помимо TRP-фолда, в N-концевой части имеется аутоингибиторное плечо (Fis1 arm), препятствующее доступу лигандов во впадину в отсутствие стимула.
Изображения электронной плотности вокруг остова полипептидной цепи Fis1 были получены с помощью программы для визуализации молекулярных данных PyMol. Использовалась команда isomesh с различными параметрами подрезки level (1-4 σ) и параметром carve=1.5, задающим максимальное расстояние от центров атомов, на котором изображается электронная плотность.
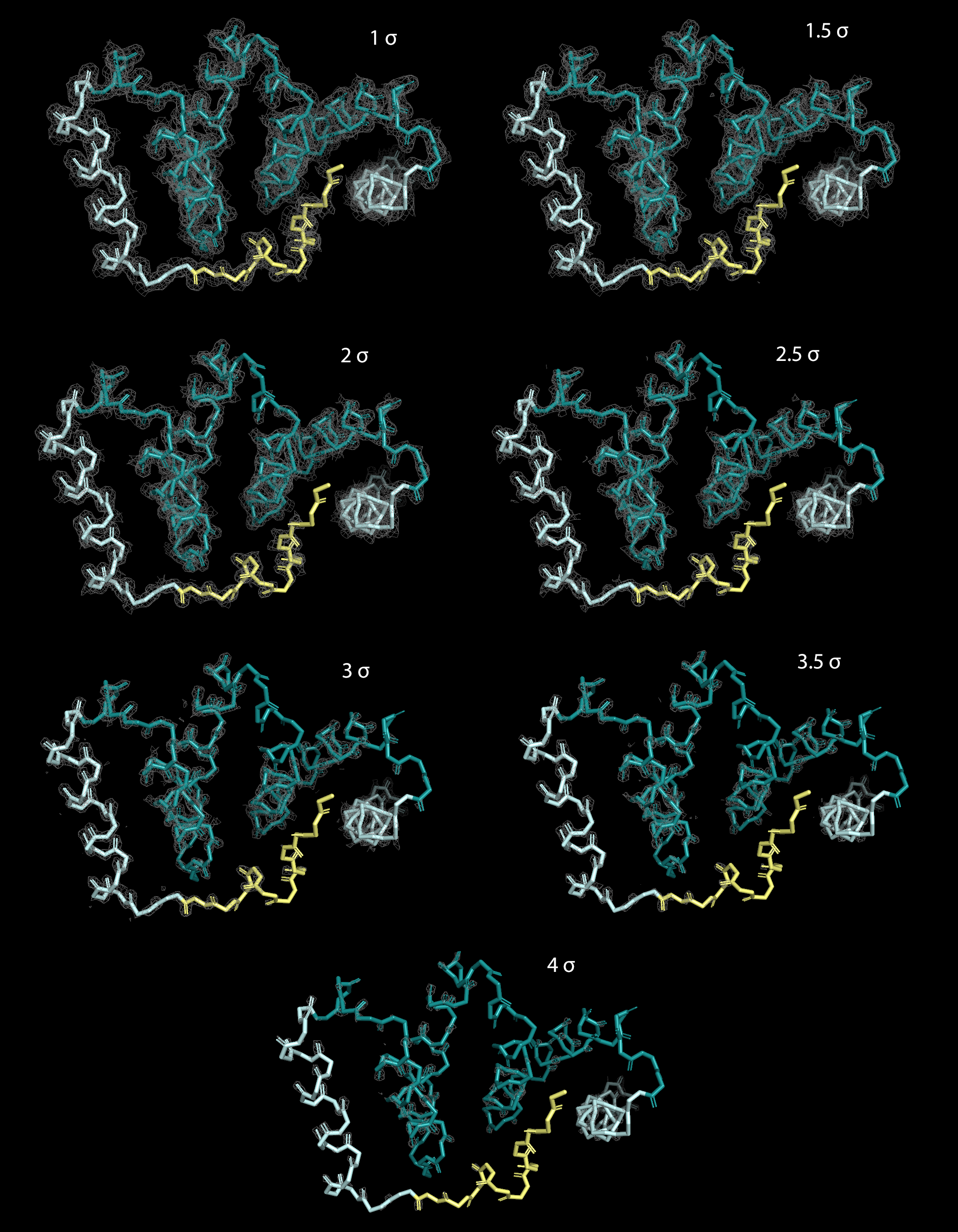 |
| Рисунок 2. Электронная плотность вокруг остова полипептидной цепи Fis1 на разных уровнях подрезки |
В целом, видно, что электронная плотность сконцентрирована вокруг остова полипептидной цепи модели и соответствует предполагаемому расположению атомов белка. Тем не менее при повышении уровня подрезки появляется все больше атомов, выходящих "за пределы" поверхности плотности. Это становится заметно уже на уровне 1.5 σ и далее идет по нарастающей. В первую очередь "обнажаются" атомы на N-конце цепи, соответствующие аутоингибиторному плечу белка. Возможно, это связано с высокой мобильностью, и, следовательно, более плохим качеством кристаллизации данного участка. Начиная с уровня подрезки 2 σ за пределы поверхности электронной плотности выходят неструктурированные петли, соединяющие антипараллельные альфа-спирали TRP-фолда. На уровне 3.5 σ плотность покрывает уже только отдельные атомы, преимущественно N и O (что, вероятно, связано с наличием у них большего числа электронов, чем у C,а также резонансом, возникающим между этими атомами при формировании пептидной связи).
Далее были построены изображения электронной плотности вокруг трех различных аминокислотных остатков, следующих друг за другом: Ala13, Tyr14 и Glu15 (Рисунок 3).
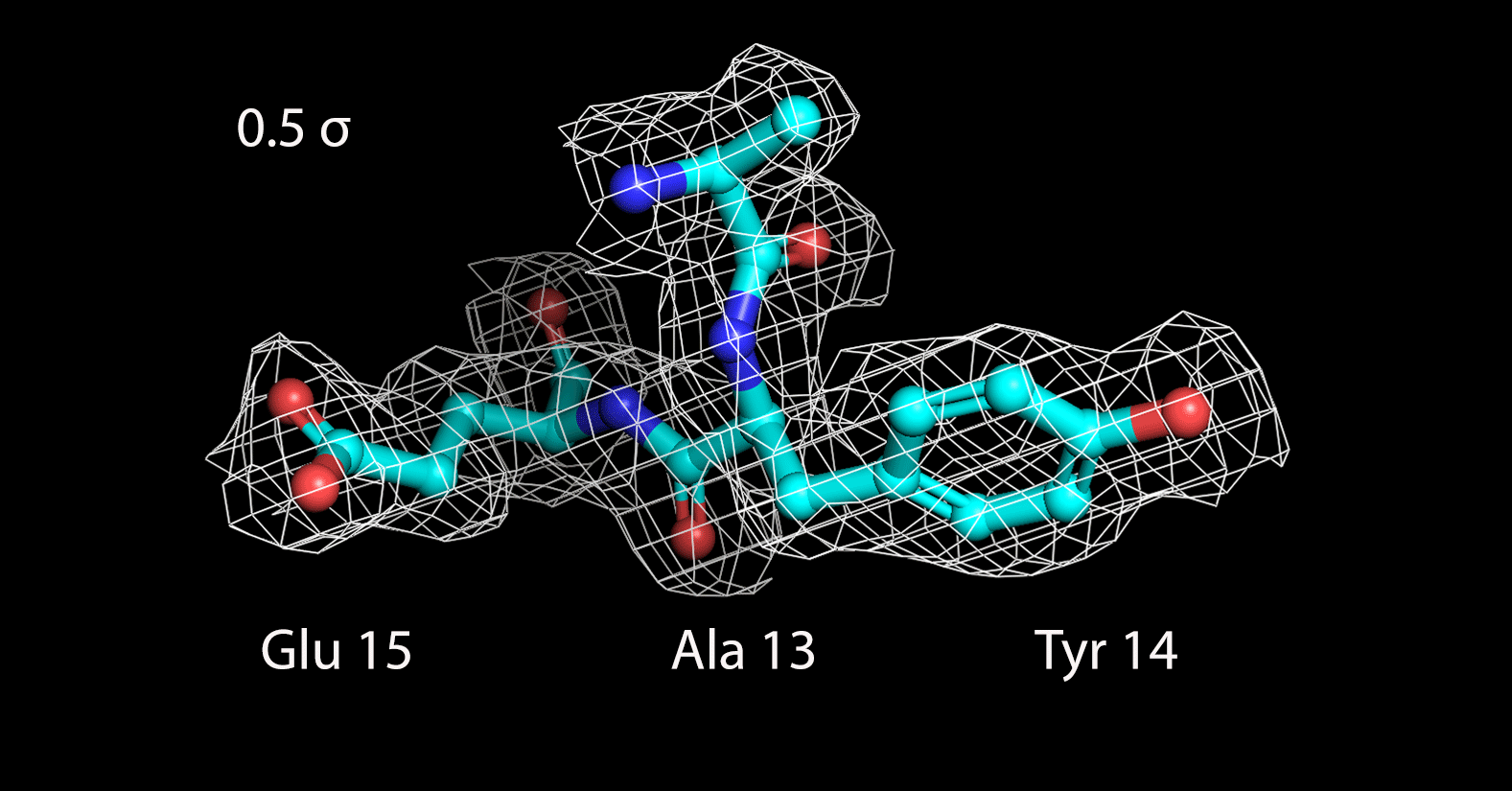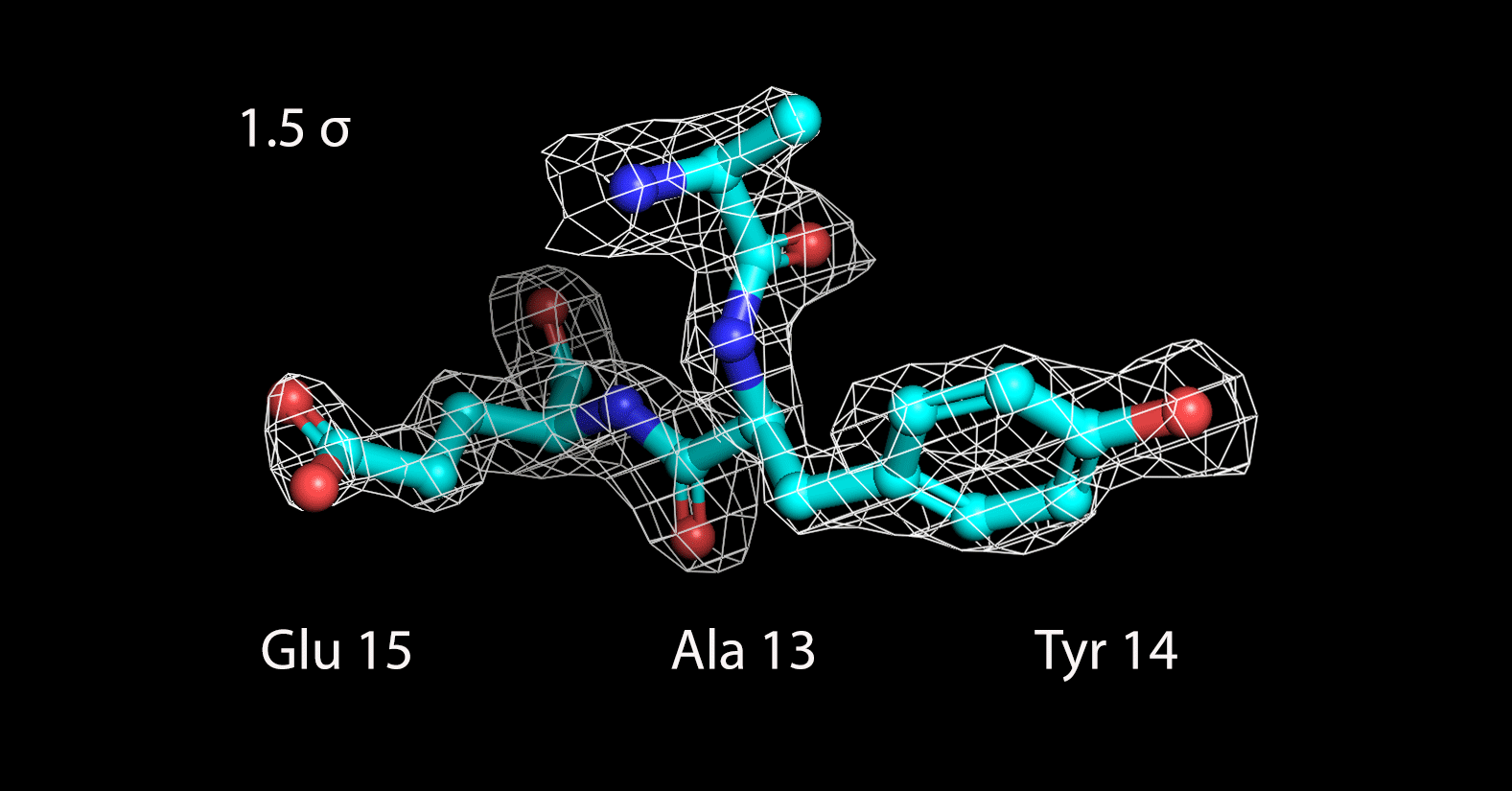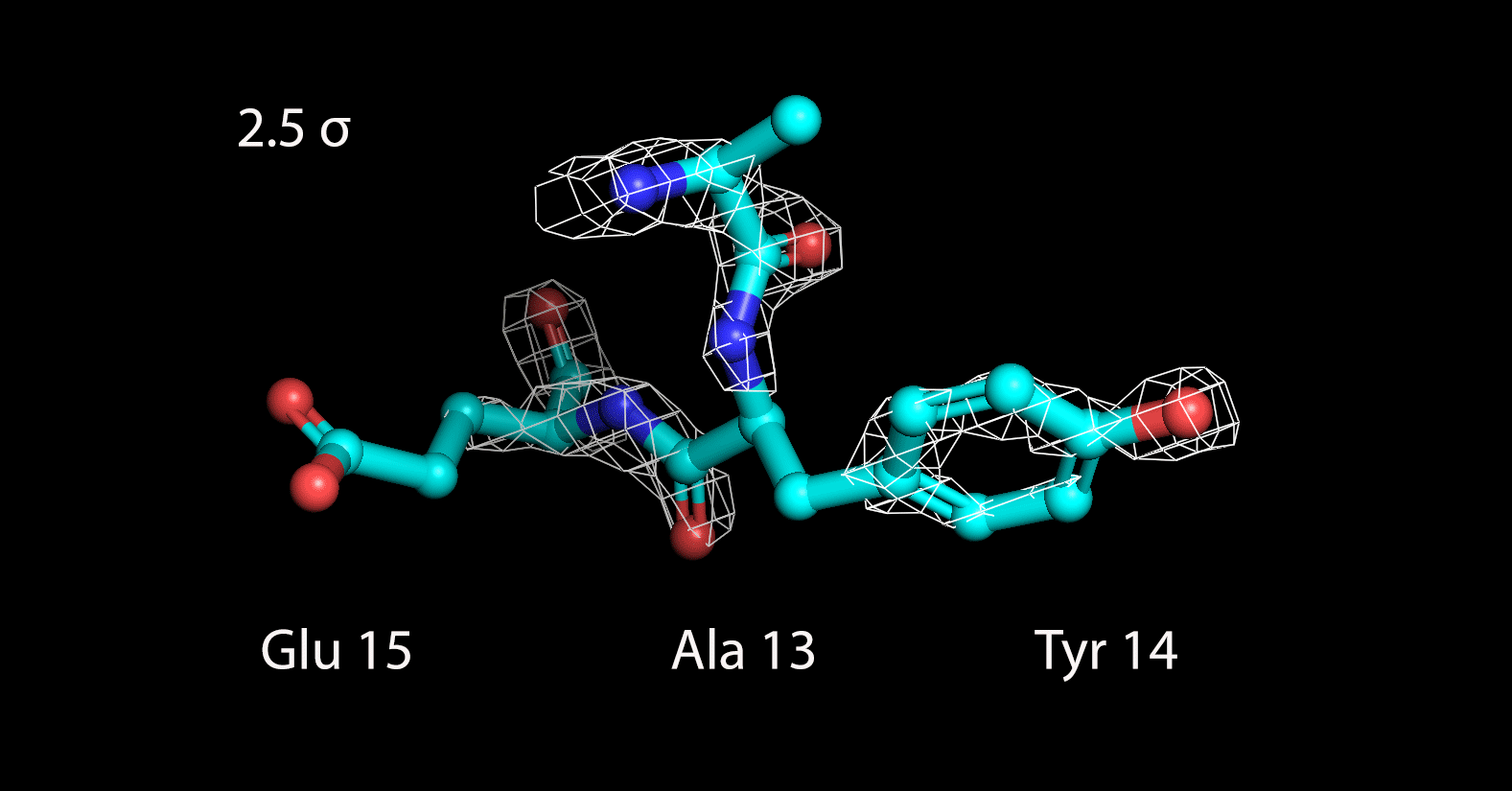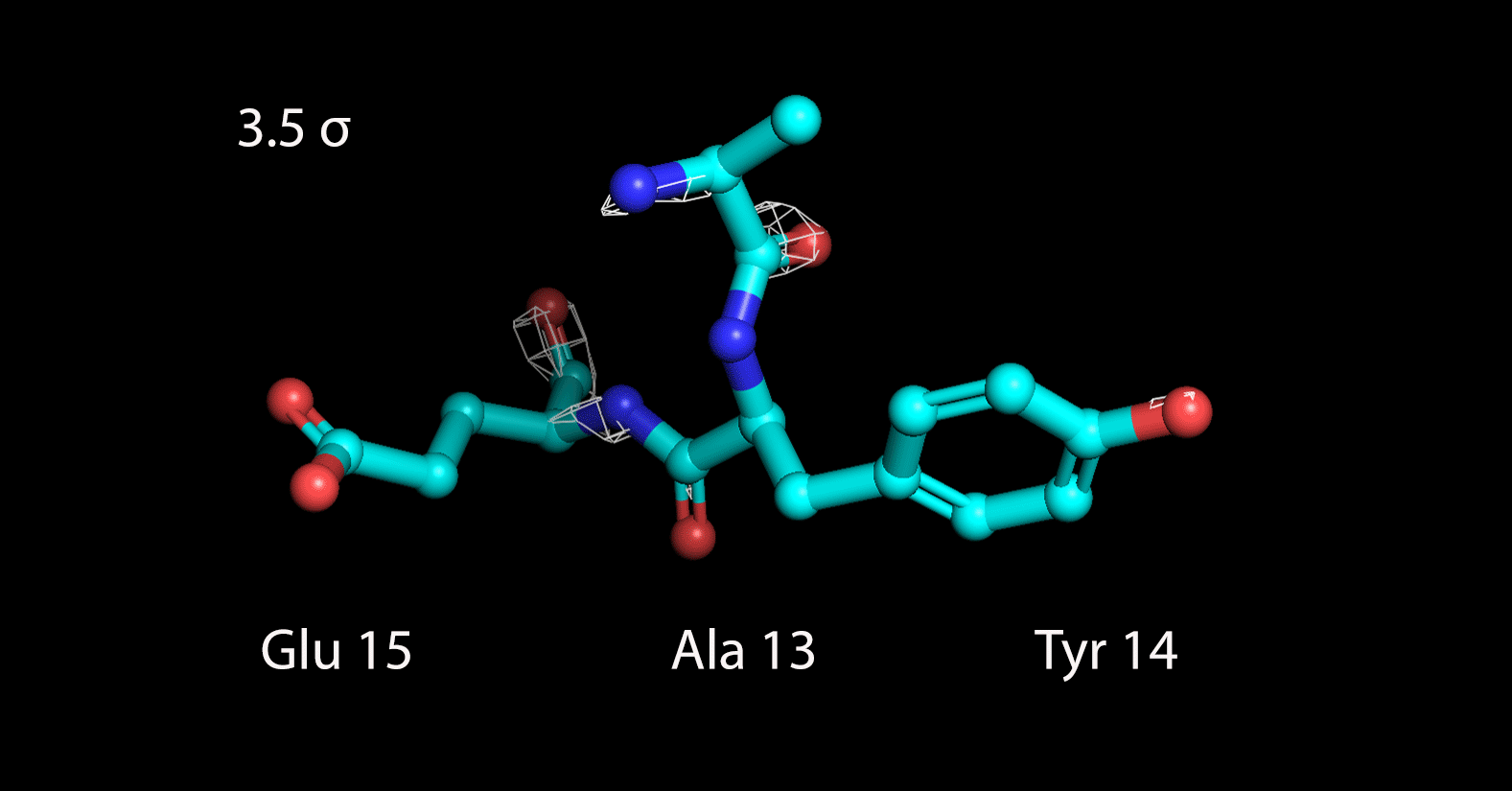 |
| Рисунок 3. Электронная плотность вокруг 3 а.о. на разных уровнях подрезки |
До уровня подрезки 1.5 σ поверхность электронной плотности полностью охватывает радикалы всех аминокислотных остатков. На уровне 2 σ она захватывает только ароматичекую систему тирозина, а атомы двух других радикалов уже остаются не покрытыми. С дальнейшим увеличением уровня подрезки электронная плотность концентрируется только вокруг атомов пептидной связи. Таким образом, можно заключить, что определение конкретных аминокислотных остатков затруднено по сравнению с определением общей структуры остова.