Анализ ЯМР файла
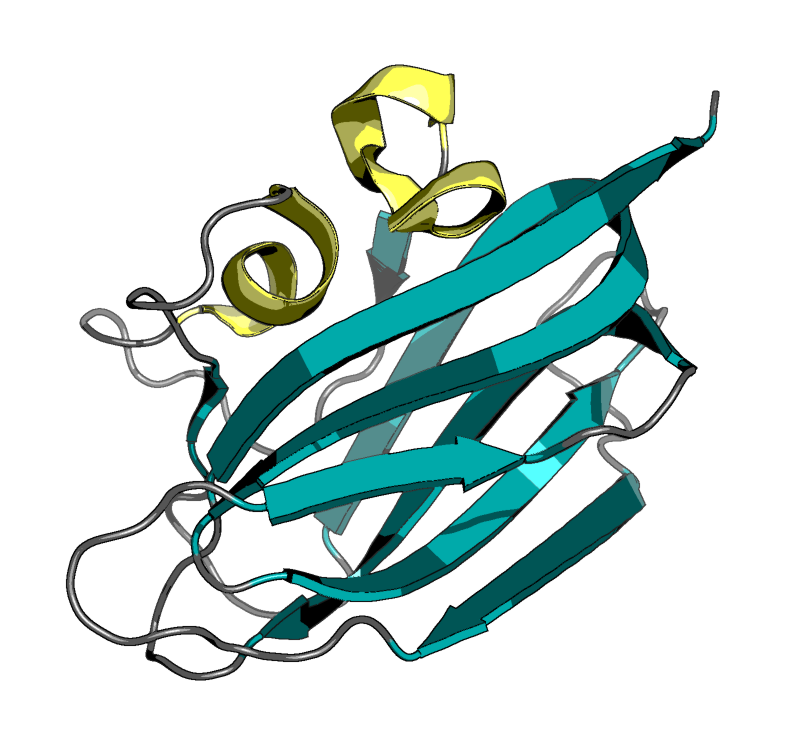 |
| Рисунок 1. Cтруктура 1tvg, полученная методом РСА |
 |
| Рисунок 2. Cтруктура 1xpw, полученная методом ЯМР, с изображением всех моделей |
Разрешение РСА-модели - 1.6 Å. Количество моделей ЯМР-структуры - 20. Все модели ЯМР демонстрируют хорошее наложение.
Укладки структур ЯМР и РСА сходны вплоть до положения петель, что говорит об отсутствии глобальных ошибок расшифровки
Для сравнения структур были выбраны аминокислотные остатки, между которыми образуются связи трех типов:
- водородная связь между остовными атомами в ядре белка
- водородная связь между боковыми цепями в ядре белка
- водородная связь в петле, выходящей на поверхность глобулы
Связи между остовными атомами в ядре белка рассматривались на примере остатков Gln65 и Ser131, входящих в состав бета-слоя (Рис. 3). Между их атомами O и C остова формируются две водородные связи с длинами 2.8 Å и 3.1 Å.
Найти в ядре белка связи между боковыми радикалами аминокислот оказалось сложнее. Фактически, обнаружить их удалось только на границе бета-слоя (Рис. 4). Были выбраны остатки Gln101 и Ser66, взаимодействующие как боковыми цепями (водородная связь Ser66-O - Gln101-N длиной 2.8 Å), так и через остовные атомы N и O (две водородные связи по 2.7 и 3.0 Å).
Наконец, были рассмотрены связи в петле, экспонированной на поверхность белковой глобулы. Для этого подошли остатки Asp22, Lys24 и His25 (Рис. 5). Остовные атомы N лизина и гистидина образуют водородные связи в 3.2 и 3.1 Å соответственно с атомом O бокового радикала аспартата. Остовный атом O Asp22, в свою очередь, взаимодействует с остовным N His25 (2.9 Å).
Вышеперечисленные взаимодействия были затем проанализированы в ЯМР-структуре 1xpw. Сравнительный анализ приведен в таблице 1.
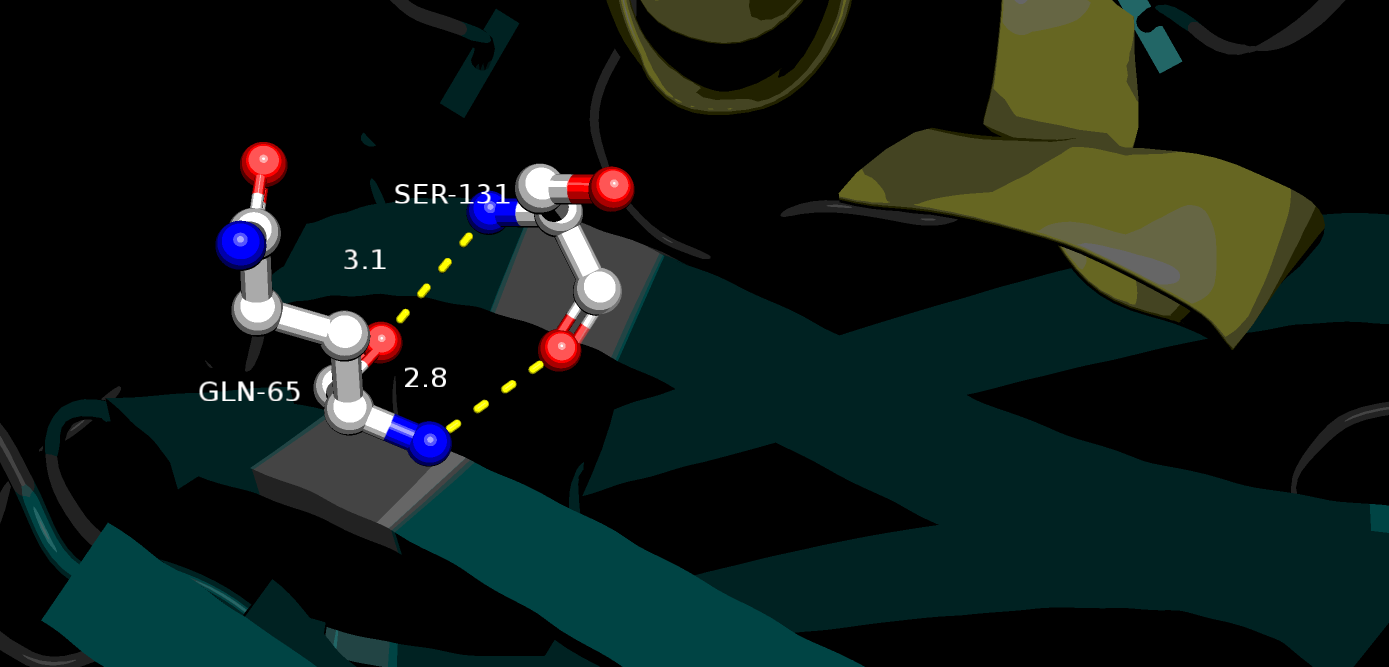 |
| Рисунок 3. Водородные связи между остовными атомами Gln65 и Ser131 в ядре белка, структура 1tvg |
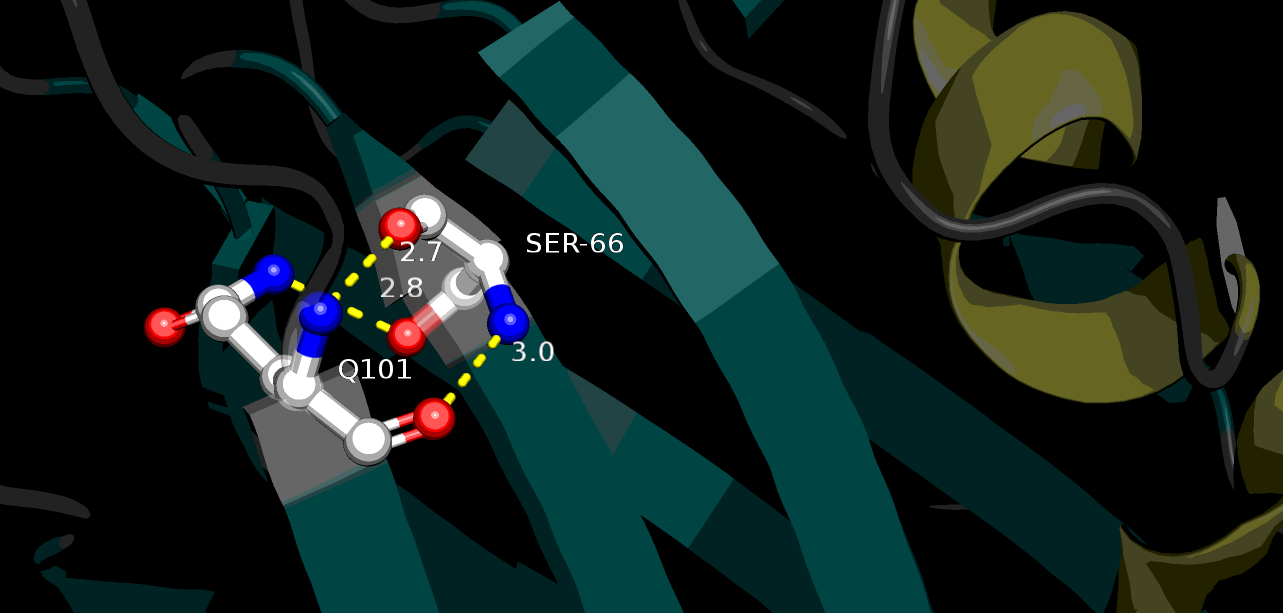 |
| Рисунок 4. Водородные связи между атомами остова и боковых цепей Gln101 и Ser66 в ядре белка, структура 1tvg |
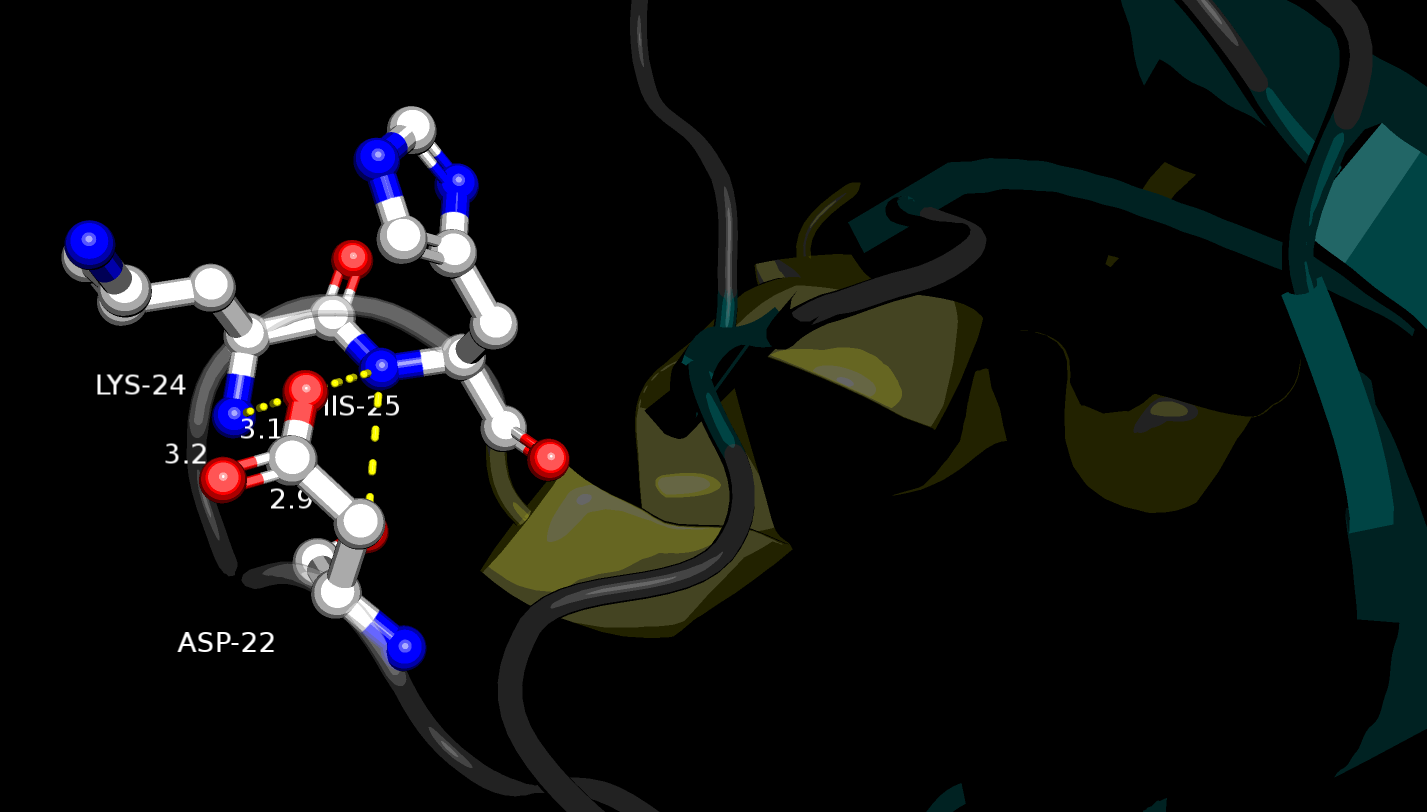 |
| Рисунок 5. Водородные связи между атомами остова и боковых цепей Asp22, Lys24 и His25 в петле, структура 1tvg |
| Взаимодействие | 1tvg (РСА) | 1xpw (ЯМР) | |||
|---|---|---|---|---|---|
| d (Å) | % | d_min (Å) | d_max (Å) | d_mean (Å) | |
| Gln65-O и Ser131-N | 3.1 | 80 | 2.1 | 2.6 | 2.213 |
| Gln65-N и Ser131-O | 2.8 | 100 | 1.8 | 2.2 | 1.955 |
| Ser66-N и Gln101-O | 3.0 | 20 | 2.1 | 2.5 | 2.25 |
| Ser66-O и Gln101-N | 2.7 | 10 | 2.0 | 2.6 | 2.3 |
| Ser66-OG и Gln101-NE2 | 2.8 | 0 | - | - | - |
| Asp22-O и His25-N | 2.9 | 5 | 2.4 | 2.4 | 2.4 |
| Asp22-OD2 и Lys24-N | 3.2 | 45 | 1.8 | 2.6 | 2.067 |
| Asp22-OD2 и His25-N | 3.1 | 55 | 1.7 | 2.7 | 2.336 |
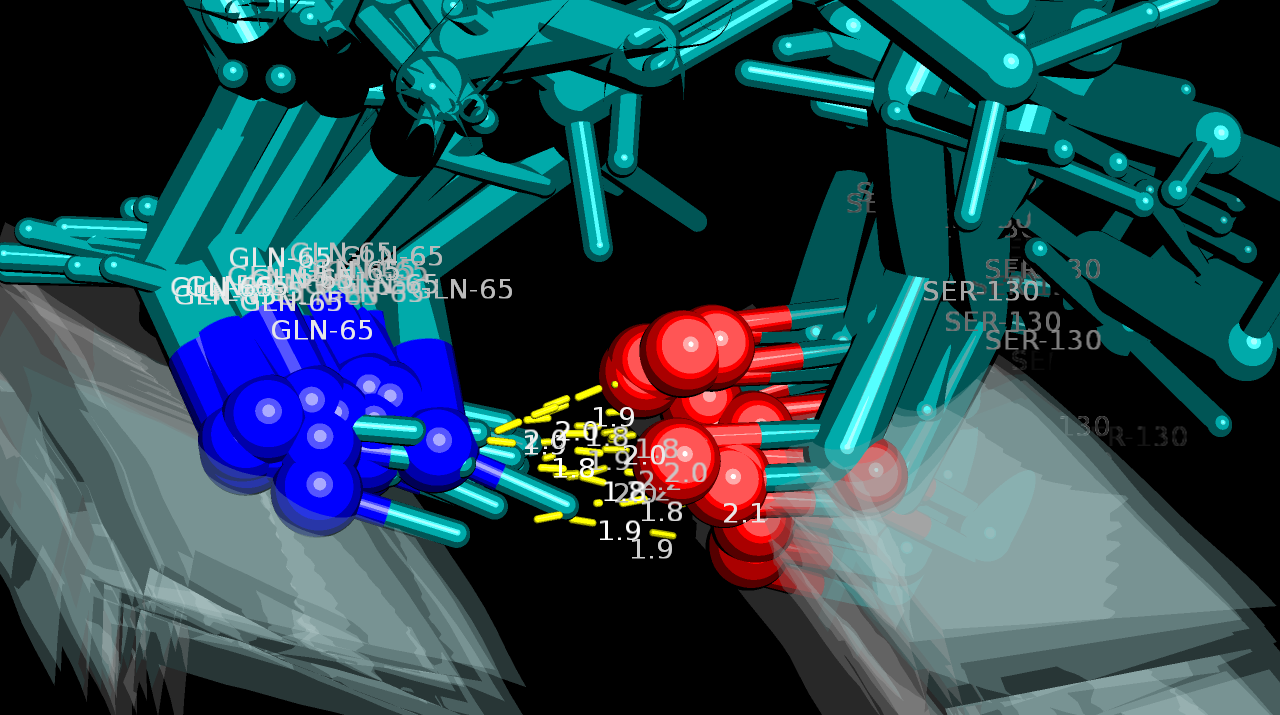 |
| Рисунок 6. Контакт Gln65-N и Ser130-O, присутствующий во всех 20 моделях структуры 1xpw |
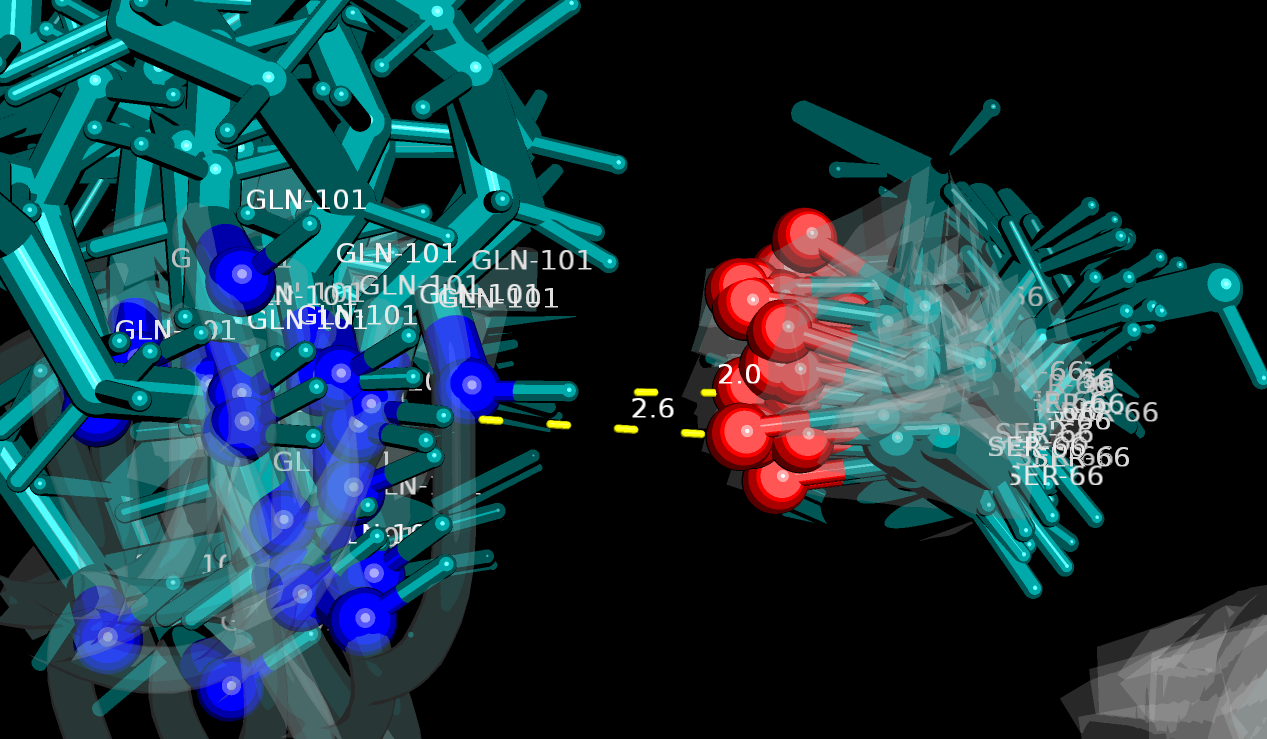 |
| Рисунок 7. Контакт Gln101-N и Ser66-O, присутствующий в 2 из 20 моделей структуры 1xpw |
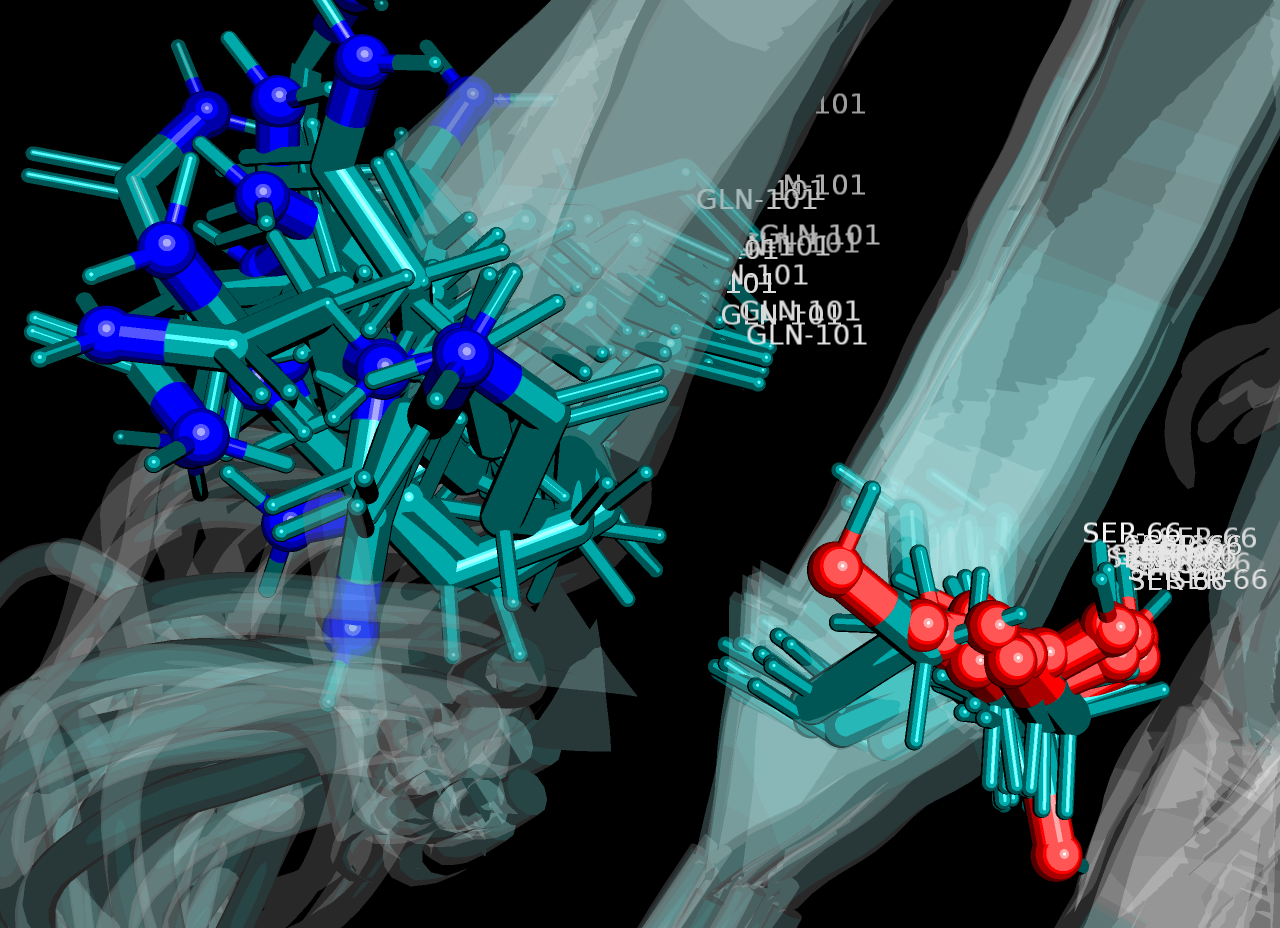 |
| Рисунок 8. Контакт Ser66-OG и Gln101-NE2, не найденный ни в одной модели структуры 1xpw |
Выбранные контакты были рассмотрены в каждой из 20 моделей ЯМР-структуры. В таблице приведен процент моделей, в которых данная связь встретилась в принципе (%), а также минимальная, максимальная и средняя длины данной связи среди моделей. Для отдельных контактов приведены изображения водородных связей с отображением всех ЯМР-моделей, однако в связи с низкой наглядностью подобных рисунков, в отчете они предтавлены не для всех пар атомов.
На рисунке 6 изображена водородная связь между остовными Gln65-N и Ser130-O в ядре белка, которая присутствует во всех 20 моделях. На рисунке 7 - аналогичная связь между Ser66-N и Gln101-O, но найденная только в 2 моделях из 20. На рисунке 8 - "связь" между радикальными Ser66-OG и Gln101-NE2 в ядре, имеющаяся в РСА-, но не найденная в ЯМР-структуре.
Необходимо отметить, что при рассмотрении первой группы контактов обнаружилось несовпадение остатков в РСА и ЯМР-структурах. В 1xpw в 131-ом положении стоял не серин, а валин. Соответственно, контактов между 65-м и 131-м остатками не было. Тем не менее, в 1xpw был Ser130, образующий с Gln65 аналогичный наблюдаемому в 1tvg контакт. Было принято решение условно принять его за искомый.
Из таблицы 1 видно, что достаточно много контактов, присутствующих в РСА, не находятся в ЯМР-модели. Возможно, это связано с особенностями проведения эксперимента. В РСА белок кристаллизован, и положение отдельных остатков может быть более или менее зафиксировано, например в состоянии их сближения на расстояние водородных связей. В ЯМР изучаемый белок находится в растворе, остатки в целом более мобильны, поэтому такие положения остатков, при которых между ними возможна водородная связь, встречаются не во всех моделях.
Стоит, однако, отметить, что связи между остовными атомами в ядре белка наиболее воспроизводимы, и с большей частотой встречаются в обеих структурах. По-видимому, это объясняется тем, что они, во-первых, несут явную функциональную значимость, а во-вторых - находятся в наименее мобильных регионах белка и образованы между относительно жестко расположенными остовными атомами.
Для связей между боковыми радикалами аминокислот внутри белковой глобулы такой тенденции не наблюдается, по крайней мере для рассмотренных взаимодействий. Возможно, подвижность боковых цепей даже внутри ядра уже достаточно высока, а возможно причина кроется в выбранных мною остатках. Как было сказано ранее, контактов боковых цепей в самом центре α-спирали или β-слоя мне найти не удалось, и пришлось взять остатки, расположенные почти на самой границе β-слоя и петли.
Воспроизводимость контактов в петлях не превысила 55%, что, впрочем, ожидаемо, ввиду их экспонированности в раствор и высокой динамичности поверхностных остатков.
Также заметно, что длины водородных связей в ЯМР моделях всегда оказывались меньше, чем в РСА. Причина этого явления мне не совсем понятна. Возможно, это просто случайность, так как выборка не велика.
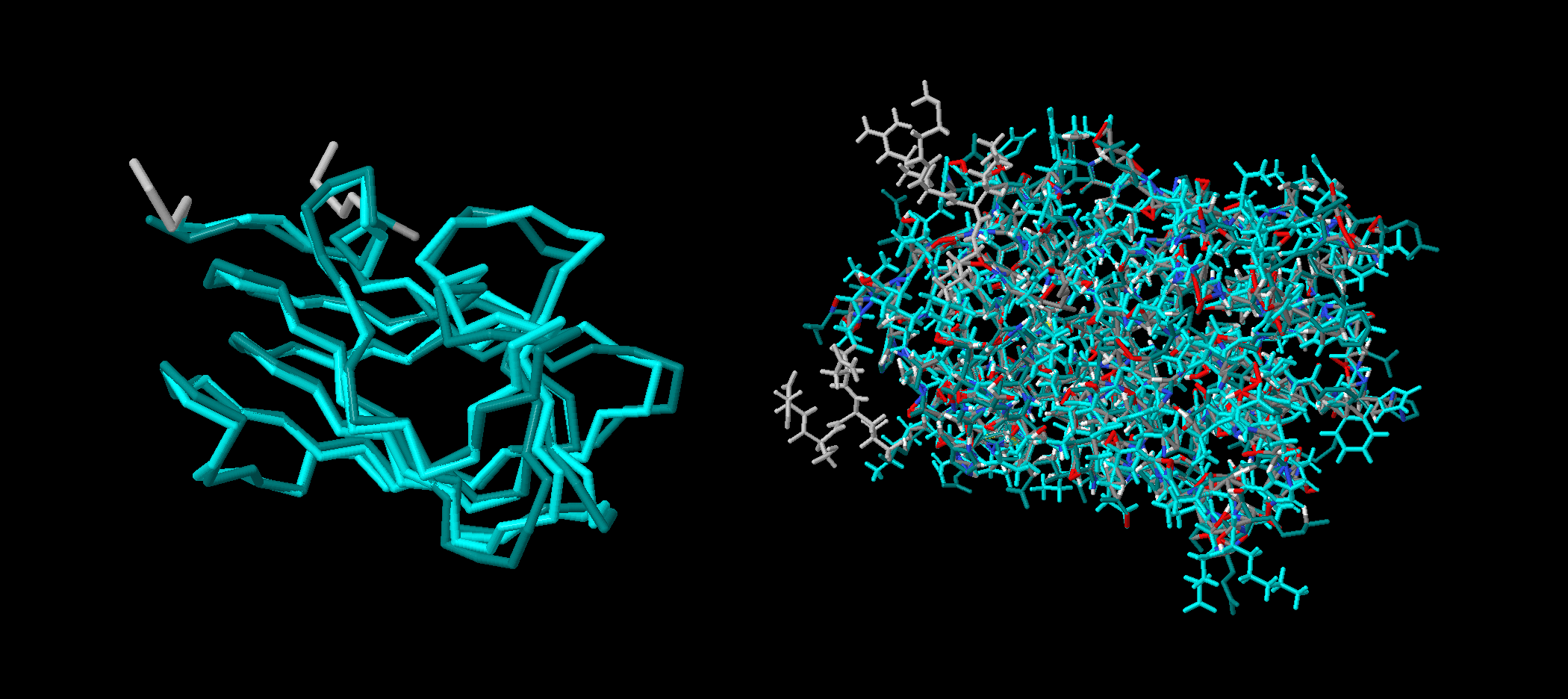 |
| Рисунок 9. Наложение структур 1tvg (темная цепь) и 1xpw (светлая цепь), полученноe с помощью сервиса PDBeFold; слева - изображение остовов, справа - остовов и боковых цепей |