Задание №1: Альтернативные положения
Для анализа были выбрана структура человеческой РНКазы VI c PDB 6ENP, а также два аминокислотных остатка с альтернативными положениями: LYS7, HIS122.

Рисунок 1: Расположение LYS7 и HIS122 в конформациях B и B

Рисунок 2: Расположение LYS7 и HIS122 в конформациях B и A
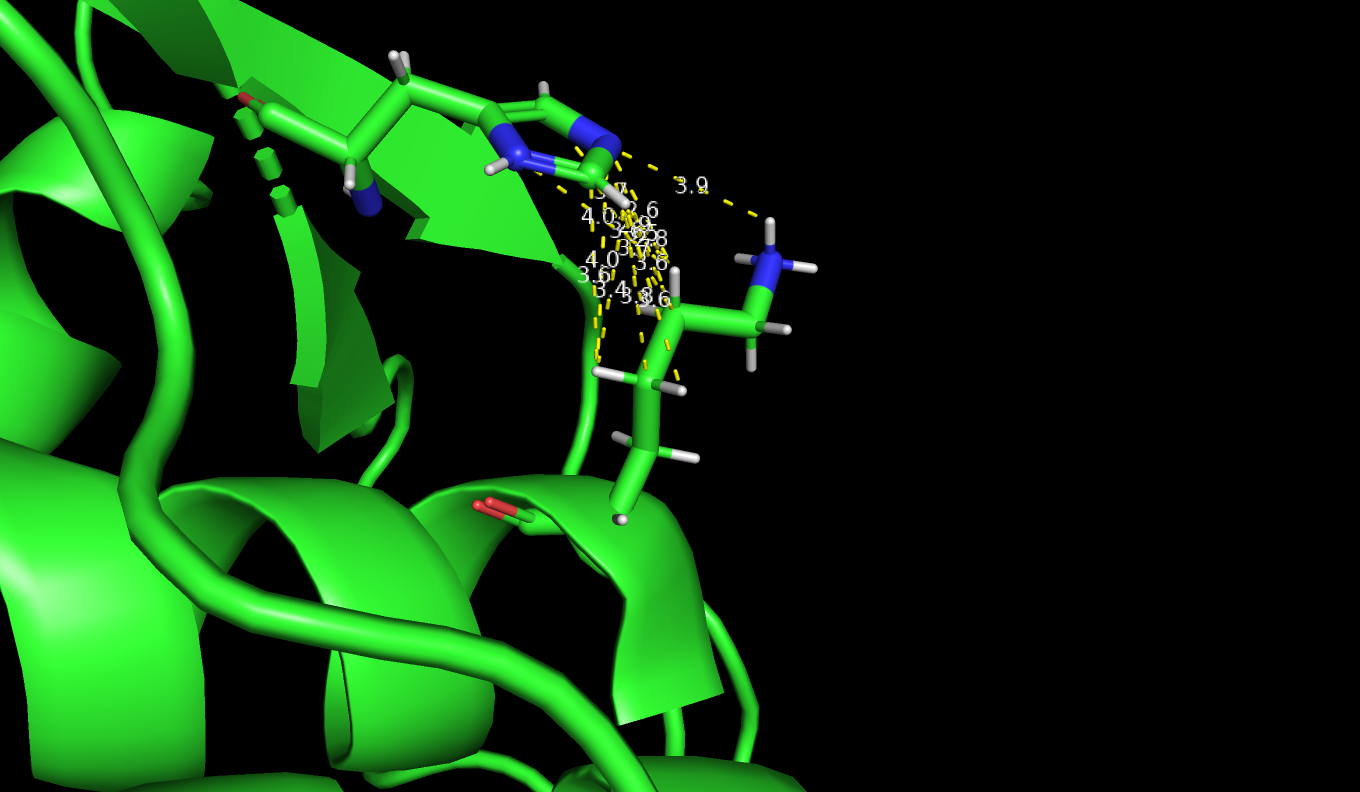
Рисунок 3: Расположение LYS7 и HIS122 в конформациях A и B
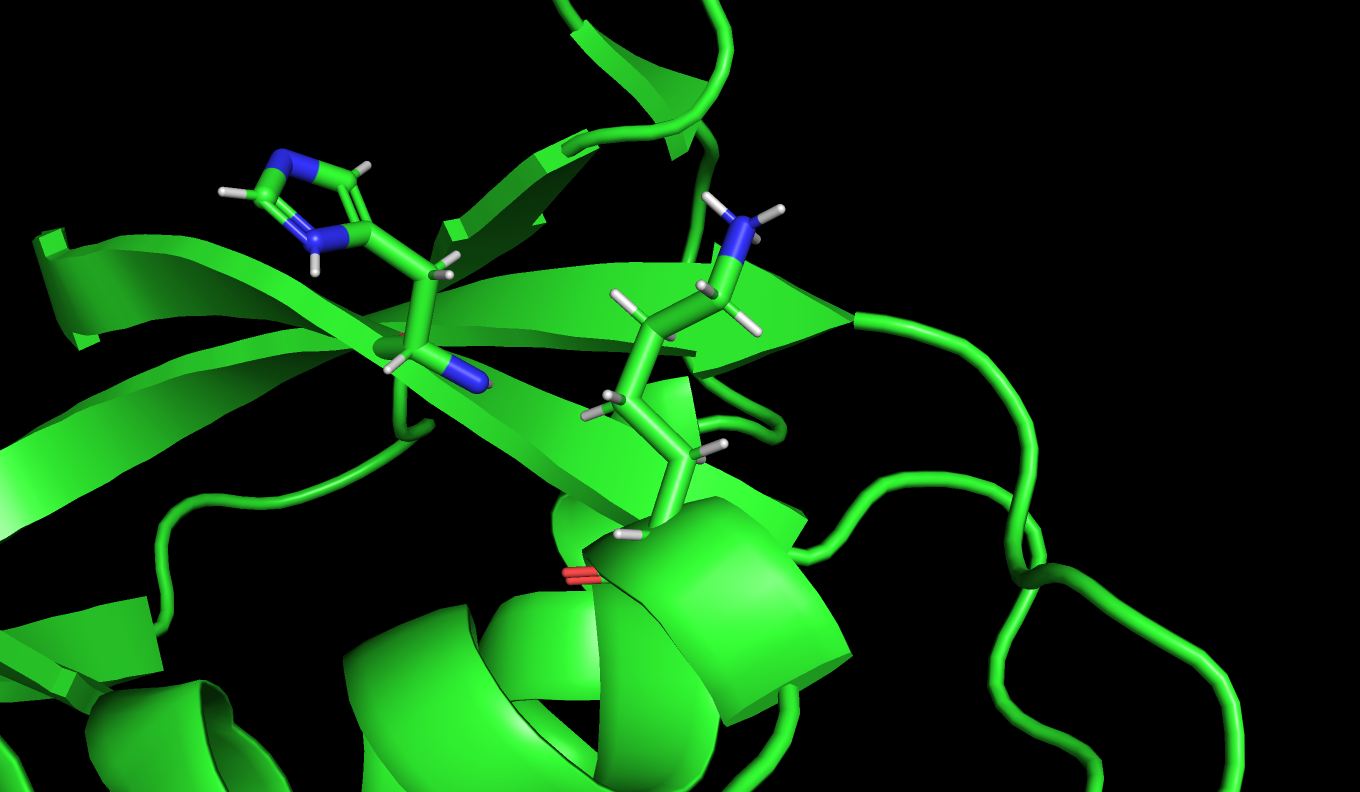
Рисунок 4: Расположение LYS7 и HIS122 в конформациях A и A
Невозможно сочетание конформаций LYS A и HIS A(Рис.4), а также конформаций LYS B и HIS A(Рис.2),так как остатки находятся довольно далеко друг от друга. Самый стабильной мне кажется сочетание конформаций LYS B и HIS B (Рис.1). По данным PDB файла населенность альтернативных полодений: LYS_A - 0.46, LYS_B - 0.54, HIS_A - 0.56, HIS_B - 0.44. Эти данные частично совпадает с моими предположенями.
Ссылка на сессии Pymol B_B, B_A, A_B и A_A.
Задание №2: B-фактор
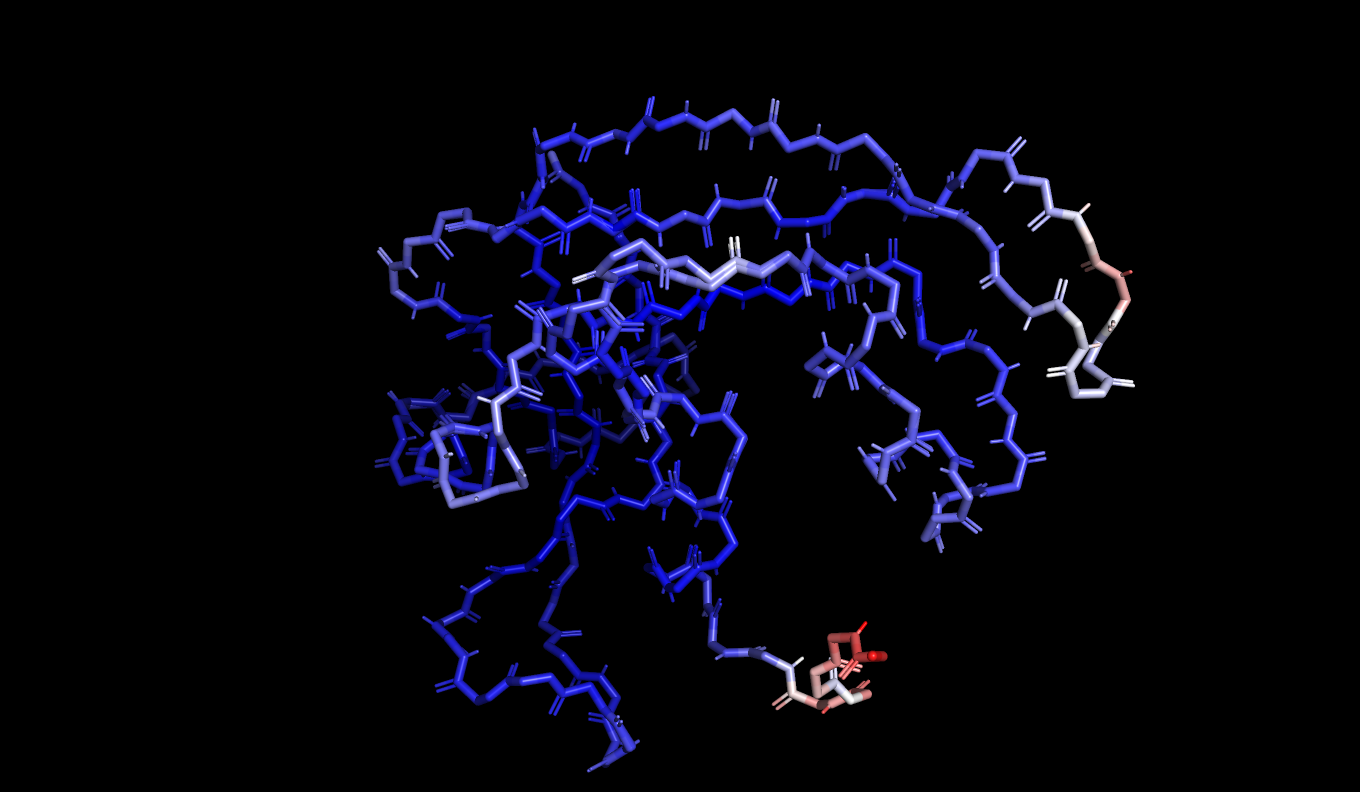
Рисунок 5: Остов белка, покрашенный по B-фактору
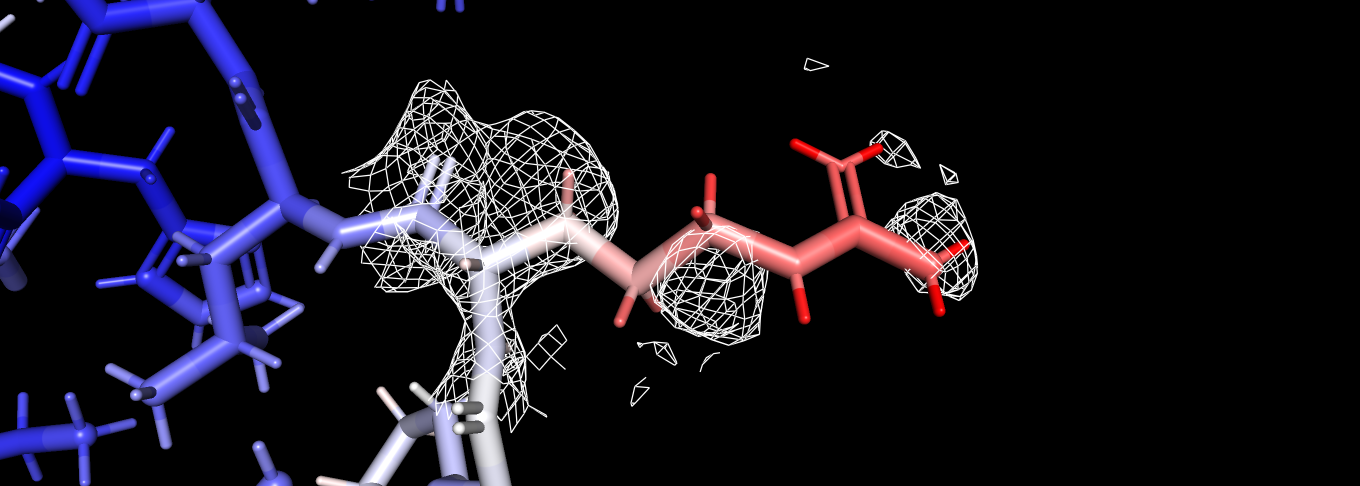
Рисунок 6: Уровень подрезки 0.5, carve=1.5

Рисунок 7: Уровень подрезки 1.5, carve=1.5

Рисунок 8:Уровень подрезки 2.5, carve=1.5
Задание №3: Соседи
Рисунок 9: Кристаллическая структура белка с идентификатором PDB 6ENP
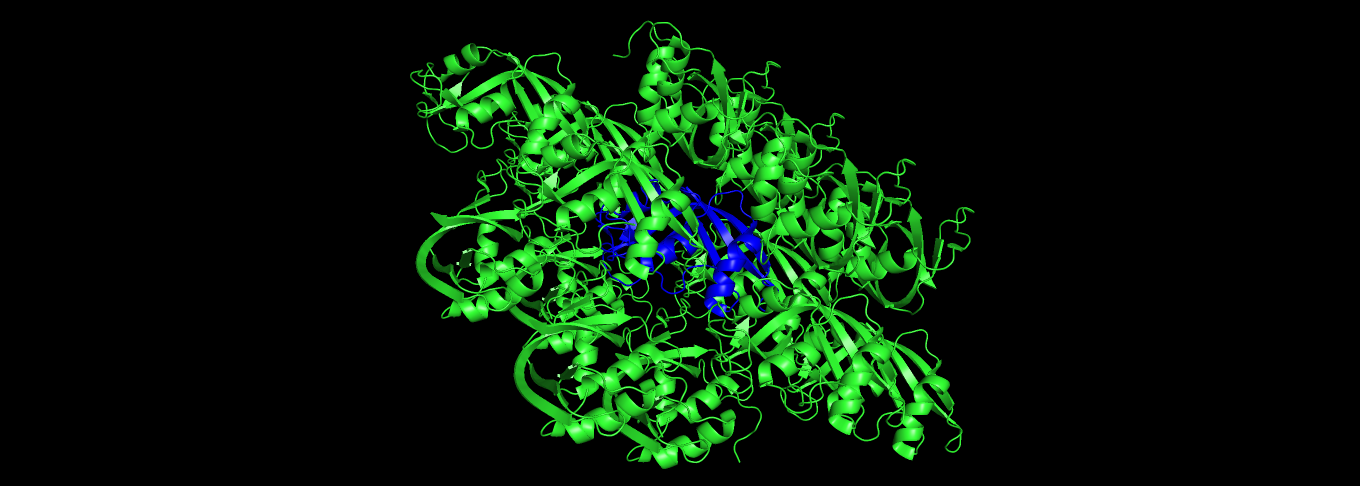
Рисунок 10: Соседи элементарной ячейки (изначальная обозначена синим)