Задание B12: Helices
Для выполнения задание были даны три последовательности длинной 118 аминокислот(seqA, seqB, seqC). Для определения различий между последовательностями было проведено выравнивание(рис.1). Можно заметить, что seqB отличается от seqA заменой 98 - 100 а.о. на пролин. Последовательность seqC отличается от seqA заменой 90-102 а.о. на пролин.

Рисунок 1: Выравнивание исходных аминокислотных последовательностей
Для предсказания структур был использован AlphaFold2. Для визуализации полученных структур был использован Pymol. Ссылка на сессии Pymol
В задании сравнивались предсказание стукур по последовательностям seqA, seqB, seqC.
Сначала сравнили seqA и seqB. Можно заметить, что в стуктуре seqB частично разрушена альфа-спираль на С-конце(рис.3) по сравнению с seqА(рис.2), а также по графику(рис.7) можно заметить, что значение model confidence на участке в районе 100 не значительно, но снизилось.
Затем сравнивались предсказания по последовательностям seqA и seqC. Можно заметить, что в стуктуре seq полностью разрушена альфа-спираль на С-конце(рис.4), а также по графику(рис.8) можно заметить, что значение model confidence на участке в районе 90-100 значительно снизилось.
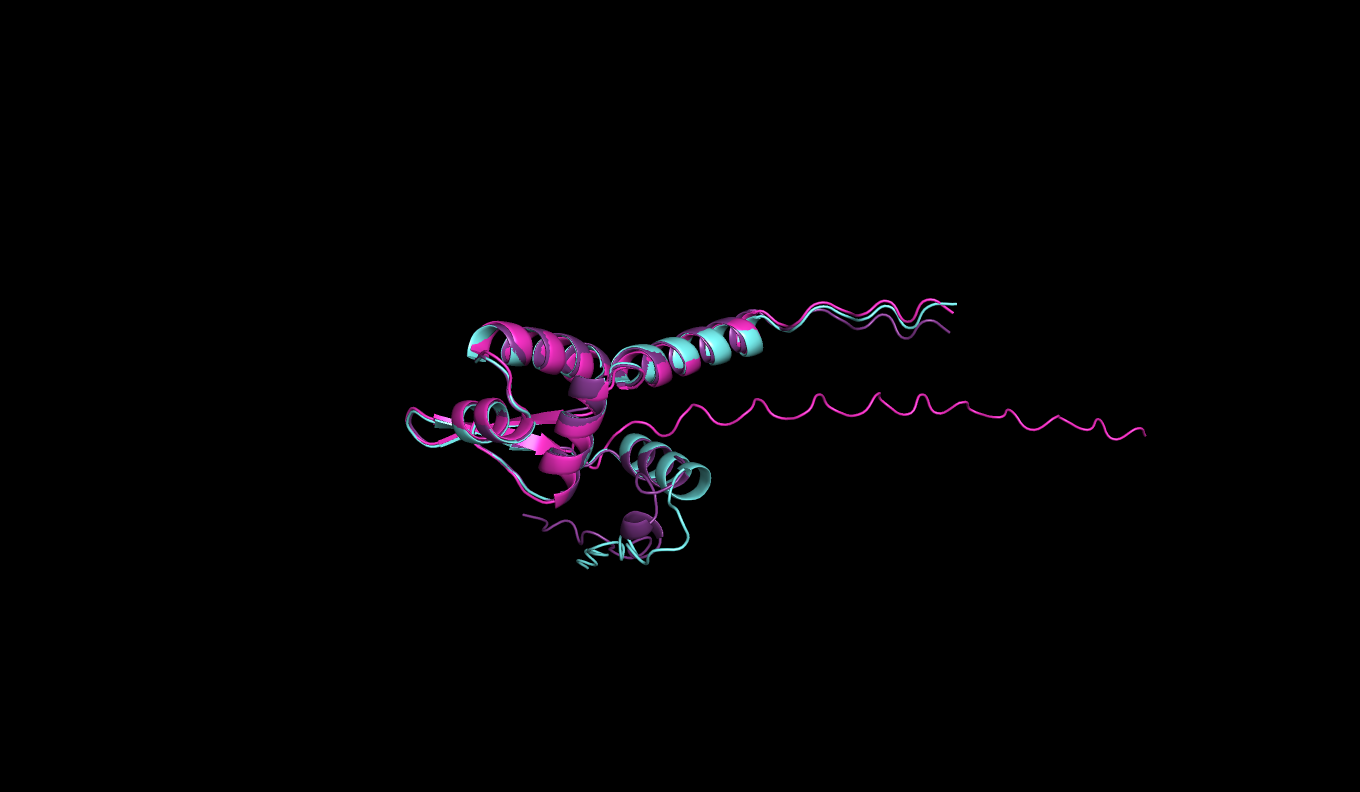
Рисунок 2: Выравнивание seqA (бирюзовый), seqB (фиолетовый) и seqC (розовый)

Рисунок 3: SeqA
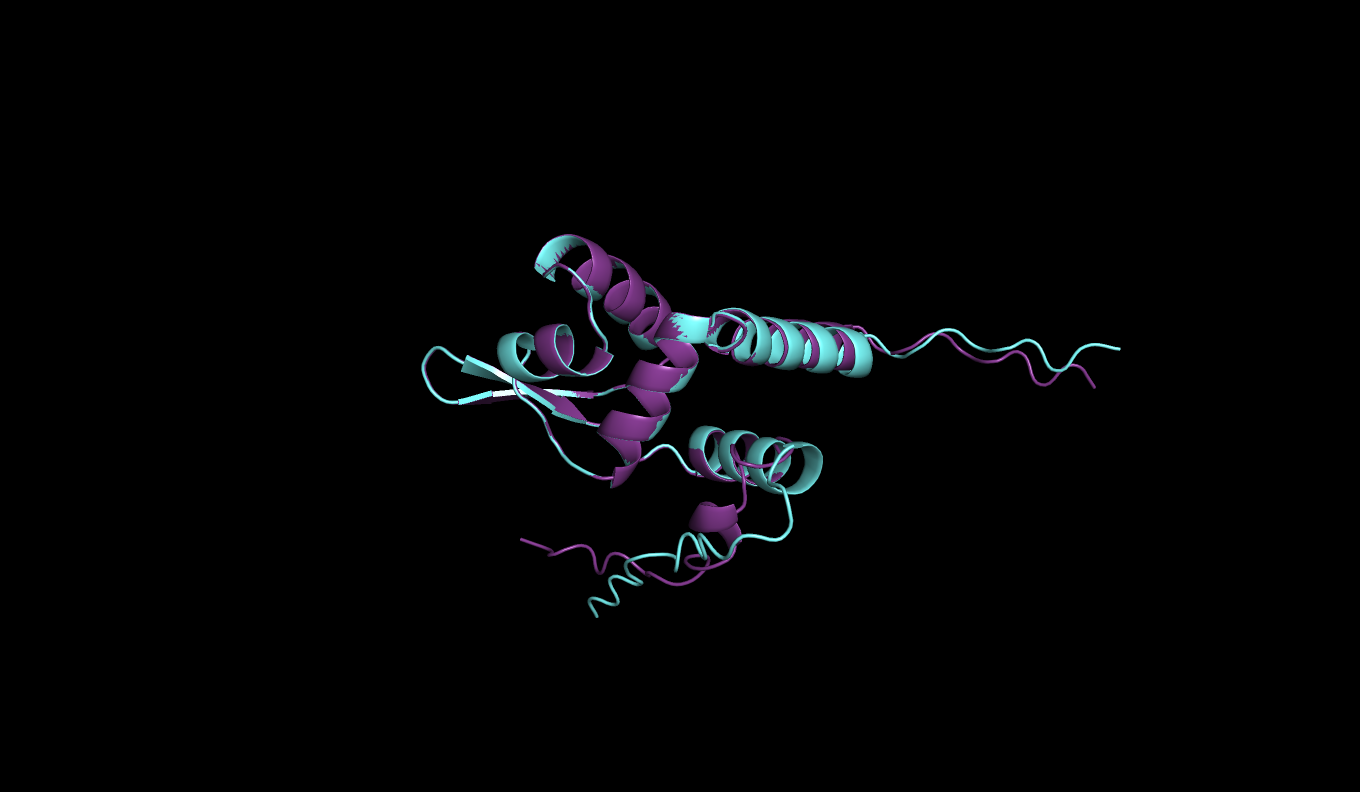
Рисунок 4: Выравнивание seqA (бирюзовый) и seqB (фиолетовый) последовательностей
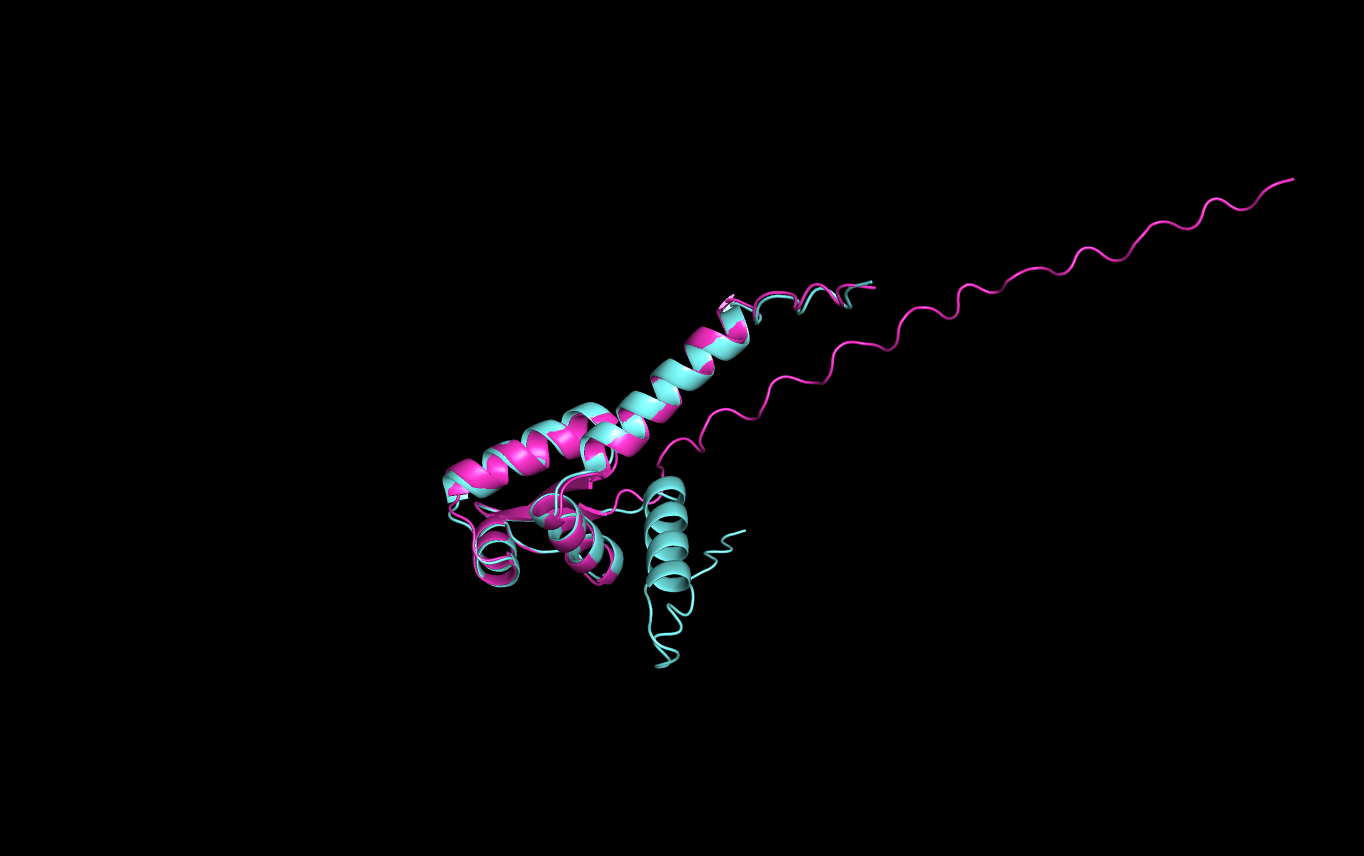
Рисунок 5: Выравнивание seqA (бирюзовый) и seqC (розовый)

Рисунок 6: Предсказание seqA
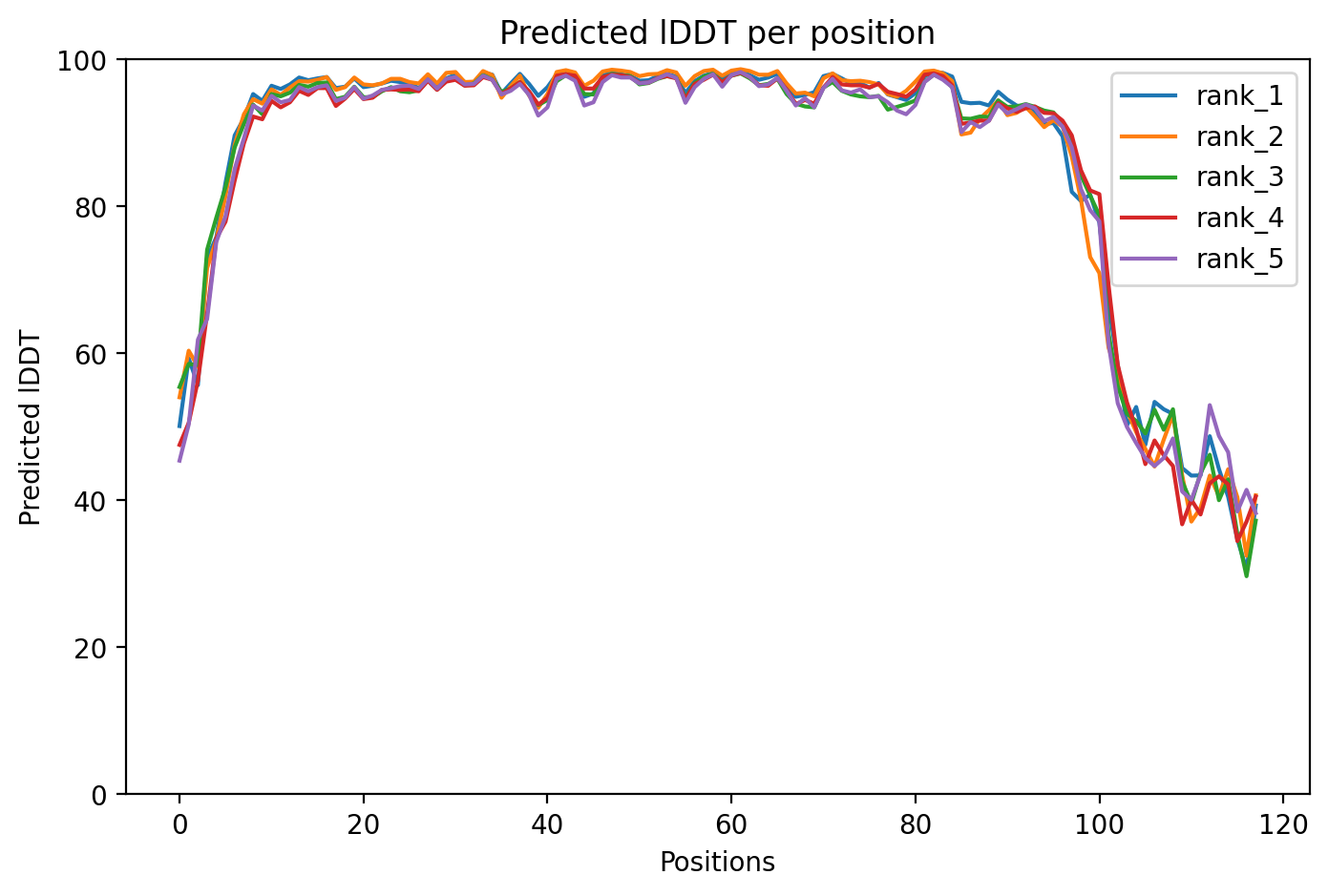
Рисунок 7: Предсказание seqB
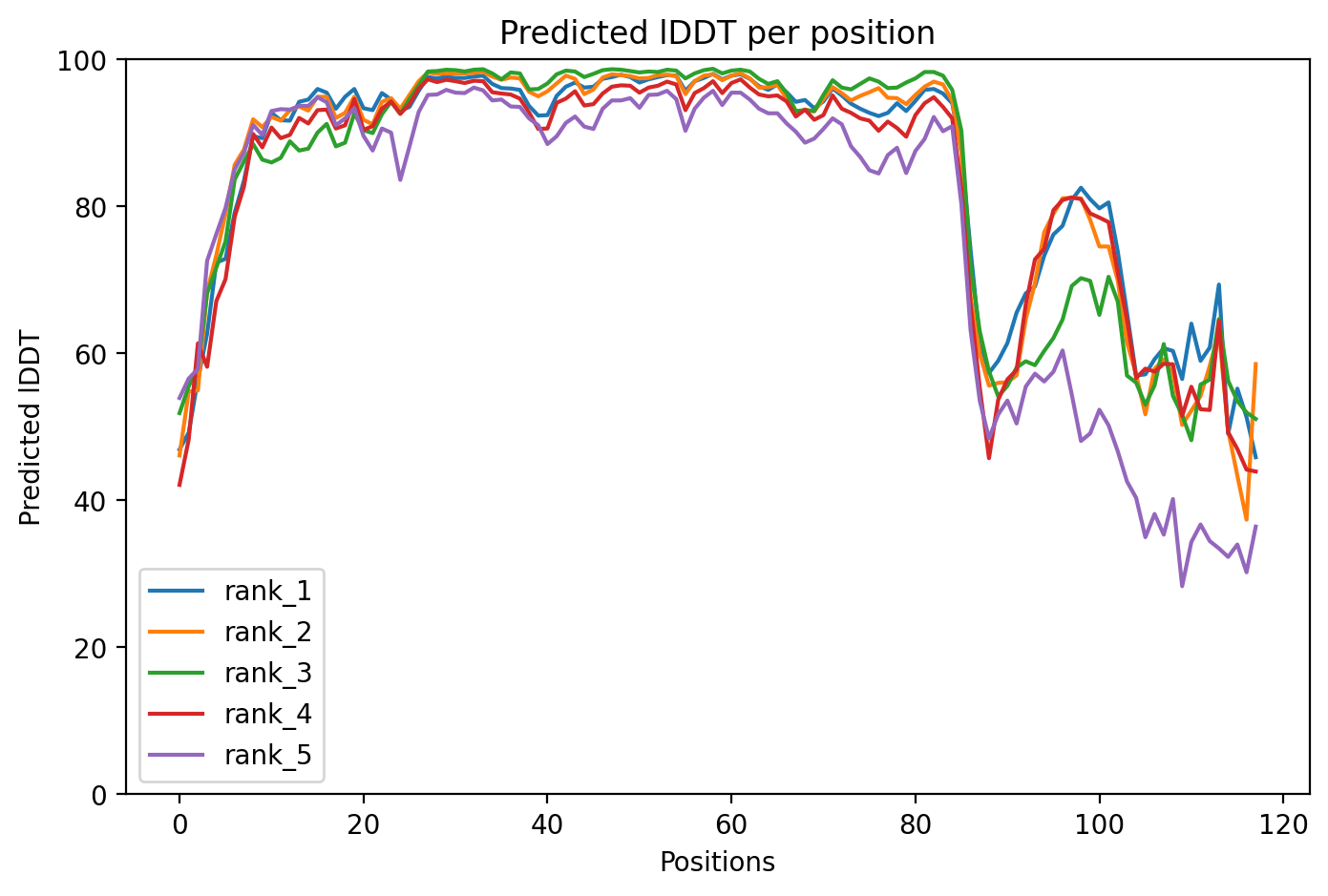
Рисунок 8: Предсказание seqC
С помощью blastp была найдена лучшая находка по seqA - рягуляторный белок NolR Sinorhizobium fredii (PDB:4OMZ).
Выравнивание структуры seqA и 4OMZ(рис. 9) показало, что общее предсказание абсолютно верно.

Рисунок 9: Выравнивание seqA (бирюзовый) и 4OMZ (телесный)
Задание D6: Deletion
Дано две последовательности: seqA и seqB (132 и 108). SeqA без делеций и seqB с N-концевой делецией(делеция первых 23 а.о.).

Рисунок 10: Выравнивание исходных аминокислотных последовательностей
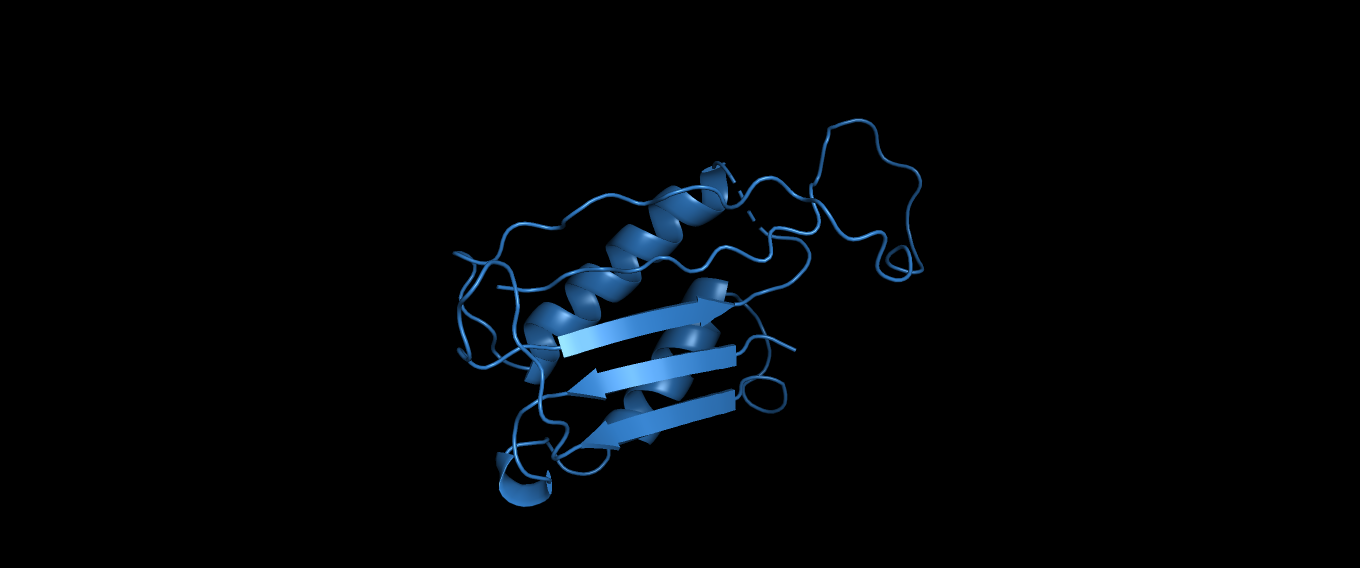
Рисунок 11: SeqA

Рисунок 12: SeqB
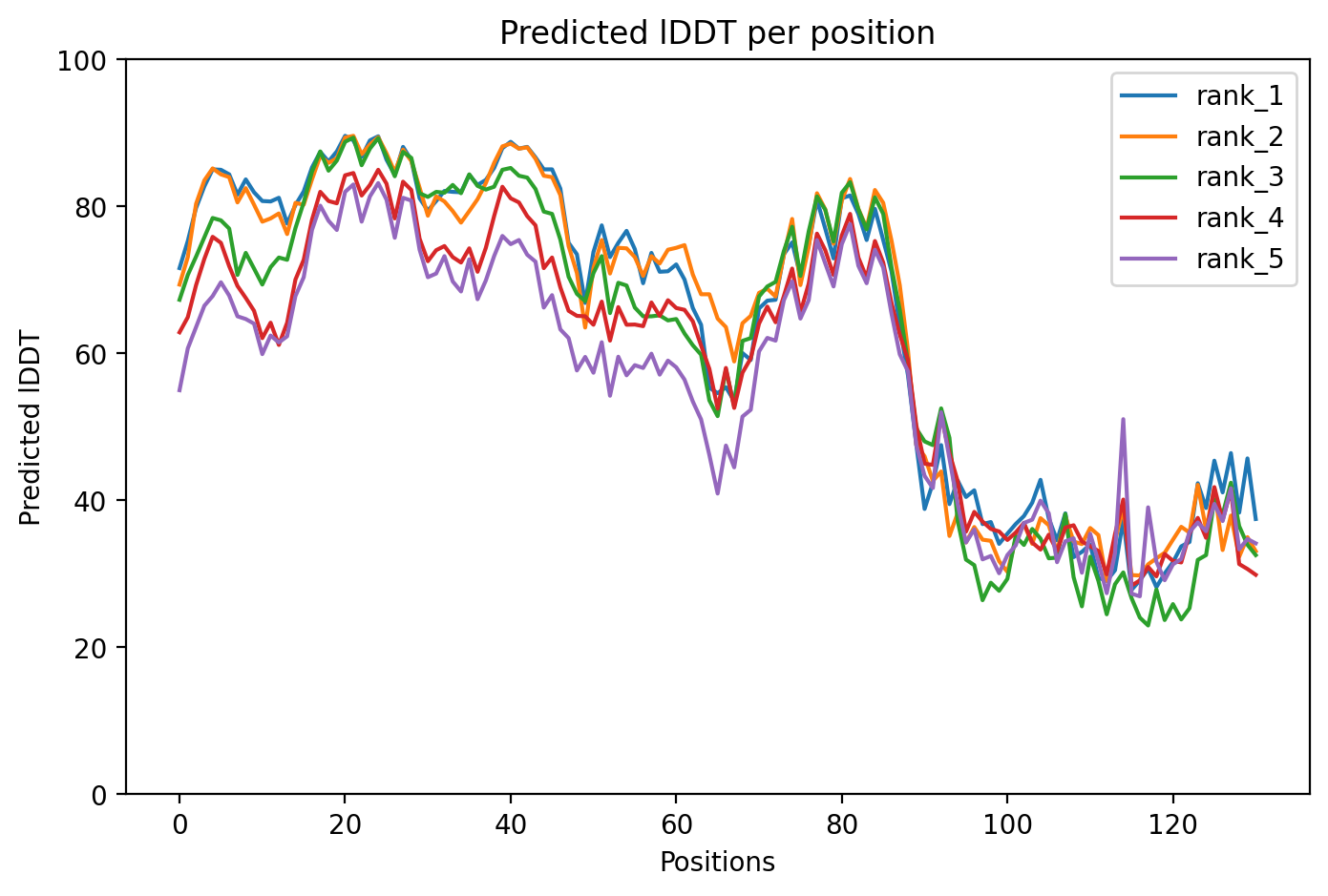
Рисунок 13: Предсказание seqA

Рисунок 14: Предсказание seqB
При наложении стуктур друг на друга можно увидеть, что у структуры с дилецией потерен весь бета-слой(рис.15). Ссылка на сессию Pymol.

Рисунок 15: Выравнивание seqA (синий) и seqB (серебристый )