В рамках этого практикума мы искали взаимодействия между аминокислотными остатками в своём белке.
Примечания: чтобы упростить себе работу в дальнейшем и просто на всякий случай, я дополнительно приведу к каждому типу контактов команды PyMol, которые я использовала для их нахождения.
Были подготовлены иллюстрации контактов следующих типов:
Водородная связь, затрагивающая атомы остова белка
Водородная связь, затрагивающая атомы боковых радикалов аминокислот
- OH-группа: Серин (Ser), Треонин (Thr), Тирозин (Tyr).
- NH или –NH₂: Аспарагин (Asn), Глутамин (Gln), Аргинин (Arg), Лизин (Lys), Гистидин (His).
- Аспарагиновая (Asp), Глутаминовая (Glu) (–COO⁻).
- Asn, Gln (–CONH₂).
- His (азот имидазольного кольца).
Солевые мостики
- Положительно заряженные: лизин(Lys), аргинин(Arg), гистидин (His).
- Отрицательно заряженные: аспарагиновая (Asp) и глутаминовая(Glu) кислота.
Дисульфидная связь
Стекинг
fetch 7frq
select helix, resi 15-27
cmd.show_as("sticks" ,"helix")
cmd.remove("(solvent and (All))")
color purple, helix and name C* # Покрасить все углероды в выбранной спирали
PyMOL>wizard measurement
PyMOL>bg_color white
#нажать на Label --> residues, чтобы добавить подписи
PyMOL>cmd.center("measure01",animate=-1)
PyMOL>set label_color, white
PyMOL>ray 2000, 2000
Пояснения:
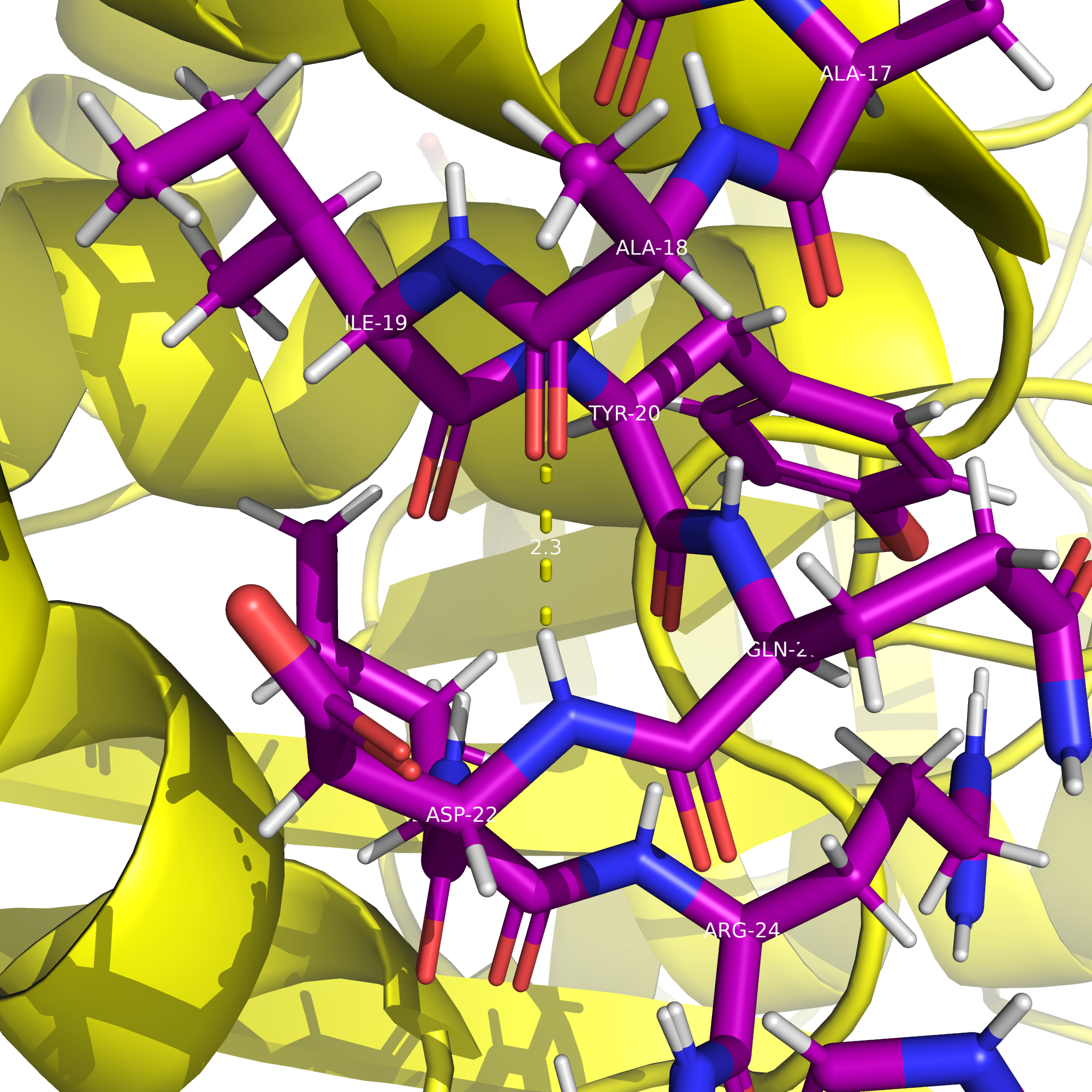
Остов белка — это цепочка атомов, повторяющаяся для каждого аминокислотного остатка: N (азот) — Cα (альфа-углерод) — C (карбонильный углерод) — O (карбонильный кислород). Боковые цепи (R-группы) к остову не относятся. Т.е. водородные связи, затрагивающие атомы остова белка, - это связи, стабилизирующие вторичную и третичную структуру, например, между N–H одного витка O=C другого витка альфа-спирали.
Критерии водородной связи в остове
Оптимальное расстояние: между донором и акцептором 2.5 - 3.5 Å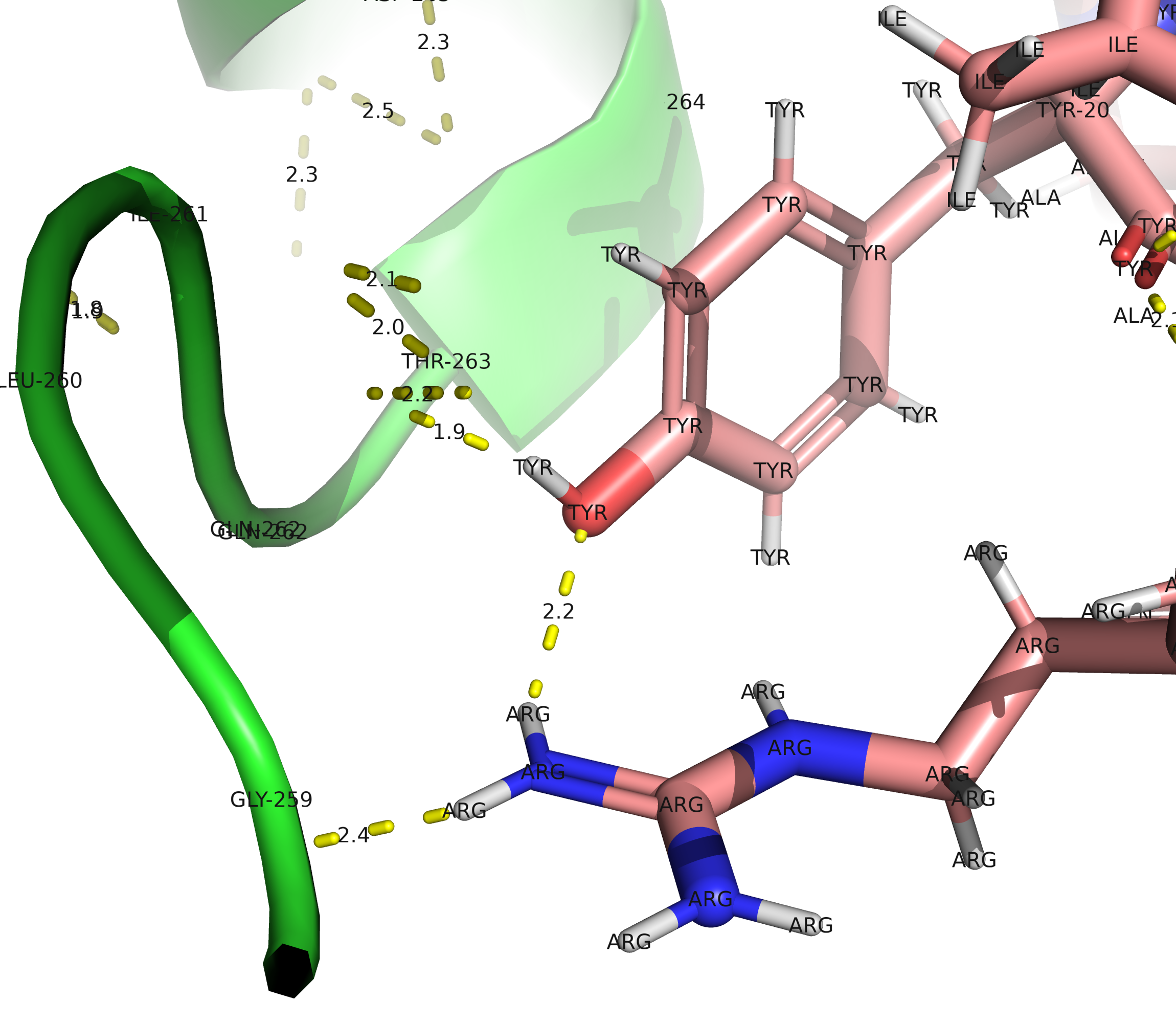
Не все аминокислоты способны к образованию H-связей через боковые цепи. Основные участники:
Доноры водорода (имеют –OH или –NH группы):В идеале, донор и акцептор должны располагаться на одной линии.
Оптимальное расстояние: между донором и акцептором - 2.5 - 3.5 Å.
Примеры связей: Ser–OH···O=C–Glu (водород от гидроксила серина к карбоксилу глутамата). Arg–NH···O=C–Asp (водород от гуанидиновой группы аргинина к карбоксилу аспартата).Соответвенно, я выделила с помощью select эти аминокислоты в два отдельных объекта (доноры и акцепторы) и сделала то же самое, что и в прошлом пункте, найдя водородную связь между двадцатым аминокислотным остатком тирозина (TYR-20) и 24 остатком аргинина (ARG-24).
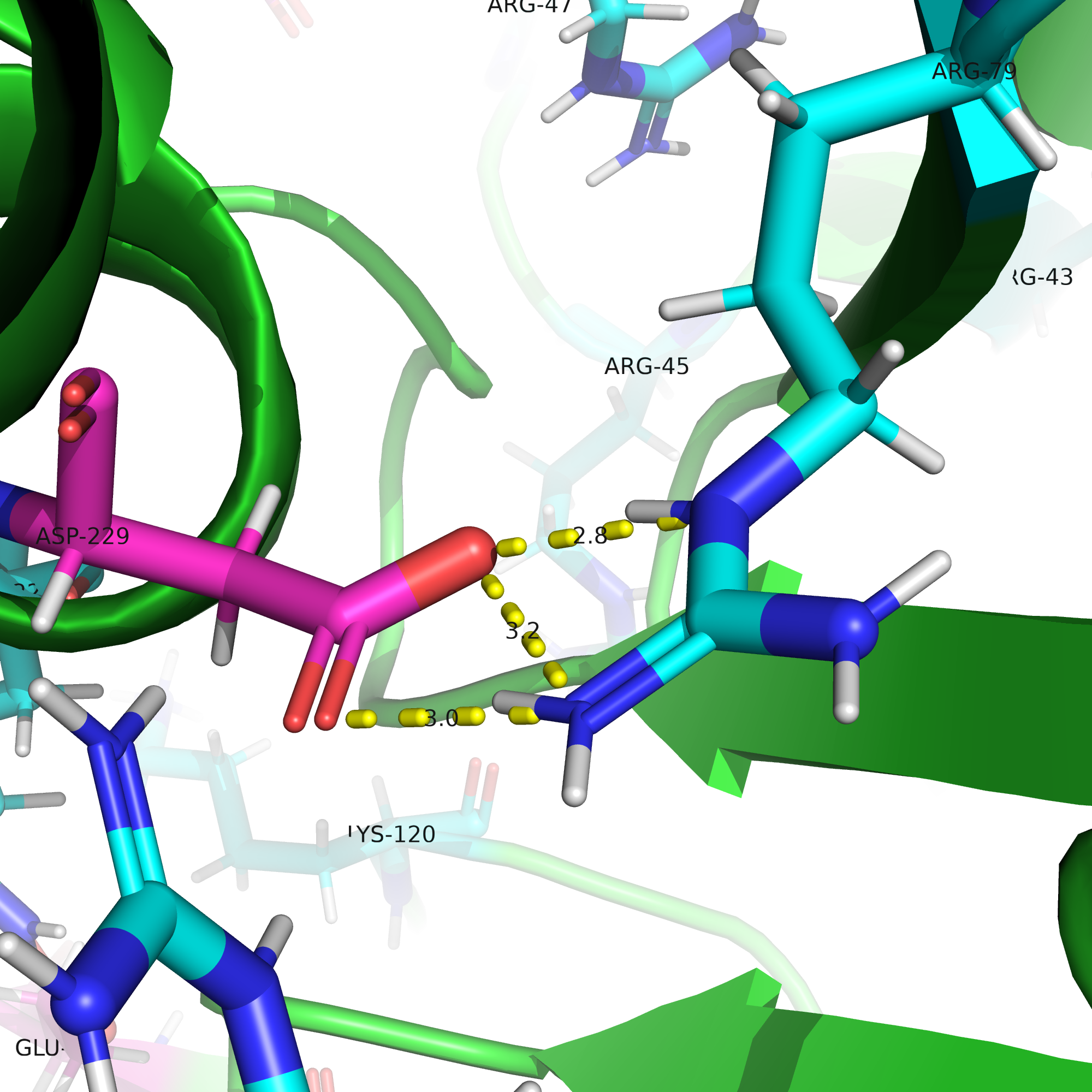
Оптимальное расстояние: 3 - 4.5 Å.
Следовательно, я так же выделила их в два объекта и нашла связи, как и в прошлом подпункте.
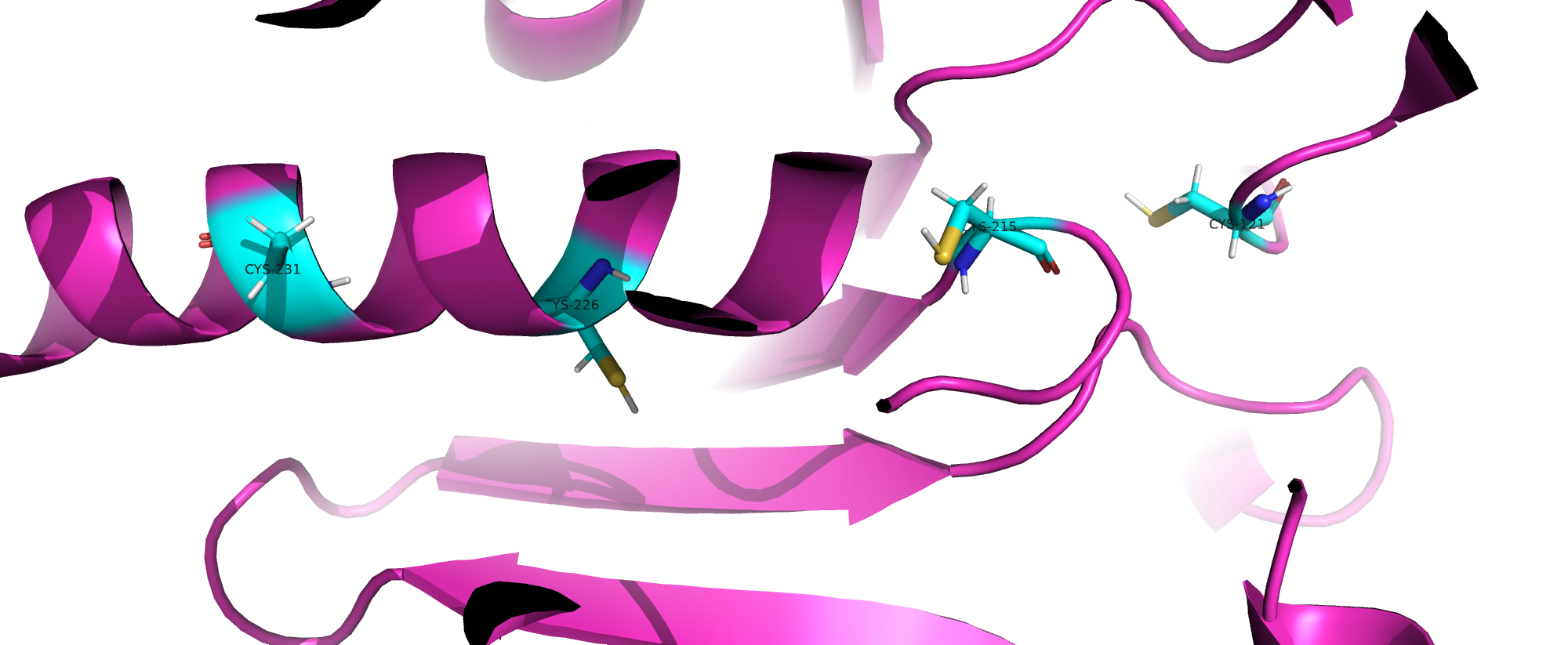
Дисульфидные мостики образуются между цистеинами, однако в исследуемом белке таких связей не было. Во всей структуре нашлось 4 а.о. цистеина. На изображении выше видны они все и наглядно показано отсутвие взаимодействия.
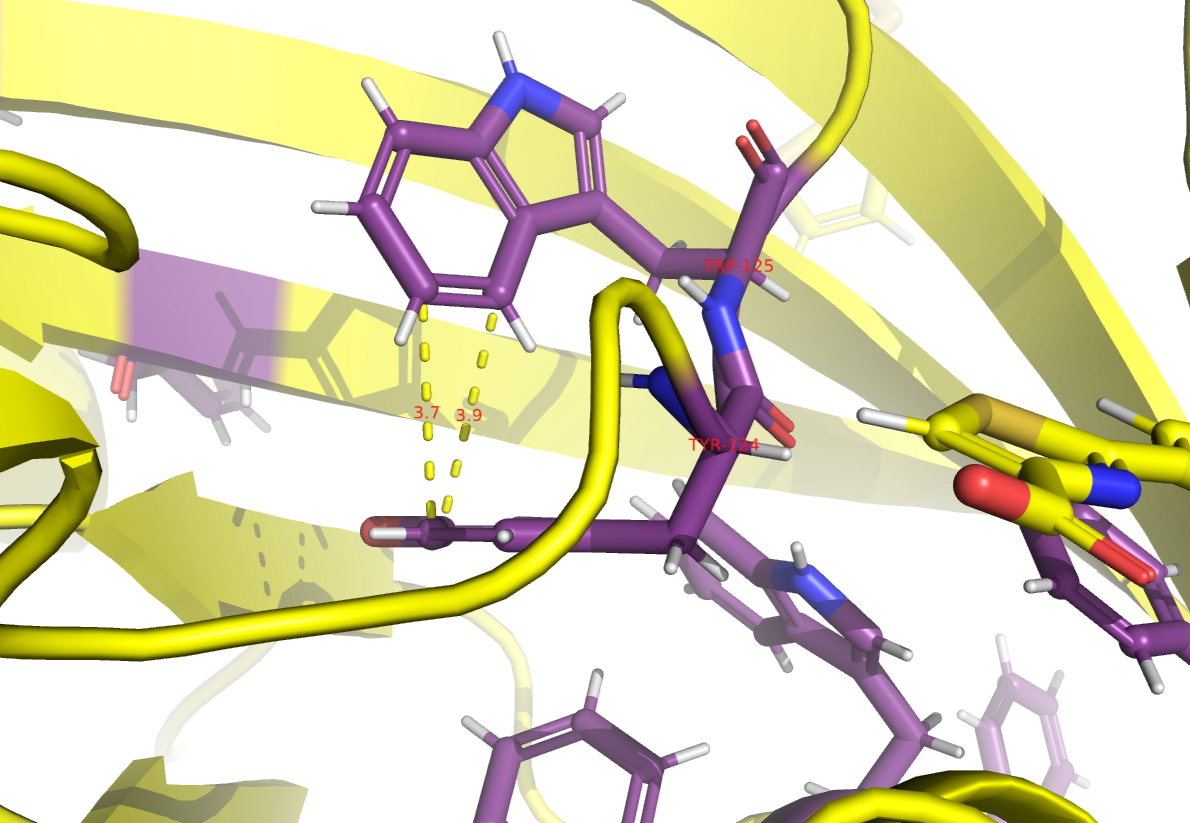
В белке был найден пример T-стекинга.
T-стекинг (от англ. T-shaped stacking) — это особый тип π-π взаимодействия между ароматическими кольцами, в котором два кольца расположены перпендикулярно друг другу, образуя форму буквы "T".
Требования:Оптимальное расстояние: между кольцами 4 - 6 Å.
Возможные аминокислоты: стекинг может быть только между ароматическими аминокислотами, а именно фениланином(Phe), тирозином(Tyr) и триптофаном(Trp).
Соответвенно, отдельным объектом с помощью select были выбраны эти три а.о., покрашены в другой цвет для удобства и был найден пример стекинга.