1. Выбор белка
C помощью расширенного поиска на сайте Uniprot были найдены записи о белках моей бактерии, Prevotella Bryantii. По запросу "Prevotella Bryantii" в базе данных оказалось 7 аннотированных белков (Swiss-Prot). Далее белки были отобраны согласно "Annotation score": весу пять соответствовало 2 белка, оба из которых были выделены из штамма Xylanibacter ruminicola (Prevotella ruminicola) - это старое название вида бактерии, поэтому было решено продолжить поиск подходящего белка. Весу 4 соответствовало 2 белка, один из которых так же относился к Prevotella ruminicola, поэтому белком для исследования был выбран второй оставшийся c ID: GLMK_SEGBR.
2. Информация о белке
Белок глюкоманнокиназа - это фермент, обладающий большим сродством к глюкозе и маннозе. Класс фермента EC: 2.7.1.2, он относится к глюкокиназам (2.7.1.2), фосфотрансферазам с алкогольной группой в качестве акцептора (2.7.1), белкам, переносящим фосфоро-содержащие группы(2.7) и трансферазам(2).
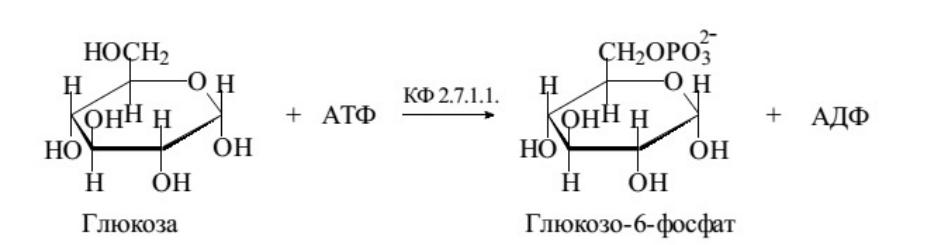
Фермент катализирует реакцию фосфорилирования D-глюкозы по гидроксильной группе при шестом атоме углерода с образованием глюкозо-6-фосфата, это эндотермическая реакция, использующая АТФ. Её краткая запись:
D-глюкоза + АТФ = D-глюкозо-6-фосфат + АДФ + Н+.
Таким же образом глюкоманнокиназой катализируется фосфолирирование маннозы. 2-дезоксиглюкоза может вступать с ферментом в конкурентное ингибирование, конкурируя с ним за связывание с субстратом. Белок связан с метаболическими путями, такими как расщепление углеводов, гликолиз, D-глицеральдегид-3-фосфат и глицеронфосфат из D-глюкозы: этап 1/4, метаболизм углеводов, метаболизм маннозы.
Несмотря на то, что в классическом гликолизе эту реакцию обычно выполняет гексокиназа, у некоторых бактерий (особенно специализирующихся на расщеплении полисахаридов) эту роль берут специфические киназы, например, глюкоманнокиназы. Так что видеть такой фермент у бактерии вида Prevotella Bryantii вполне ожидаемо, ведь она обитает в рубце жвачных животных и участвует в расщеплении сложных углеводов, играя ключевую роль в анаэробном метаболизме.
Краткая информация о белке приведена в таблице ниже. Все данные были взяты из записи Uniprot, исключение состравляет строчка INSDC, комментарии по которой я бы хотела дать дополнительно.
Раздел INSDC: в записи Uniprot на прямую не упомянались ссылки на нуклеотидные архивы, которые называются EMBL, поэтому было решено найти их с помощью NCBI (базы Protein). Вбив в поисковую строку сайта запрос "txid77095[Organism] AND (glucokinase OR mannokinase)", включающий ID организма из раздела Organism записи Uniprot и название нужного белка, я отсортировала результаты по "Source databases" — EMBL и получила 2 результата, accession которых и был записан в файл с отчётом.
Database:Swiss-Prot ID:GLMK_SEGBR AC:P82680 Version:54 Name:Glucomannokinase TaxID:77095 INSDC:SDZ98865.1,SDL59832.1 Length:25 MW:2670
3. Кластеры похожих белков
Для белка были найдены кластеры UniRef, путём выбора базы Uniref для поиска в начале страницы. Как и для каждого белка UniProtKB для него есть ровно по одному кластеру в UniRef50, UniRef90 и UniRef100. Кластеры имеют следующие параметры:ID:UniRef100_P82680 Size:3 Length:25 Name:Glucomannokinase (Fragment) ID:UniRef90_P82680 Size:3 Length:25 Name:Glucomannokinase (Fragment) ID:UniRef50_P82680 Size:733 Length:25 Name:Glucomannokinase (Fragment)
UniRef90 с размером 3 указывает на очень близкие ортологи с идентичностью ≥90%. Маленький размер кластера может говорить о том, что белок консервативен только у близкородственных видов, например, в пределах одного рода или семейства.
UniRef50 с 733 белками показывает, что при снижении порога идентичности до 50% находится много белков со схожей последовательностью. Это говорит о том, что функциональные домены белка (например, каталитические участки) высоко консервативны в более широком эволюционном контексте. Такое большое количество белков в UniRef50 указывает на важную роль этого фермента в базовых метаболических процессах, возможно, глюкокиназной или маннокиназной активности, которые необходимы разным организмам.
Стоит обратить внимание на то, что все кластеры имеют одинаковую длину (25 аминокислот), и имя включает слово "Fragment". Это может означать, что оригинальный белок был аннотирован как фрагмент, что иногда встречается в автоматически предсказанных записях. Однако, стоит заметить, что запись была проверена вручную, на что указывает её статус (Status: UniProtKB reviewed (Swiss-Prot)).
Возможно, полная последовательность белка длиннее, и кластеры основаны на этом фрагменте, что влияет на интерпретацию данных.
(но я обнаружила это слишком поздно, пожалуйста, не заставляйте менять белок и переделывать весь практикум)
4. Поисковые запросы
1. Изучение таксономической представленности глюкокиназы
Так как мне показалось не обычным, что первую реакцию гликолиза катализирует не гексокиназа, а глюкоманнокиназа, мне стало интересно увидеть представленность этого фермента в разных таксономических группах. В поисковую строку был введен запрос "(ec:2.7.1.2)", как и упомяналось раннее, классификация этого фермента. Далее результаты были группированы по таксономии - "Group by Taxonomy", среди них 99% были представлены в клеточных организмах, подавляющее большинство которых (так же 99%) были бактериями.
Я проделала ту же самую операцию с гексокиназой, получив следующее распределение по таксонам: из 15417 клеточных организмов - 11 архей, 789 бактерий и подавляющее большинство, 14610 представлено эукариотами.
Эти наблюдения подтверждают, что доминирование глюкокиназы (EC 2.7.1.2) у бактерий связано с их нишевой специализацией на расщеплении сложных углеводов, таких как глюкоманнаны, в то время как эукариоты и археи полагаются на универсальные ферменты (гексокиназу) или альтернативные метаболические пути.
2. Поиск по ключевым словам
Далее было решено с помощью того же запроса посмотреть белки класса 2.7.1.2, сгруппировать их по ключевым словам (Group by Keywords), и посмотреть на представленность в разных биологических процессах. Предполагаемый результат был увидеть, что подавляющее большинство задействовано в гликолизе. Так и оказалось, из 10155 белков 10037 предствлены в гликолизе, ещё 87 в углеводном обмене, такие результаты говорят о высокой специфичности фермента.
Так же я посмотрела на самую широко представленую группу keywords - молекулярную функцию (38% всех ключевых слов). Около половины ферментов были ДНК-связывающими, остальная половина обозначалась как "мультифункциональные ферменты". Что меня удивило и я задалась вопросом, как глюкокиназа может учатсвывать в связывании ДНК? Указанные в UniProt данные, вероятно, отражают комбинацию эволюционной диверсификации, ограничений аннотации (т.к. большинство белков были автоматически аннотированы и не рецензированными) и контекстно-зависимых функций. Прямое участие глюкокиназы в связывании ДНК маловероятно для большинства организмов, но у отдельных видов или в специфических условиях такая функция не исключена.
И в дополнение можно упомянуть раздел "Cellular component", который даёт понять, что большинство подобных белков глюкокиназ представлены в цитоплазме, что совершенно логично.
3. Поиск по семейству.
Я заметила, что белок входит в семейство "ROK (NagC/XylR) family", о чём написано на его странице. Семейство ROK (Repressor, ORF, Kinase) объединяет разнообразные белки, участвующие в регуляции метаболизма углеводов у бактерий. И возможно, именно из-за принадлежности киназ к этому семейству в результатах из прошлого запроса было много ДНК-связывающих белков, ведь в состав семейства входят транскрипционные репрессоры. Они имеют N-концевой HTH-мотив (helix-turn-helix) для связывания ДНК и С-концевой домен для связывания эффекторов (например, ксилозы у XylR). У киназ отсутствует HTH-домен, но сохраняется каталитический домен, характерный для сахарных киназ.
Далее я группировала белки по классу фермента, и около 99% из них оказались трансферазами, переносящами фосфоро-содержащие группы, что говорит о том, что такой структурный мотив высоко консервативен, широко представлен и просто необходим для глюкокиназы.
