ОБЩИЕ СВЕДЕНИЯ О МЕТАБОЛИЧЕСКОМ ПУТИ БИОСИНТЕЗА ПЕНИЦИЛЛИНА И ЦЕФАЛОСПОРИНА | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
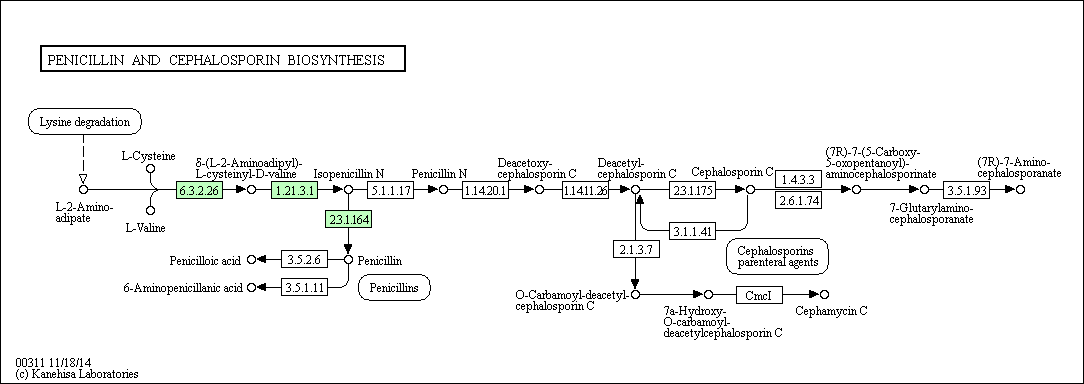
В данном практикуме работа велась с метаболическим путем биосинтеза пеницеллина и цефалоспорина, карта которого (map00311)(Рис.3) была взята из базы данных KEGG. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
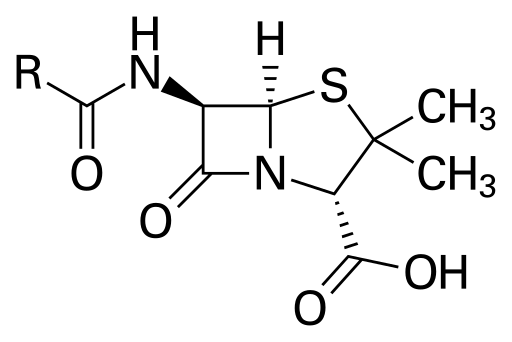
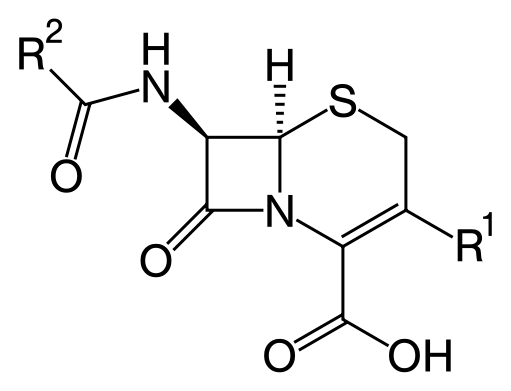
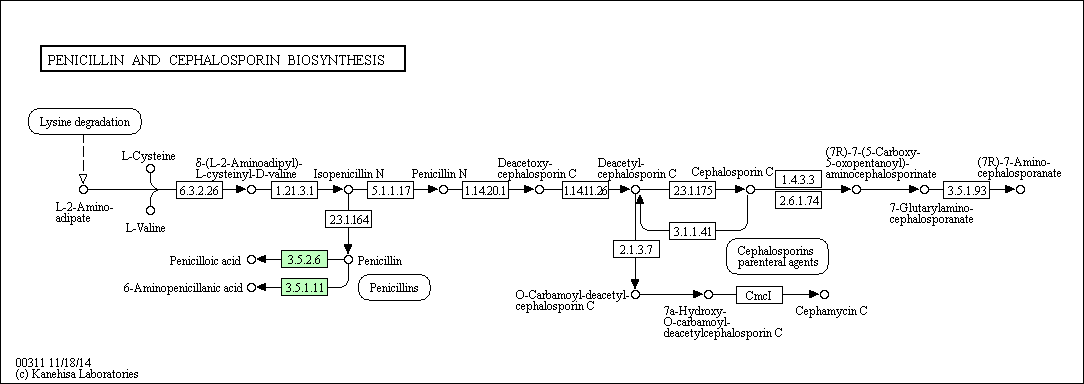
| Пенициллины (пенамы) и цефалоспорины (цефемы) представляют собой бета-лактамные антибиотики, в основе которых лежат 6-аминопенициллановая кислота (6-АПК) и 7-аминоцефалоспорановая кислота (7-АЦК), соответственно. 6-APA и 7-ACA являются ключевыми интермедиатами для синтеза различных производных пенициллина и цефалоспорина. Пенициллины производятся исключительно грибами, а цефалоспорины (включая цефамицины) продуцируются и грибами, и бактериями.[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Пенициллины и цефалоспорины обладают бактерицидным эффектом. Механизм их действия связан с нарушением синтеза пептидогликана, являющегося основным компонентом клеточной стенки бактерий, а именно подавлением транспептидазной реакции синтеза компонентов клеточной стенки (например D-аланина). Основными особенностями цефалоспоринов по сравнению с пенициллинами являются их большая резистентность по отношению к β-лактамазам, ферментам, синтузируемым бактериями в качестве приобретенной устойчивости к антибиотикам. [2][3] Оба антибиотика синтезируются из L-2-аминоадипата, L-цистеина и L-валина через общий путь. Он начинается с конденсации этих трех аминокислот с помощью не рибосомальной пептидной синтетазы с образованием трипептидного дельта- (L-2-аминоадипил) -L-цистеинил-D-валина (ACV). Затем трипептид линейного ACV превращают в бициклический изопенициллин N изопенициллином N-синтазой, в котором образуется бета-лактамное кольцо. Изопенициллин N является точкой разветвления путей пенициллина и цефалоспорина. [1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Рис.3. Карта метаболического пути биосинтеза пенициллина и цефалоспорина (map00311). Прямоугольными рамками отмечены вещества,
связывающий данный путь с другими биохимическими путями. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
МЕТАБОЛИЧЕСКИЙ ПУТЬ БИОСИНТЕЗА ПЕНИЦИЛЛИНА И ЦЕФАЛОСПОРИНА В РАЗНЫХ ДОМЕНАХ ЖИЗНИ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Было рассмотренно представлительство данного биохимического пути у трех различных, случайно выбранных предствителей из трех доменов жизни: эукариоты, бактерии, археи. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
РЕАКЦИЯ ОКИСЛЕНИЯ ПЕНИЦИЛЛИНА-N В KEGG | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
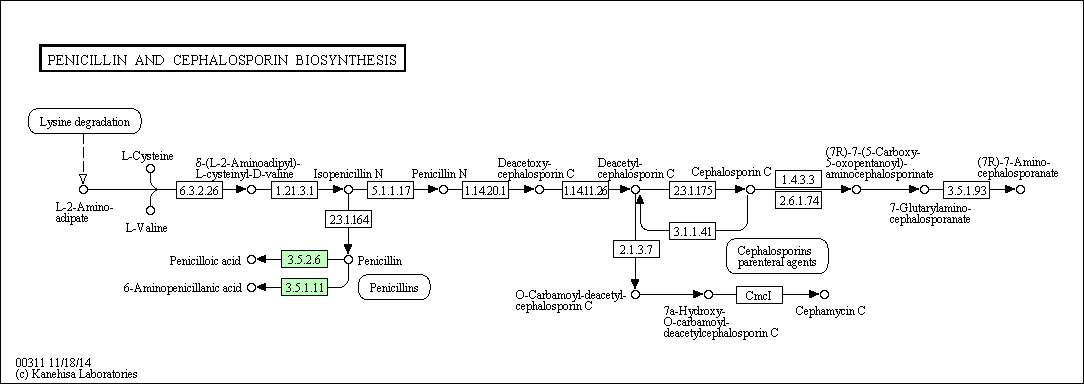
Из метаболического пути синтеза цефалоспорина была рассмотрена реакция окисления пенициллина-N ( R05301), отмеченная на Рис.5. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Рис.5. Метаболичесеий путь синтеза пенициллина и цефалоспорина. Красным отмечена реацкция окисления пенициллина-N.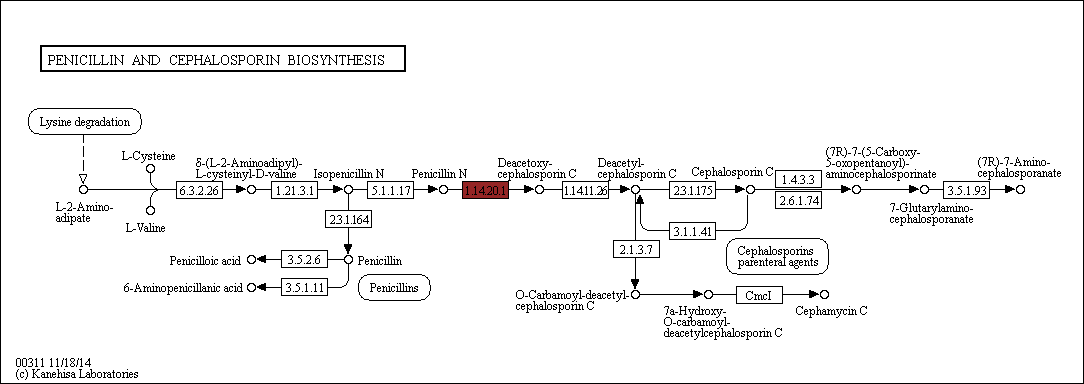 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
На Рис.6 представлена схема данной рекции. Она происходит при участии фермента деацетоксицефалоспорин-C-синтетаза (EC 1.14.20.1). Этот фермент относится к классу оксидоредуктаз, которые используют два субстрата и молекулярный кислород в качестве окислителя при этом происходит встраивание кислорода в молекулу. В качестве ко-субстрата для окисления выступает 2-оксиглутарат. Вводимый кислород не должен быть получен из молекулы O2, реакция требует присутствия 2-окисглутората в качестве донора и еще одного гидрированного.[4][5] В ходе реакции окисления при участии молекулярного кислорода и косубстрата 2-оксиглутарата феремент деацетоксицефалоспорин С синтетаза окисляет пенициллин-N c образованием в качестве продуктов деацетоксицефалоспорина С, суккцината, углекислого газа и воды. В общем виде реакция выглядит так:
penicillin N + 2-oxoglutarate + O2 = deacetoxycephalosporin C + succinate + CO2 + H2O | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Рис.6.Схема реакции окисления пенициллина-N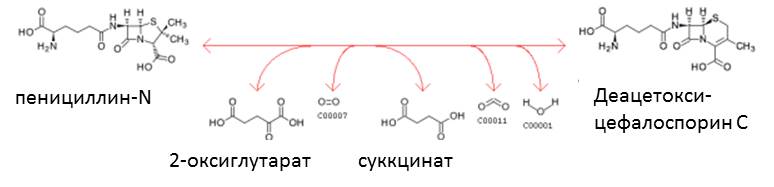 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
ССЫЛКИ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Главнaя страница | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||