|
Карань Анна |
|||
| Главная | О себе | Учеба | ФББ МГУ |
Комплекс аминопептидазы с ингибитором
Снизу вы видете аминопептидазу N бактерии Neisseria meningitidis MC58 с PDB ID 4QUO. Чтобы запустить скрипт и увидеть разные варианты изображения белка нажмите один "Start script", а дальше для смены изображения нажимайте "Resume".
Какие вы видете изображения (по порядку):
1. (до нажатия кнопок) Изображение в виде картонок.
(cartoons) с раскраской по вторичной структуре и с шаро-стержневым изображением лигандов и воды.
2. Изображение в виде картонок (cartoons) с раскраской по цепочкам.
3. Изображение в виде картонок (cartoons) с раскраской по вторичной структуре.
4. То же самое + изображение шаро-стержневой модели лиганда с раскраской по химическим элементам.
5. Изображение белка в виде ван-дер-ваальсовых радиусов (spacefill) с раскраской по химическим элементам.
6. Изображение остова одной альфа-спирали с обозначением водородных связей.
7. Изображение двух бета-тяжей с обозначением водородных связей между ними.
Текст скрипта можно увидеть тут
Параметры водородных связей между остовными атомами азота и кислорода:
| № | Имена атомов | Длина связи(Å) | Угол N-O-C(°) |
| А-спирали | |||
| 1 | N(652HIS)-O(648LEU) | 3.14 | 160.7 |
| 2 | N(663ASN)-O(659ALA) | 3.37 | 146.8 |
| 3 | N(380GLY)-O(375THR) | 2.98 | 158.6 |
| 4 | N(408ASP)-O(404PHE) | 3.03 | 132.8 |
| 5 | N(321PHE)-O(317GLY) | 2.9 | 149.9 |
| Среднее значение | 3.08 | 149.76 | |
| B-листы | |||
| 1 | N(485ASN)-O(489GLU) | 2.93 | 156.9 |
| 2 | N(477ILE)-O(507LEU) | 2.84 | 162.4 |
| 3 | N(47GLU)-O(44ARG) | 3.36 | 142.3 |
| 4 | N(53GLY)-O(74GLU) | 2.87 | 133.2 |
| 5 | N(91GLU)-O(59SER) | 2.94 | 146.3 | Среднее значение | 2.99 | 148.22 |
Согласно данным, приведенным в таблице, длина водородной связи и угол N-O-C не зависят от вида вторичной структуры белка и варьируются в пределах 2.84-3.37Å и 132.8-160.7° соответственно среди измеренных связей. Разброс достаточно небольшой, поэтому значения по всем водородным связям скорей всего не сильно будут отличаться от полученных даже на такой маленькой выборке, что объясняется едиными характеристиками для всех водородных связях N-O, например, водородные связи тем устойчевее, чем больше угол, соответственно, острых углов точно не будет. Но почему же мы в первом же практикуме по структуре белков обращаем внимание именно на этот тип взаимодействия в белке, неужели межмолекулярные взаимодействия, даже такие сильные как водородные связи, могут играть решающую роль в укладке и функционировании белка? Да, для формирования определенной вторичной структуры наиболее важны именно водородные связи. Наиболее известными типами вторичной стуктуры являются а-спирали и b-слои. Известно, что а-спираль является преобладающей структурой в а-кератинах. Более того, около четверти всех аминокислотных остатков в полипептидных цепях входят в состав а-спиралей (в разных белках это значение немного отличается). Почему а-спирали образуются чаще других стуктур? До некоторой степени это объясняется тем, что в а-спирали оптимальным образом используются водородные связи внтури молекулы. (Рис.1)
 |
 |
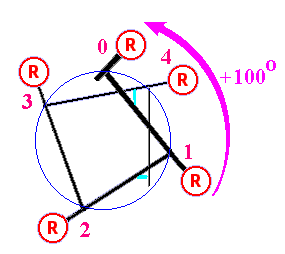 |
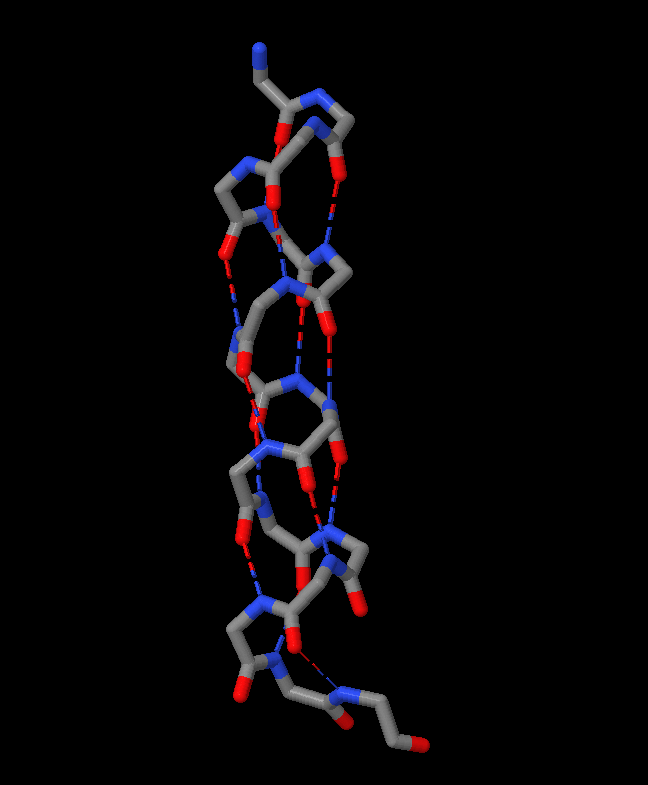
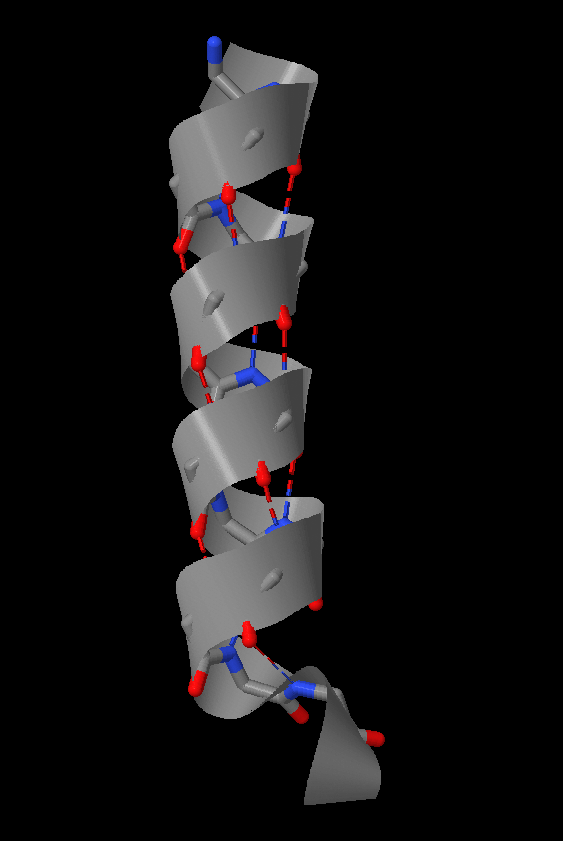
Рис.1 Сверху: Часть а-спирали исследуемого белка только с остовными атомами, слева без картонок, справо с картонками. Здесь видно общее строение а-спирали, число водородных связей и аминокислот на виток. Снизу: Проекция спирали. Стрелка показывает поворот спирали (в расчете на один остаток) по мере ее приближения к нам |
Данная структура стабилизируется водородными связями между атомом водорода, соединенным с электроотрицательным атомом азота пептидной связи, и электроотрицательным атомом кислорода карбонильной группы четвертой аминокислоты (считая водль цепи назад). Связь с 4 остатков позволяет упаковывать атомы достаточно плотно, но без напряжения. В образовании подобных водородных связей участвует каждая пептидная группа а-спирали (кроме концевых). В результате каждый последующий виток связан с предыдущим 3 и 4-мя водородными связями, что делает эту конформацию полипептидной цепи довольно устойчивой.
©Карань Анна, 2015