Пространственная структура трипсина(5LH8)
Общая структура
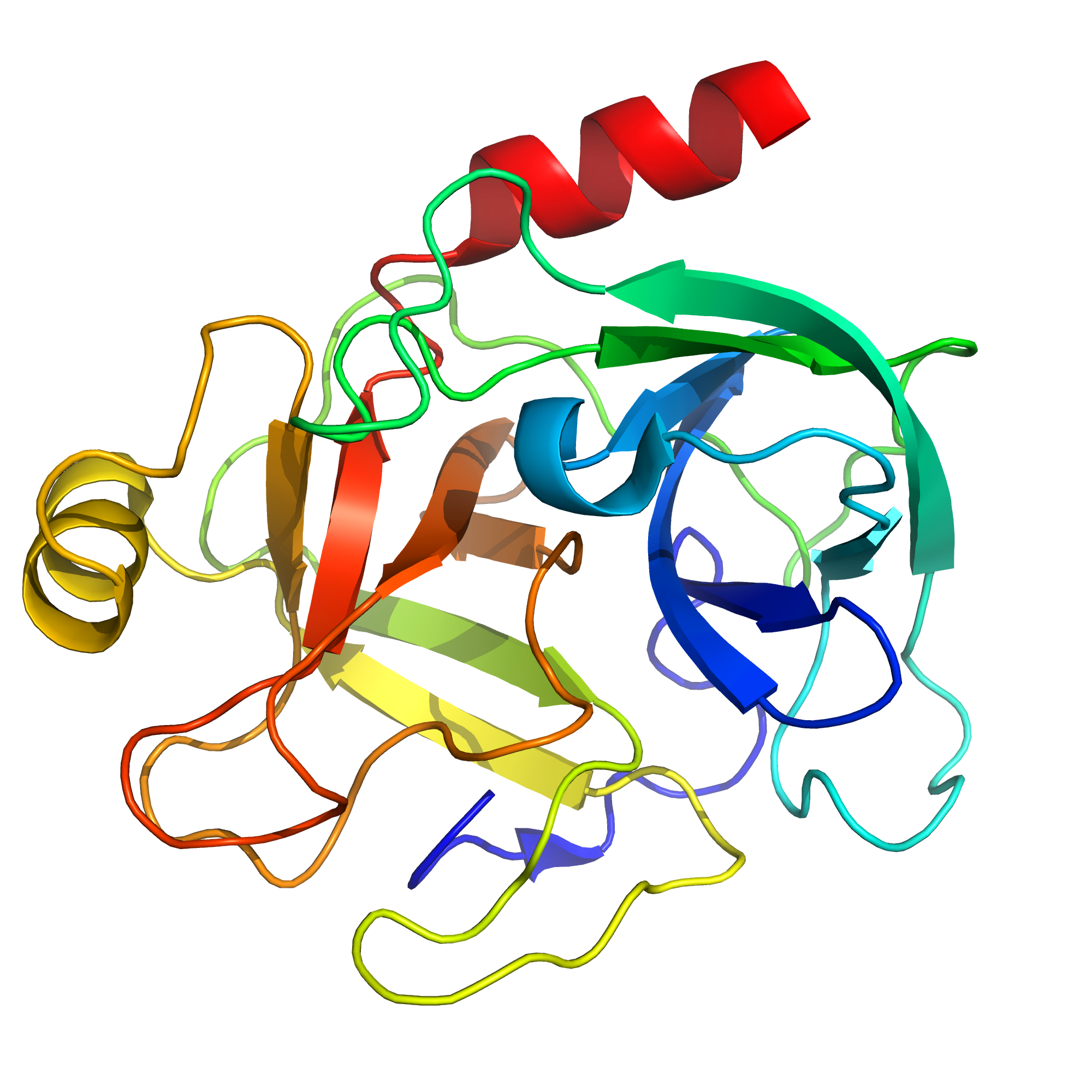
На Рис. 1 представлен общий ход полипептидного остова трипсина(N-конец окрашен в синий, а С-конец – в красный). Трипсин – это фермент поджелудочной железы, обладающий пептидазной активностью(преимущественно расщепляет пептид по связям Arg-|-Xaa и Lys-|-Xaa, где Xaa – любая аминокислота) и относящийся к классу сериновых протеаз. Белок представлен одной полипептидной цепью, при этом его биологическая единица никак не отличается от ассиметрической. Фермент был получен из Bos taurus(uniprot_id - P00760), мутаций относительно референсной последовательности нет, потстрансляционная модификация аминокислотных отстаков не происходит.
Малые молекулы
- 6WH – (2~{S},4~{S})-1-[4-(aminomethyl)-3-methoxy-phenyl]carbonyl-4-(4-cyclopropyl-1,2,3-triazol-1-yl)-~{N}-[(1~{S},2~{R})-2-phenylcyclohexyl]pyrrolidine-2-carboxamide(новый найденный ингибитор трипсина)
- DMS – диметилсульфоксид(использовался для кристаллизации белка из раствора ДМСО в воде)
- CA – ион кальция(кофактор трипсина)
- HOH – молекулы воды
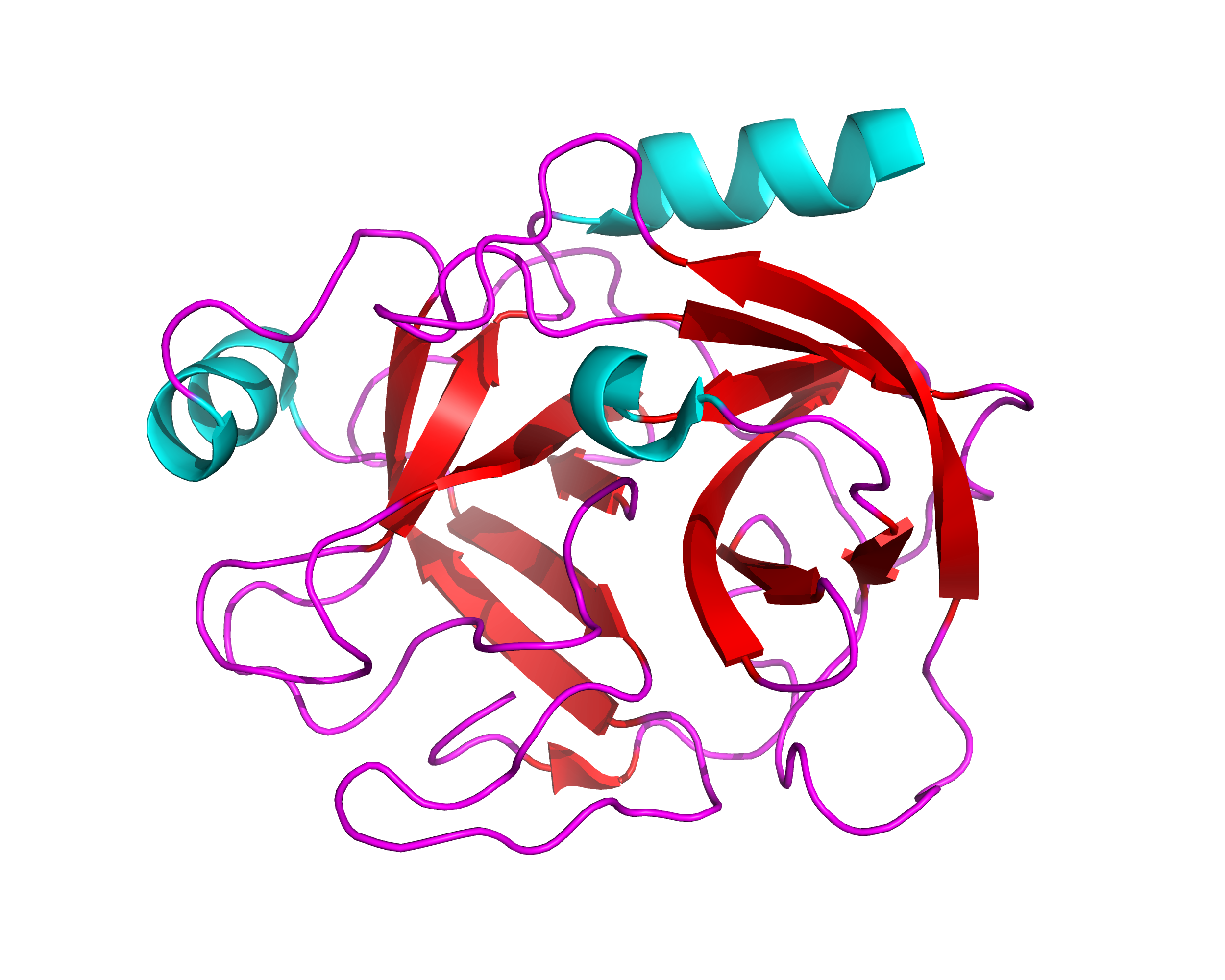
На Рис. 2 показан общий вид фермента с выделенными вторичными структурами(альфа-спирали показаны голубым, бета-листы – красным, неструктурированные петли – фиолетовым), а на Рис. 3 показано взаимодействие трипсина с ингибитором 6WH.
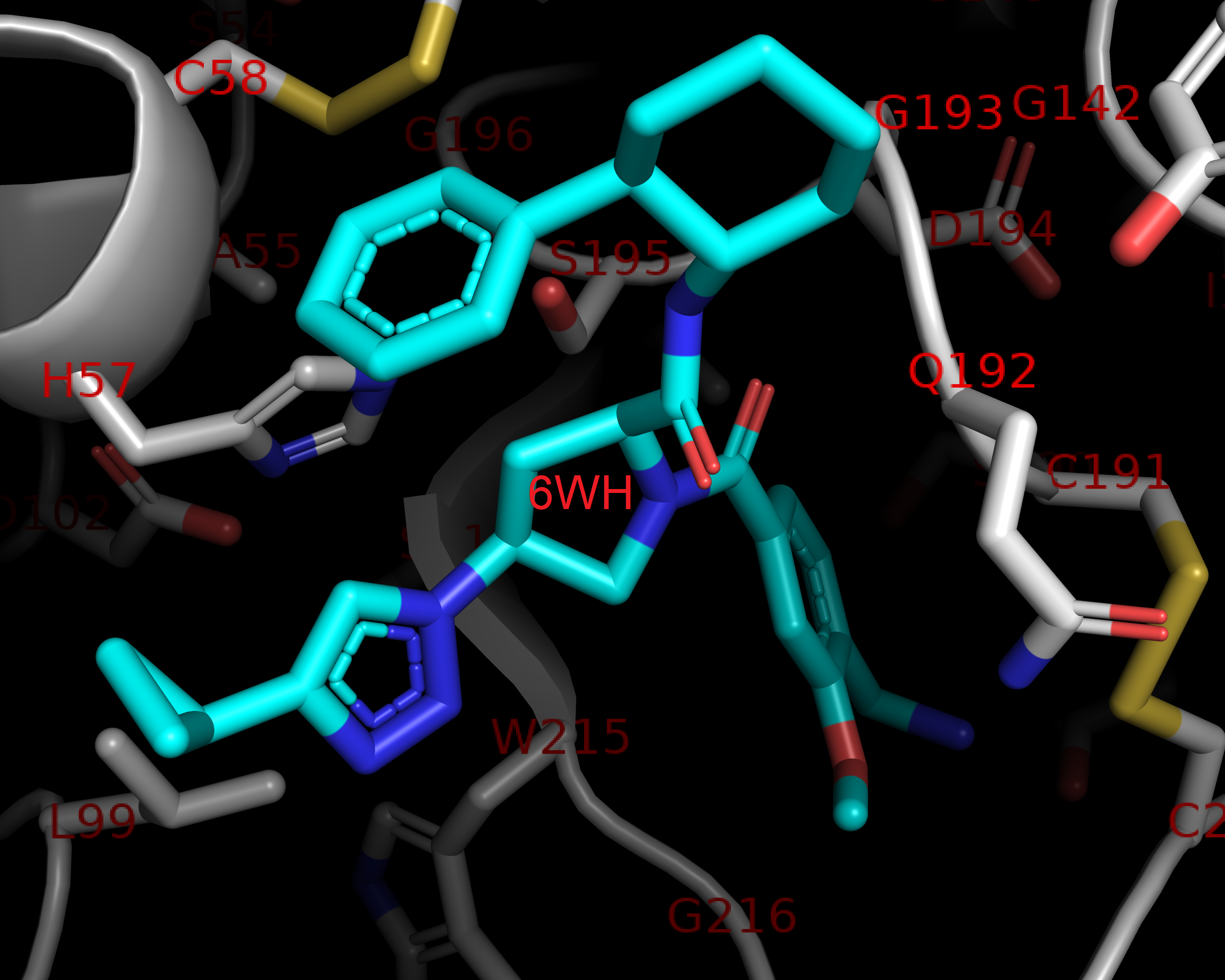
Внутримолекулярные взаимодействия полипептидной цепи
.png)
.png)
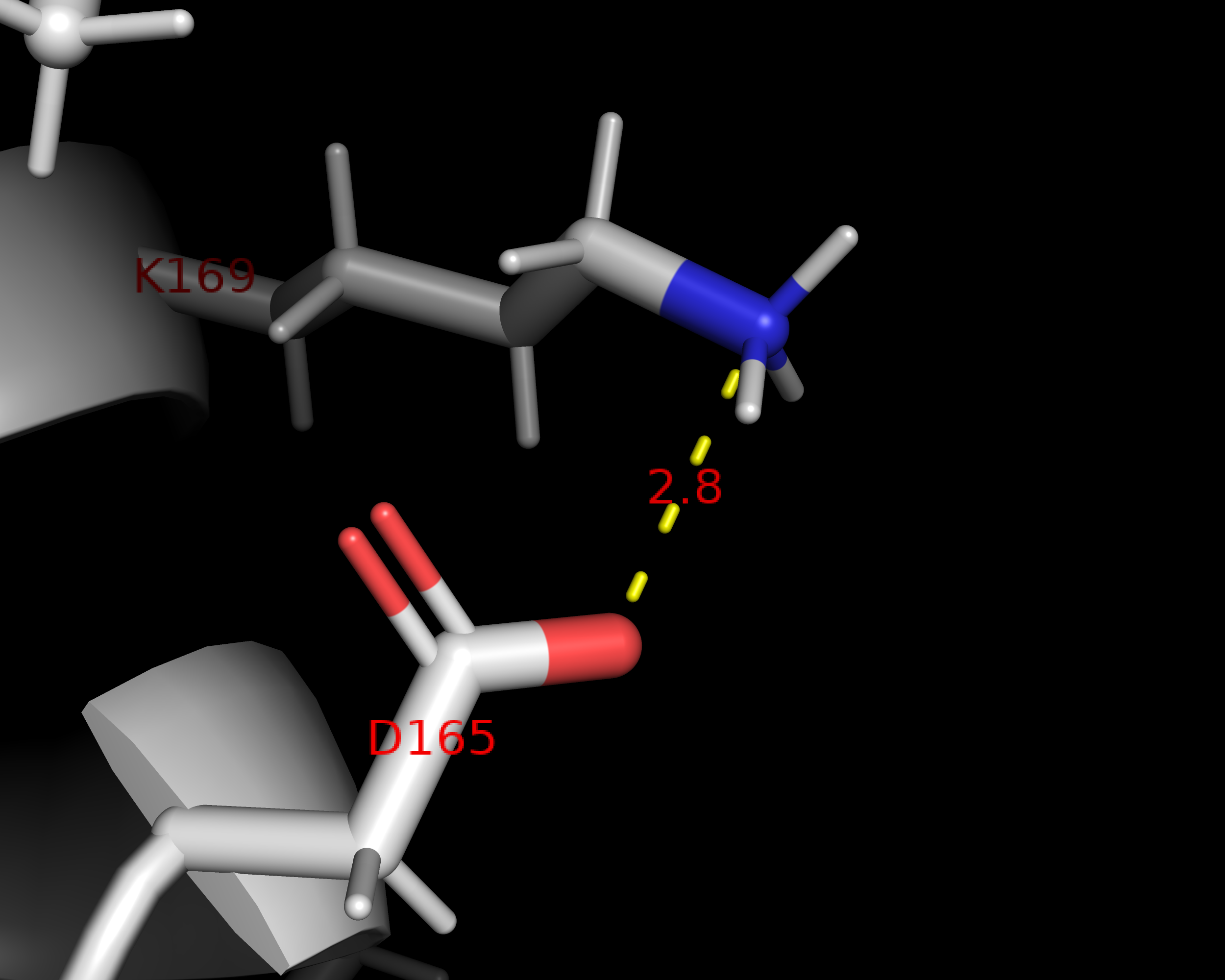
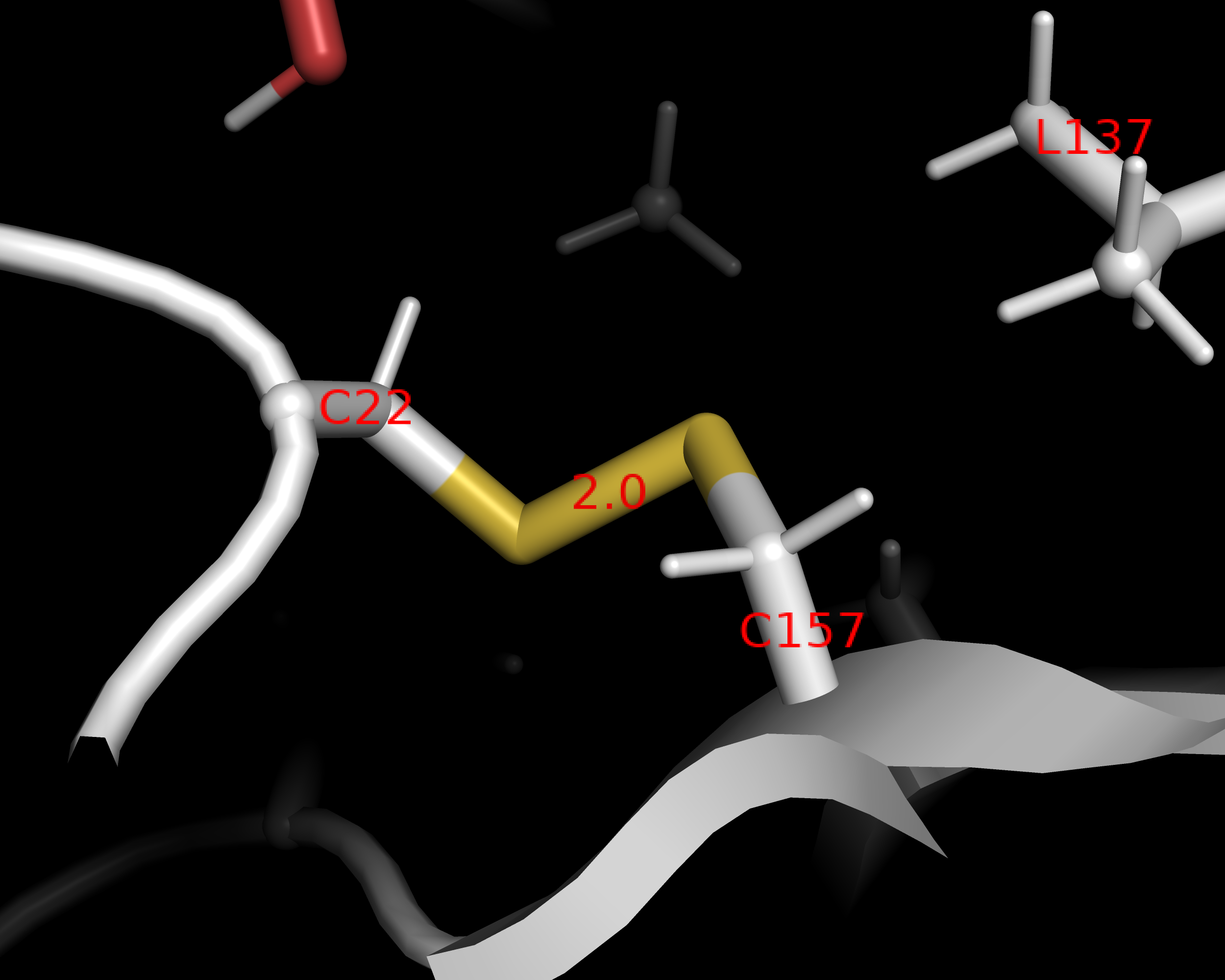
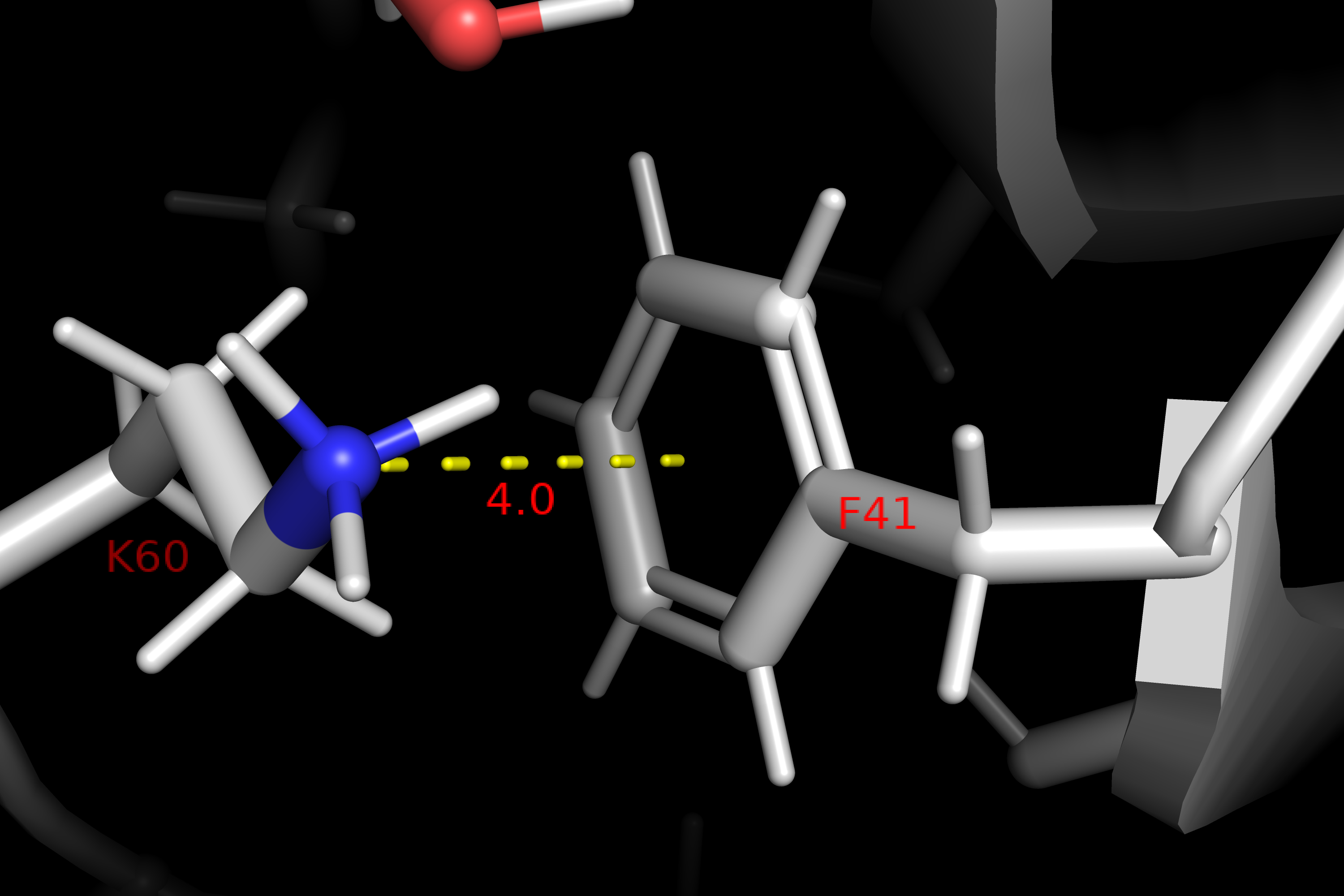
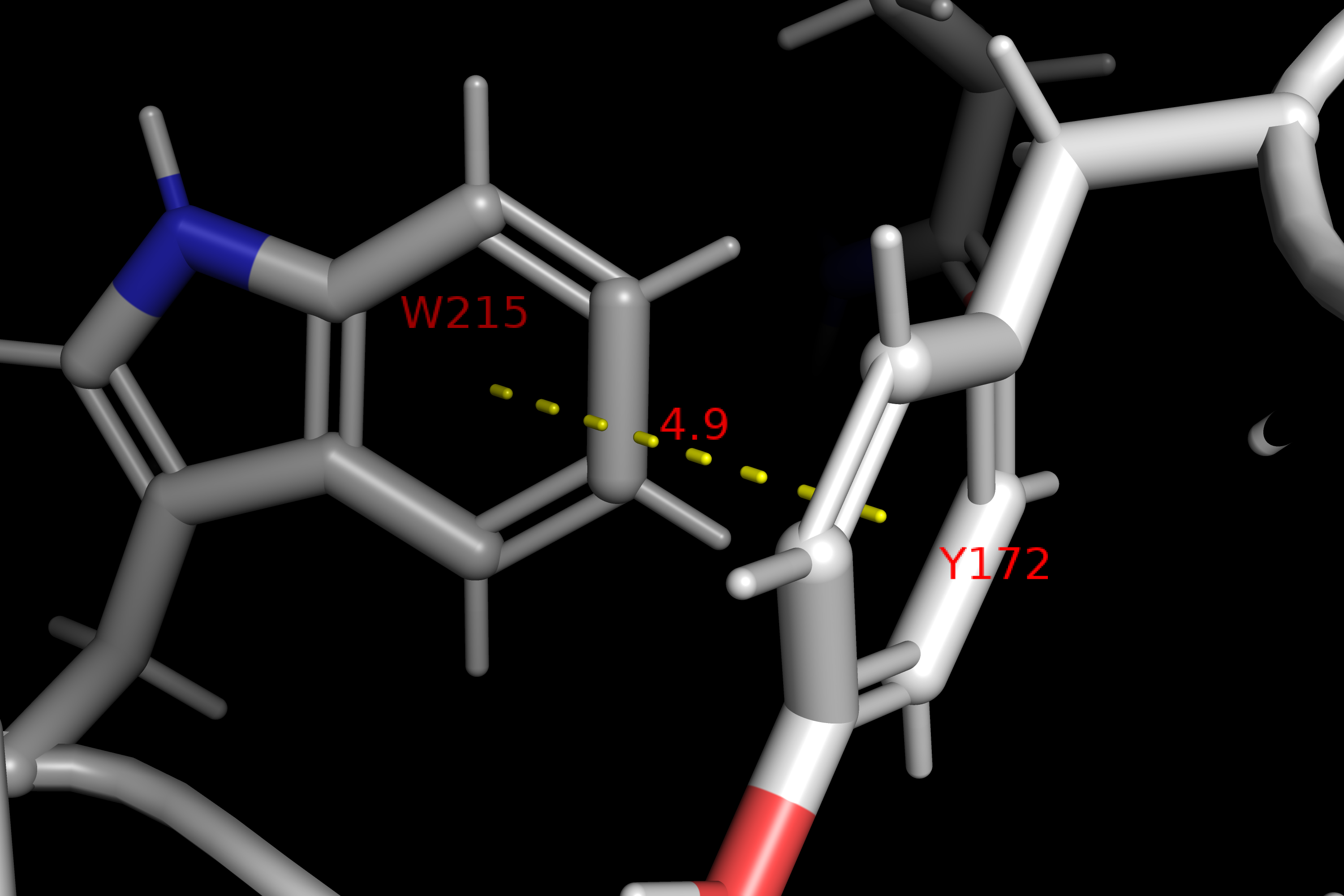
Ферментативная активность трипсина
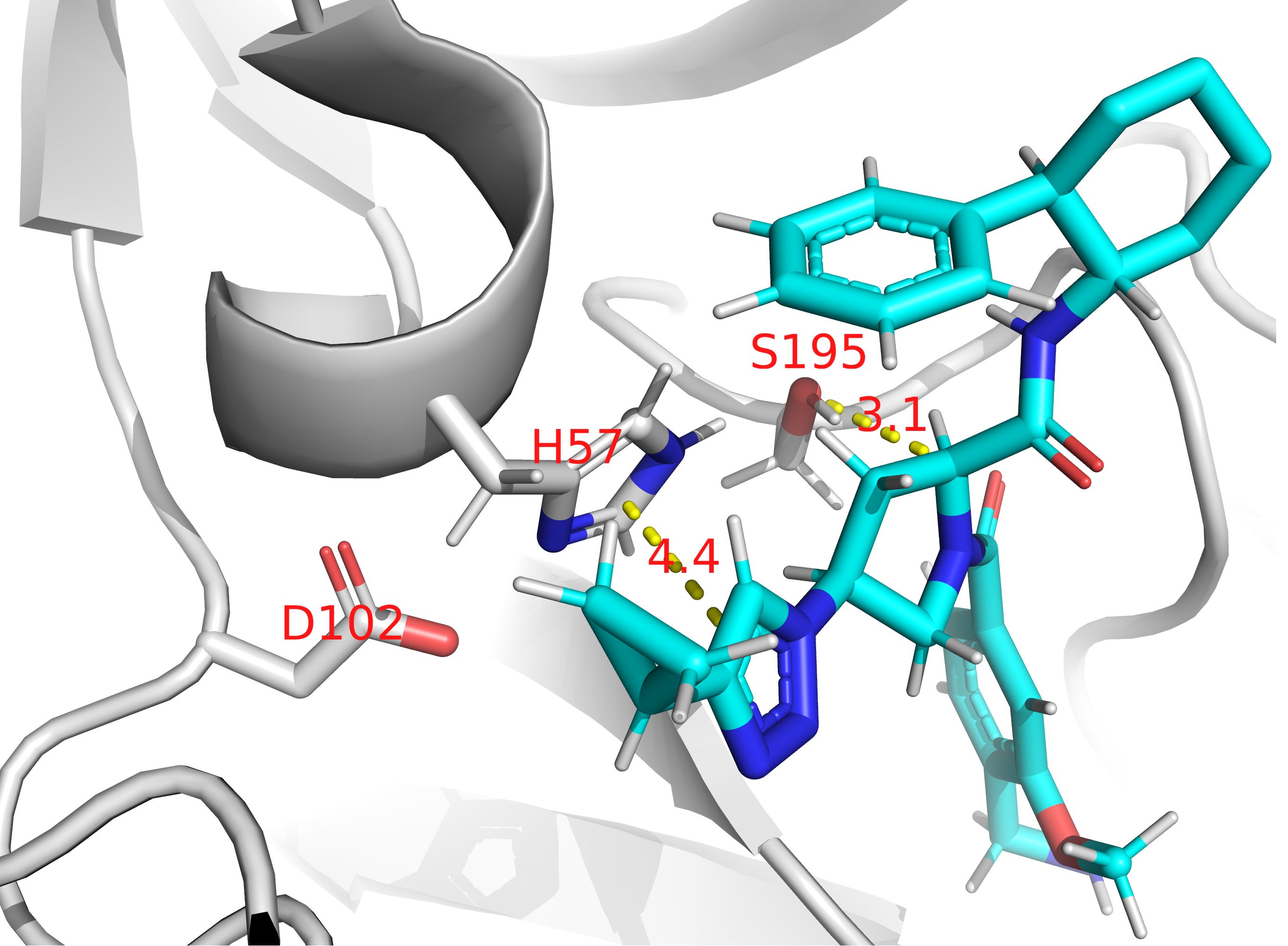
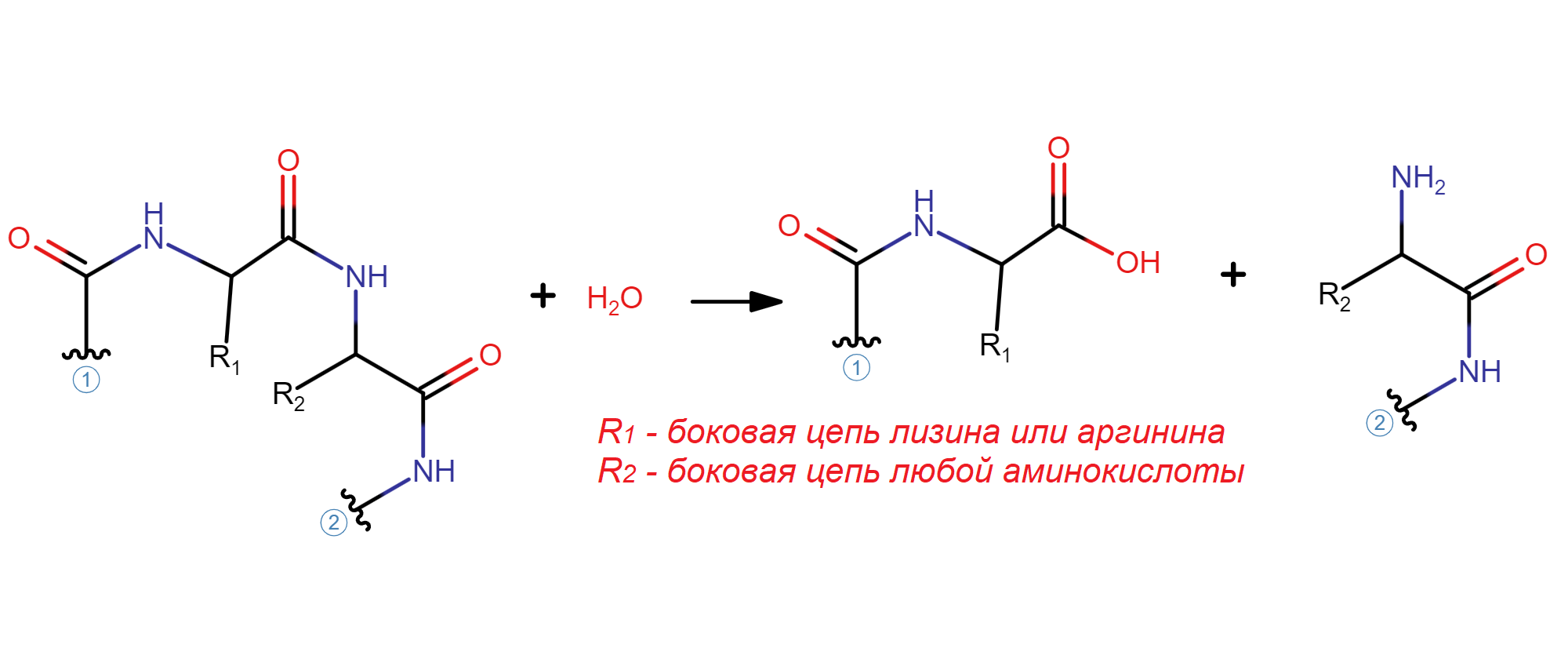
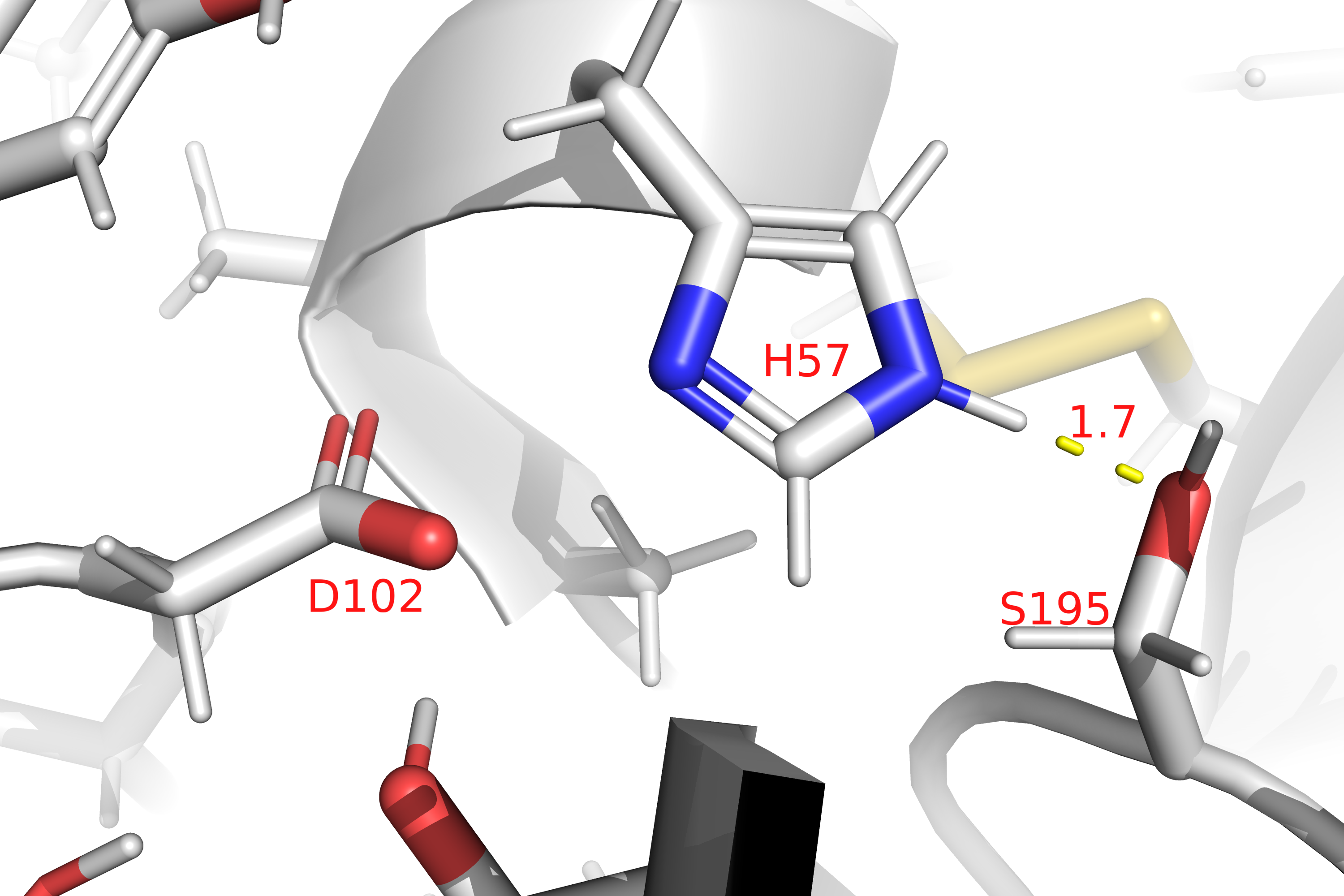
Фермент трипсин катализирует реакцию гидролиза полипептидных связей между остатком аргинина или лизина и любой другой аминокислоты.(EC 3.4.21.4) На Рис. 10 показано уравнение химической реакции, катализируемой трипсином. в состав каталитического центра фермента входят остатики(Рис. 11): гистидина(H57), аспартата(D102) и серина(S195). В пределах активного центра гистидин(H57) образует водородную связь с серином(S195).
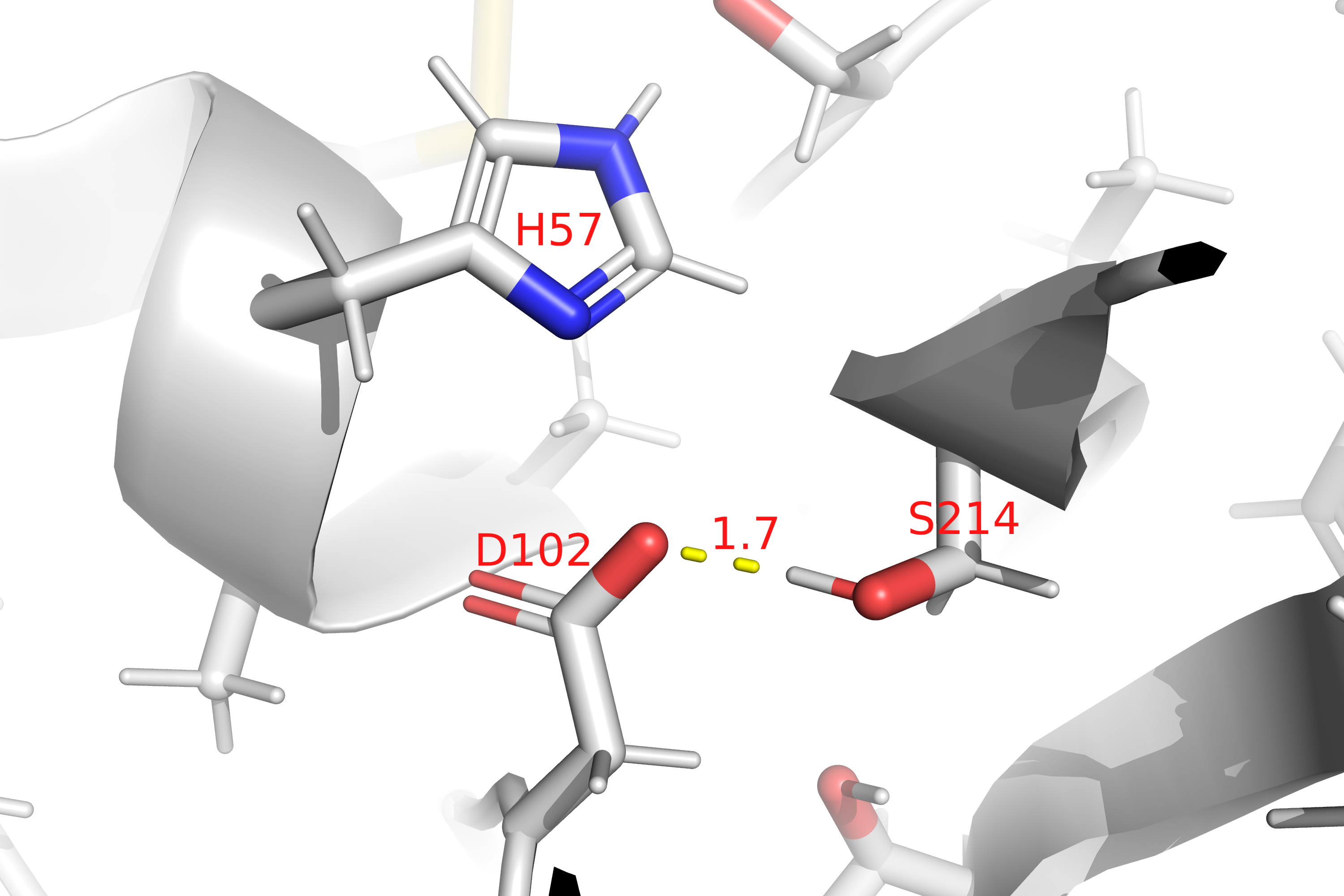
Кроме того, остаток аспартата(D102) образует водородную связь с серином(S214), находящемся в ближайшем окружении активного центра трипсина(Рис. 11).
Ингибитор трипсина 6WH связывается с ферментом за счет пи-пи стекинга и водородных связей, так что он находится на расстоянии 4.4 ангстрема от остатка гистидина(H57) и 3.3 ангстрема от остатка серина(S195) активного центра( Рис. 12 ). Объемные группы ингибитора закрывают подходы к каталитическому центру фермента, тем самым препятствуя связи фермента с субстратом.