Практикум 2. Атлас контактов
Атлас контактов белка пируватдегидрогеназа человека
Введение
Идентификатор белка (PDB ID): 1NI4Название на английском языке: Human pyruvate dehydrogenase Молекулярная масса: 159.4 КДа
Общая информация
Пируват дегидрогенадаза — фермент, состоящий из двух субъединиц: альфа и бета, включающих в себя цепочки A, C и B, D соответственно. Uniprot ID альфа-субъединцы: P08559, бета-субъединицы: P11177.
Пируват дегидрогеназа — первый из трех ферментов ПДК (пируватдегидрогеназого комплекса), осуществляющего окислительное декарбоксилирование пирувата, которое заключается в отщеплении от реагента одной молекулы углекислого газа и присоединении к декарбоксилированному пирувату кофермента А (КоА) с образованием ацетил-КоА. Этот процесс является промежуточным этапом между гликолизом и циклом Кребса, таким образом он необходим для осуществления клеточного дыхания – заключительно процесса энергетического обмена. Однако известны мутантные аллели этого гена в 11-й и в Х-хромосомах, приводящие к пируватдегидрогеназной недостаточности, которая может стать причиной серьезный пороков развития. Из-за того, что ПДК не может осуществлять переход пирувата в ацетил-кофермент А, молочная кислота, или лактат, в свою очередь, не может перейти в пируват, что является своего рода барьером для осуществления дальнейшей бескислородной и кислородной диссимиляции.
Также фермент играет роль протектора некоторых патогенных спирохет от воздействия пероксида водорода.
Описание лигандов
|
|
||||||||||||||||
|

|
||||||||||||||||
|
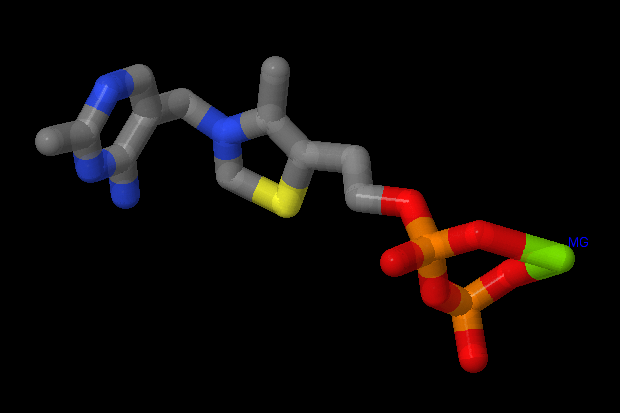
|
|||||||||||||||||||
Информация о лиганд-биомолекулярных контактах
В работе описаны 3 вида связей лиганда тиаминпирофосфата с белком, которые демонстрируют основные типы взаимодействия лигнада с белковым комплексом. Все описанные связи проиллюстрированы скриншотами из JMol. Открыв соответсвующий вид апплета с лигандами ↑, можно рассмотреть описанные связи подробнее.
| Ионное взаимодействие. Ионные связи между тиаминпирофосфатом, магнием ([MG]1331) и аминокислотами [ASN]196, [ASP]167 обеспечивают связывание лиганда с белком через образование комплекса с низкомолекулярным лигандом магнием. |
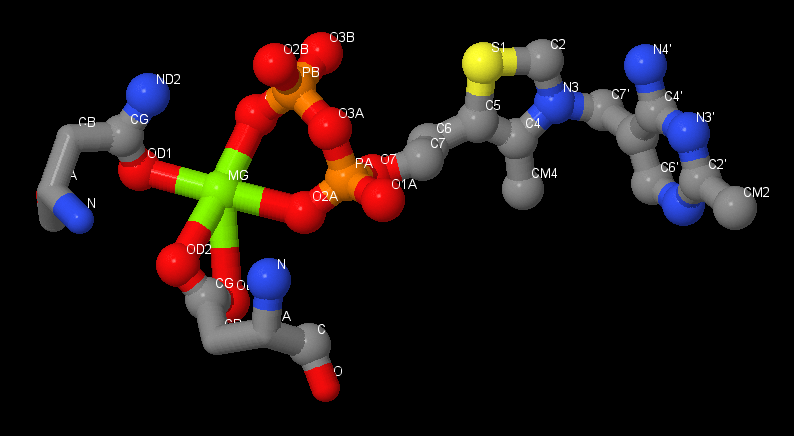 |
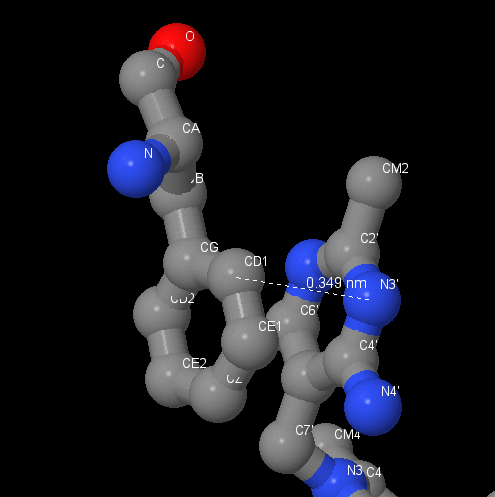 |
Стэкинг взаимодействие. Лиганд вступает в стэкинг взаимодействие с бензольным кольцом остатка аминокислоты [PHE]85:B. Это подтверждается тем, что ароматические кольца расположены параллельно друг другу на расстоянии 3.5Å, что удовлетворяет теоретическому расстоянию для образования пи-сопряжения. |
| Ионные пары. Лиганд образует ионную пару с аргинином ([ARG]90). Вывод об этом сделан на основании анализа расстояния между азотами остатка аминокислоты и ближайшими кислородами лиганда. Оно составляет в среднем 3.1Å, что соответствует оптимальному расстоянию для образования ионной пары. |
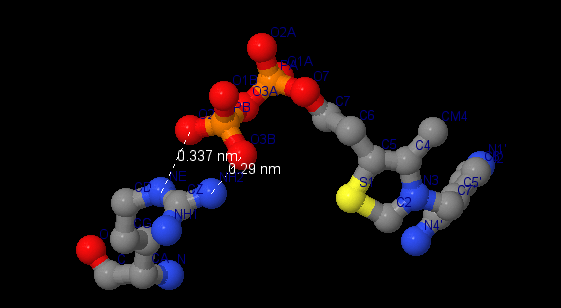 |
Информация о белок-белковых контактах
В ходе работы были рассмотрены различные взаимодействия внутри молекулы белка. Все описанные связи и взаимодейстия можно наблюдать в апплете, открыв соответствующий вид.
Водородные связи
Как и в остальных белках, водородные связи играют ключевую роль в поддержании пространственной структуры белка и широко распространены внутри отдельных цепей биомолекулы. Поэтому в работе описаны те водородные связи, которые встречаются между аминокислотными остатками разных белковых цепей.
- Взаимодействие между кислородом в [ARG]349:A и азотом в [ASP]299:D обеспечивают связь между цепями A и D соответственно.
- Взаимодействие между кислородом в [ALA]122:B и азотом в [GLY]60:C обеспечивают связь между цепями B и C соответственно.
Ионные пары
Ионные пары также влияют на поддержание пространственной структуры белка. Такая форма взаимодействия наблюдается у разноимённо заряженных аминокислот, находящихся заряженными концами на теоретическом расстоянии 3.5Å друг от друга с возможными отклонениями в пределах 1Å. Для поиска таких контактов выделялись разными цветами положительно и отрицательно заряженные аминокислоты. Затем визуально оценивали возможность образования ионной парой с дальнейшей проверкой с помощью измерения расстояния и сравнения его с теоретическим. В работе рассмотрены ионные пары, образованные аминокислотными остатками только различных цепей.
- Взаимодействие между остатками [ARG]294:D (+) и [GLU]274:B (-) обеспечивают связь между цепями D и B соответственно. Среднее расстояние между кислородом и азотом - 3.17Å.
- Взаимодействие между остатками [ARG]242:D (+) и [ASP]299:B (-) обеспечивают связь между цепями D и B соответственно. Среднее расстояние между кислородом и азотом - 3.7Å. Lys143:D,
- Аминокислотные остатки [LYS]242:D (+) и [ASP]163:B (-) c [ASP]343:D (-), предположительно, образуют ионную тройку. Расстояние между азотом лизина и кислородами аспарагиновых кислот равно 2.63Å и 2.47Å соответственно для каждого остатка.
Гидрофобное ядро
Гидрофобные ядра белка были обнаружены с помощью скрипта. Было выбрано ядро, состоящее из 325 аминокислотных остатков. В скрипте можно последовательно проследить окружение гидрофобного ядра атомами белка. На расстоянии 1Å атомы белка не были обнаружены. На расстоянии в 5Å можно утверждать, что гидрофобное ядро достаточно скрыто белком, поскольку при дальнейшем отдалении атомы наслаиваются друг на друга, но гидрофобное ядро остаётся примерно таким же заметным, как и при 5Å.
Ближайшие атомы, не связанные ковалентно, находятся на расстоянии в среднем 5Å друг от друга. Поэтому теоретически между ними может поместиться атом кислорода (молекула воды). Встречаются также атомы на большем отдалении друг от друга, например, на расстоянии 8Å.
Личный вклад членов команды
Власов Антон занимался размещением информации на веб-странице с атласом контактов, вёрсткой и дизайном сайта. Им были описаны взаимодействия лиганда тиаминпирофосфата с белком и скрипты для иллюстрации даннных связей. Также им были написаны некоторые скрипты для отображения описанных другими членами командами связей.
Игумнов Даниил занимался поиском и анализом литературных источников, составлением общей информации о белке. Им были описаны ионные взаимодействия между цепями, а также написаны скрипты для их отображения.
Иззи Антон осуществил выбор белка для составления атласа его контактов. Им были написаны основные части скриптов для отображения гидрофобного ядра, водородных связей между цепями, а также окружения лигандов. Он описал гидрофобное взаимодействие в белке, а также водородные связи между цепями.
Все участники ознакомились с финальной версией статьи и одобряют её. Авторы заявляют об отсутствии конфликта интересов.
Ссылки на исользованную литературу:
- Zhilwan Rahim Pyruvate Dehydrogenase Complex Deficiency (PDCD). // Undergraduate Research Journal for the Human Sciences. — 2011. — Vol. 10.
- Troxell, Bryan et al. “Pyruvate Protects Pathogenic Spirochetes from H2O2 Killing.” Ed. Ronald Mark Wooten. PLoS ONE 9.1 (2014): e84625. PMC. Web. 5 Mar. 2018.
- G K Brown; L J Otero; M LeGris; R M Brown (November 1994). "Pyruvate dehydrogenase deficiency" J Med Genet , PMID 7853374
- Genetics Home Reference: Pyruvate dehydrogenase deficiency [Электронный ресурс]//URL: https://ghr.nlm.nih.gov/condition/pyruvate-dehydrogenase-deficiency#genes, dated from March, 3 2018
- Pyruvate Dehydrogenase Complex Deficiency Workup: Laboratory Studies, Imaging Studies, Histologic Findings [Электронный ресурс]//URL: https://emedicine.medscape.com/article/948360-workup#showall, dated from February, 5 2018
