Практикум 2. Альтернативные положения, B-фактор, кристалл
Задание 1. Альтернативные положения
Целью данного задания являлось сравнение альтернативных положений триптофанов 42 и 75 из структуры эндотиапепсина в комплексе с пирролидиновым ингибитором S47 (PDB ID 3Q6Y). Общий вид рассматриваемых вариаций представлен на рисунке 1.
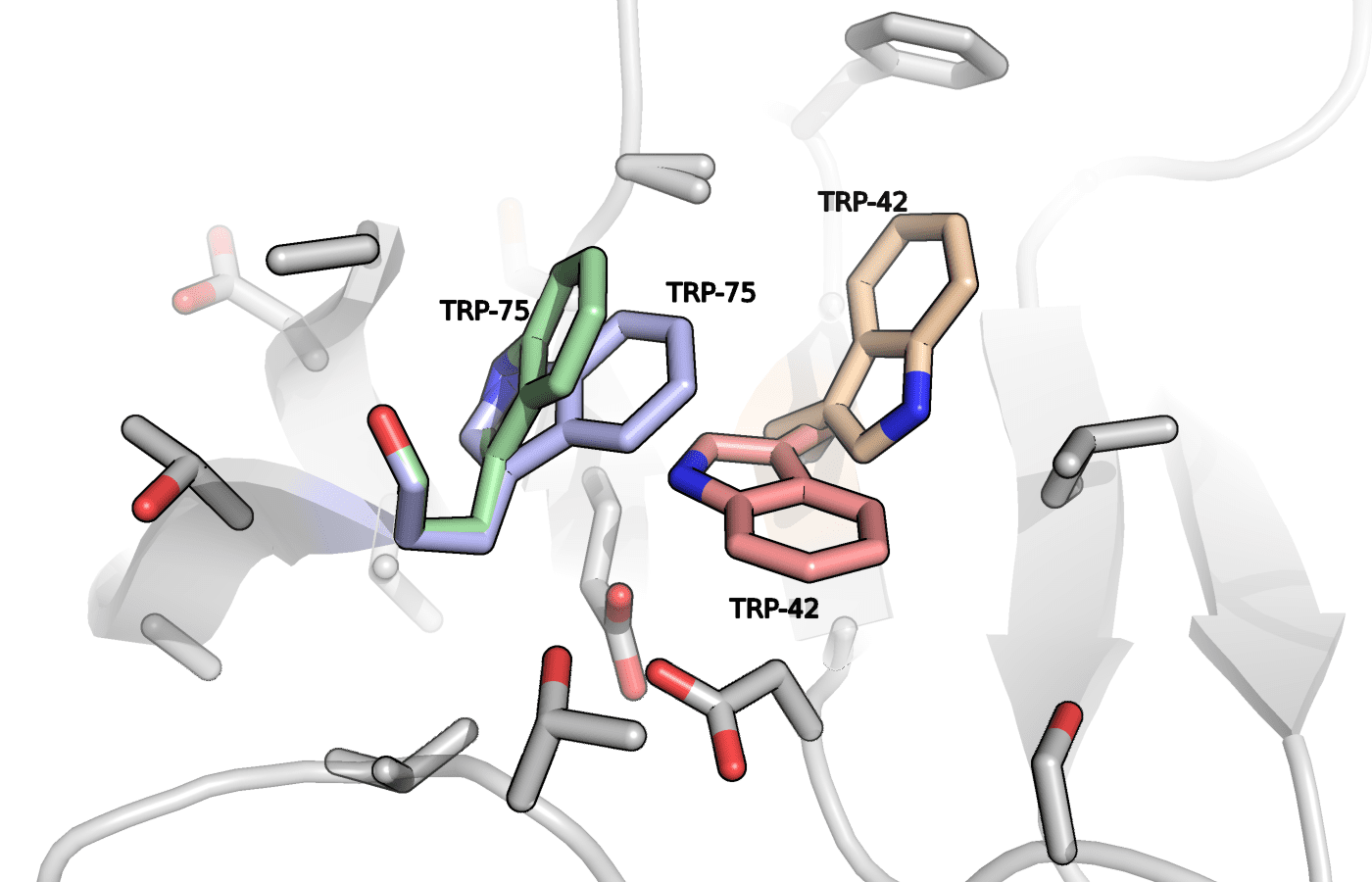
Рисунок 1. Триптофаны 42 и 75 в альтернативных положениях. Альтернативные положения А для остатков 42 и 75 показаны золотистым и светло-фиолетовым, соответственно. Положения B для 42 и 75 показаны розовым и зеленым. Данная цветовая схема сохраняется далее.
Ниже представлен фрагмент записи в файле PDB о данных альтернативных положениях.
... ATOM 295 N ATRP A 42 3.802 -3.409 18.859 0.65 9.60 N ATOM 296 N BTRP A 42 3.809 -3.403 18.804 0.35 9.69 N ATOM 297 CA ATRP A 42 2.711 -3.601 19.798 0.65 11.93 C ATOM 298 CA BTRP A 42 2.577 -3.477 19.592 0.35 11.92 C ATOM 299 C ATRP A 42 1.777 -4.698 19.342 0.65 9.97 C ... ATOM 498 N ATRP A 75 3.267 2.805 26.842 0.65 19.03 N ATOM 499 N BTRP A 75 3.252 2.808 26.852 0.35 18.99 N ATOM 500 CA ATRP A 75 3.276 3.387 25.511 0.65 18.34 C ATOM 501 CA BTRP A 75 3.248 3.331 25.494 0.35 18.34 C ATOM 502 C ATRP A 75 1.954 4.083 25.254 0.65 22.54 C ...
Всего возможно 4 комбинации из данных альтернативных положений. Выделенный жирным столбик показывает долю конформаций белка с указанным альтернативным положением остатка среди всех структур. Четкое разделение на 65:35 для обоих триптофанов наводит на мысль, что положения A и B в кристалле существуют попарно, так как случайное совпадение двух чисел от 0 до 100 кажется маловероятным. Попробуем разобраться, с чем это может быть связано. Рассмотрим рисунок 2, на котором представлены триптофаны в положении A.
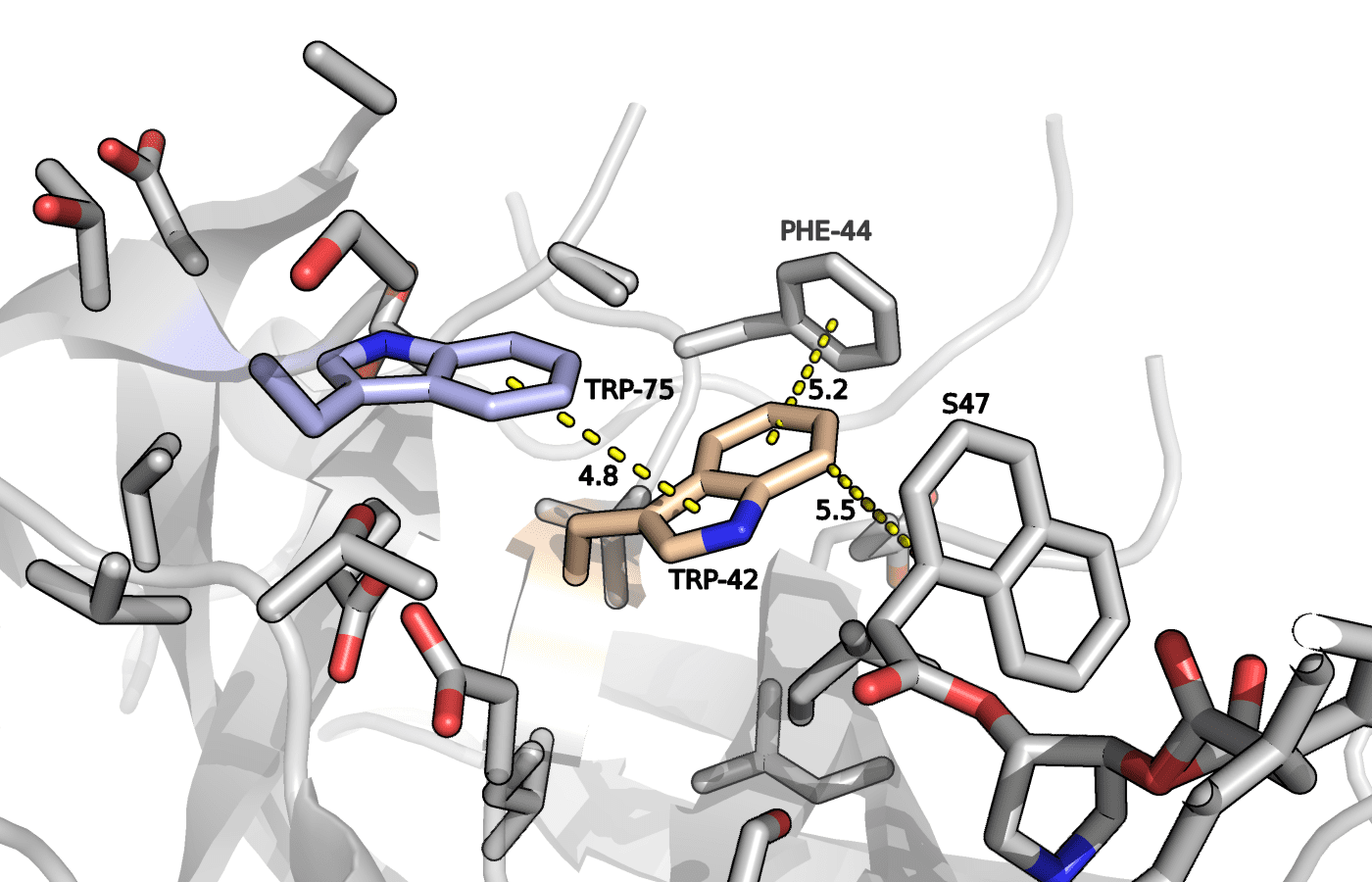
Рисунок 2. Триптофаны 42 и 75 в положении A. Показаны расстояния возможных стэкинг взаимодействий.
В пользу стабильности такого расположения триптофановых остатков свидетельствует T-стэкинг индольного кольца TRP-42 с бензилом PHE-44, а также с нафталиновой группой ингибитора S47. Также наблюдается параллельно сдвинутый стэкинг с остатком TRP-75.
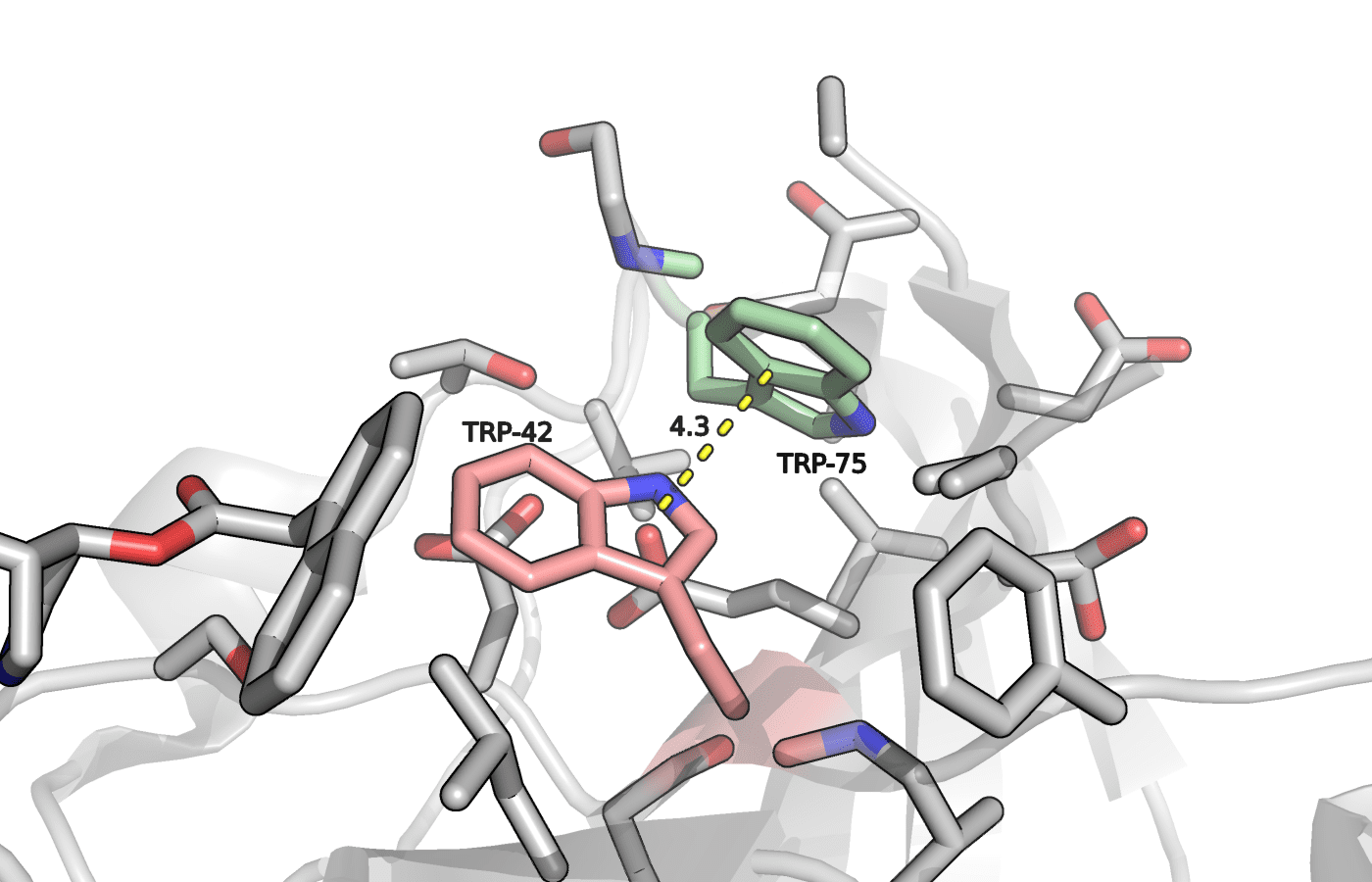
Рисунок 3. Триптофаны 42 и 75 в положении B. Показано расстояние возможного стэкинг взаимодействия.
В таком положении остатков не удалось найти каких-либо дополнительны стабилизирующих структуру факторов, кроме возможного параллельно сдвинутого стэкинг взаимодействия остатков друг с другом.
На рисунке 4 представлены рассматриваемые остатки, выровненные со структурой этого же фермента без ингибитора (5RCQ).
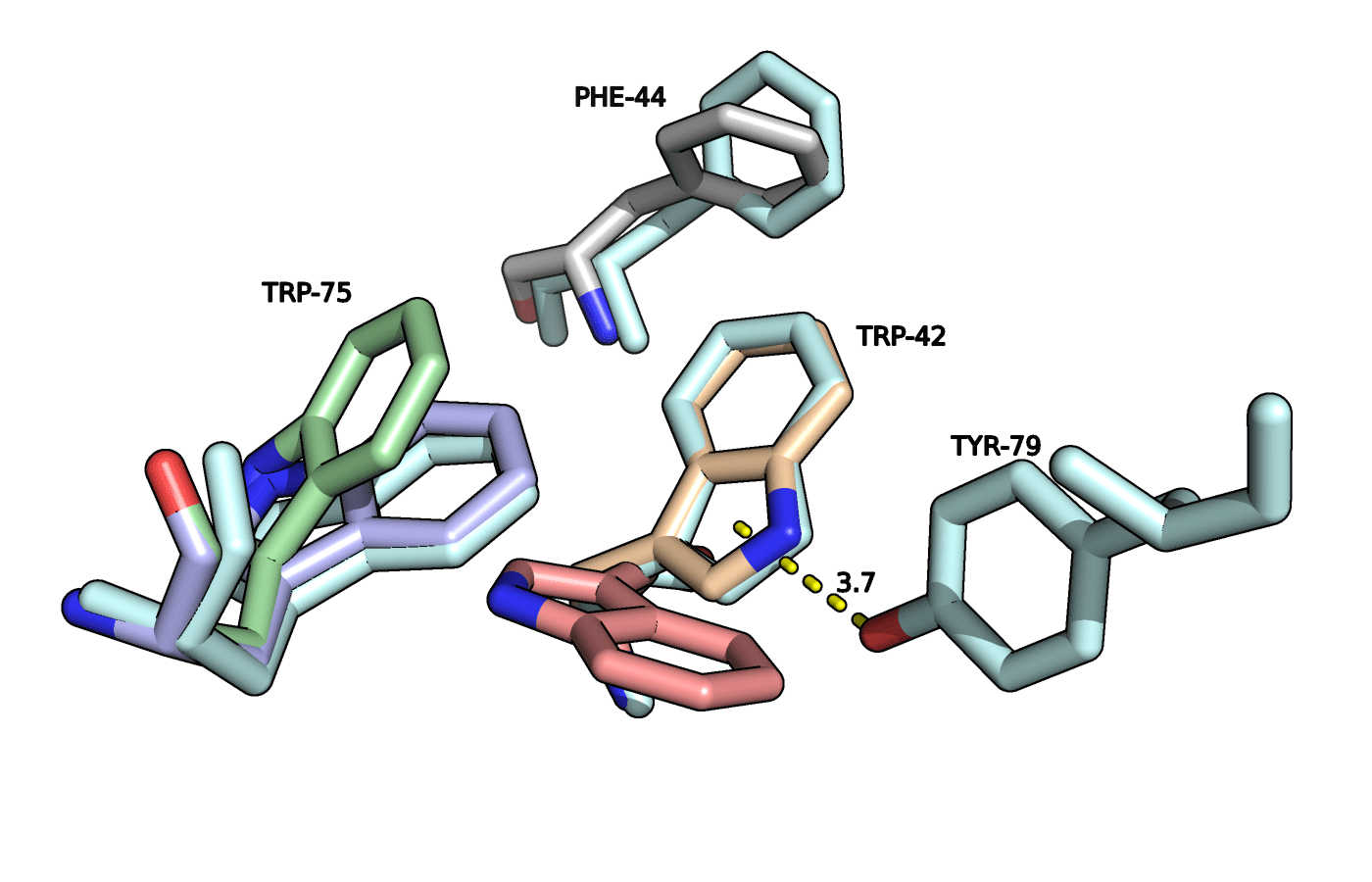
Рисунок 4. Триптофаны 42 и 75 из структур 5RCQ (показаны голубым) и 3Q6Y.
В структуре свободного фермента оба триптофана находятся в положении A. Дополнительно можно заметить что в оригинальной структуре TRP-42 образует водородную связь с TYR-79 вместо стэкинга с лигандом, а стэкинг с PHE-44 больше похож на параллельно сдвинутый. Возникает вопрос, что происходит с TYR-79 в присутствии лиганда? Оказалось, что аминокислоты 77-85 отсутствуют в рассматриваемой структуре с ингибитором.
Таким образом, конформация A, которая имеет большую представленность в кристалле, присутствует также в единственном варианте в структуре свободного фермента и стабилизирована стэкингом. Пара альтернативных положений B выглядит менее устойчивой, мне не удалось обосновать её присутствие в кристалле. Кажется, что конформация B выглядит стабилизированной не лучше, чем попарные A и B (про которые в самом начале указано, что если бы такие были, то соотношение 65:35 вряд ли бы сохранялась для обоих альтлоков), однако препятствий для таких конформаций также найдено не было. Вероятно, в растворе они могут находиться во всех представленных конформациях, однако при кристаллизации могут действовать геометрические факторы стэкинга, которые приводят к появлению только 2 конформаций, а не четырёх.
Задание 2. B-фактор
Остов структуры эндотиапепсина 3Q6Y был покрашен по B-фактору цветовой гаммой rainbow, так как она более наглядная, чем blue_white_red, которая в основном хорошо показывает только наиболее и наименее подвижные участки. Результат представлен на рисунке 5.
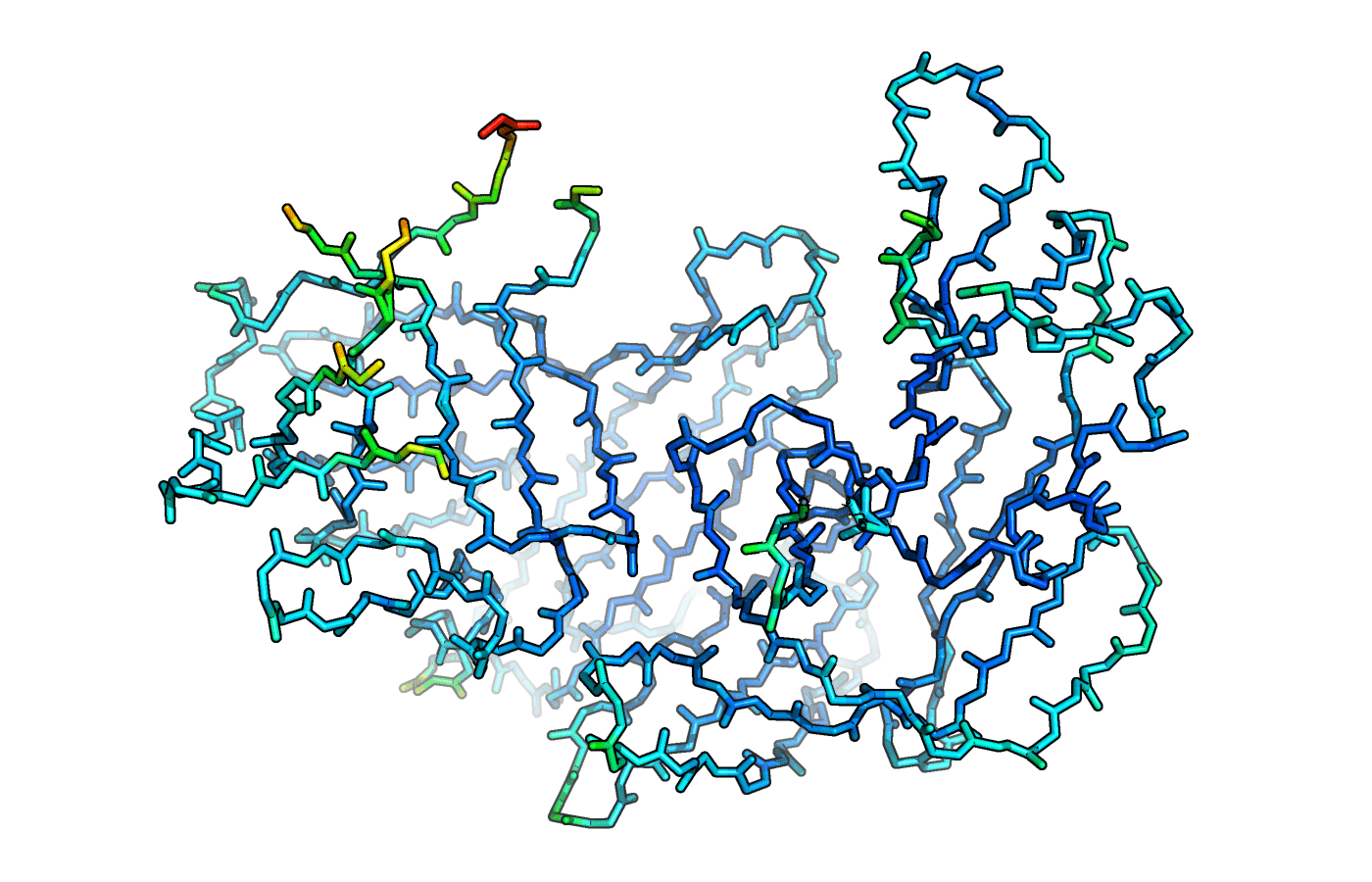
Рисунок 5. Остов 3Q6Y, покрашенный по B-фактору.
B-фактор показывает температуро-зависимые атомные вибрации или же статический беспорядок в кристалле, другими словами является мерой локальной подвижности макромолекулы. Визуально более подвижные атомы показаны более тёплыми цветами, чем менее подвижные. Видно, что наиболее холодными цветами показаны альфа-спирали и бета-листы. Ожидаемо, что петли оказались более подвижными. В целом по краям белка атомы более подвижны, чем в жёстком центре. Наиболее подвижными оказались участки белка на месте разрывов цепи. На рисунке 6 представлена схема, на которой указаны пропущенные в структуре фрагменты, а на рисунке 7 наложены пропущенные участки из структуры 5RCQ.

Рисунок 6. Схема покрытия последовательности белка структурой. Серыми прямоугольниками показаны участки, которые не смоделированы в структуре.
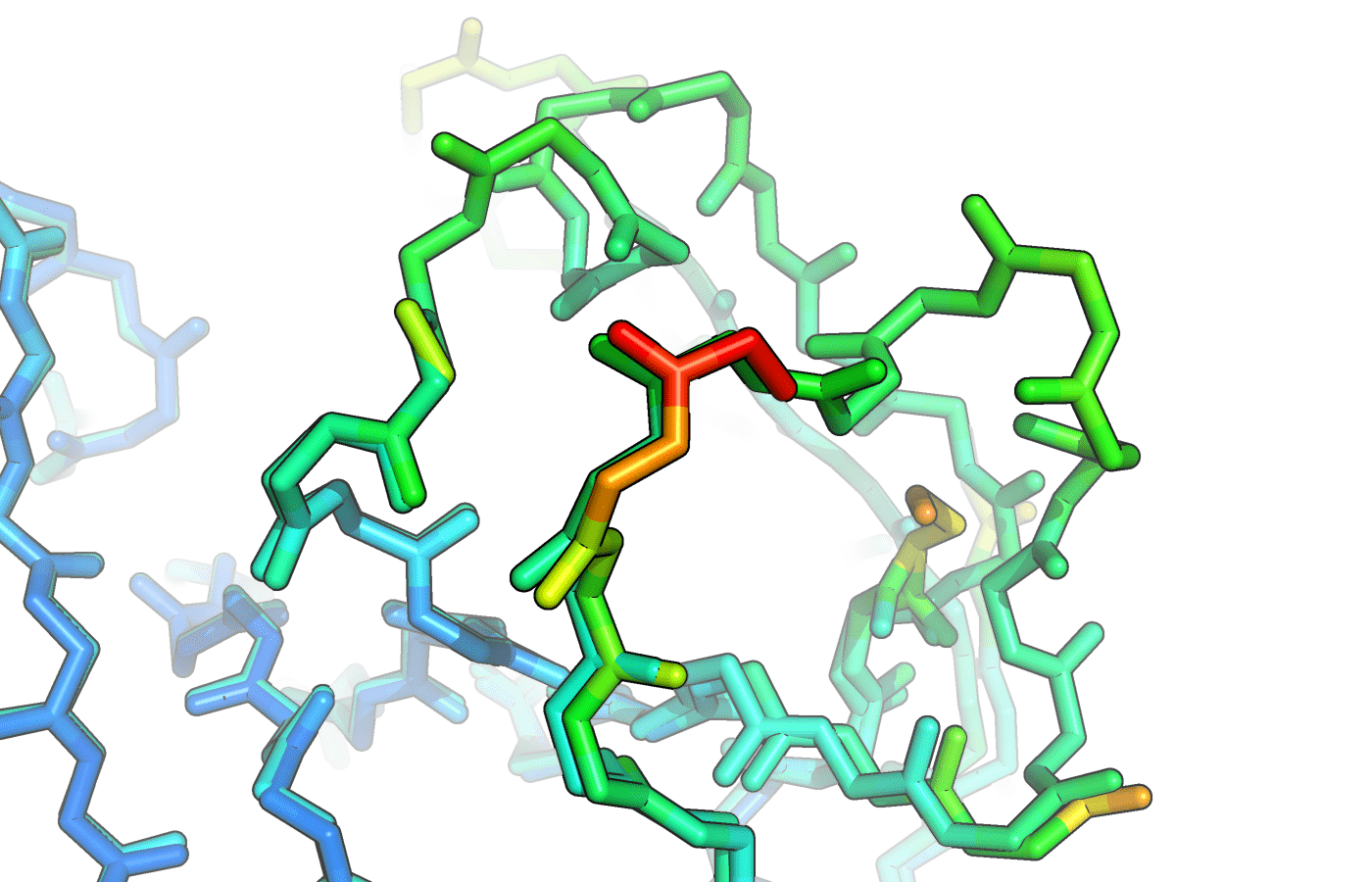
Рисунок 7. Фрагмент наложения структур 3Q6Y и 5RCQ. После подвижных остовов следуют пропущенные петли.
Видно, что в структуре без лиганда данные петли не пропущены, при этом остовы петель менее подвижны. Мне не удалось найти объяснение тому, почему в структуре с лигандом некоторые участки оказались более подвижными и пропущенными.
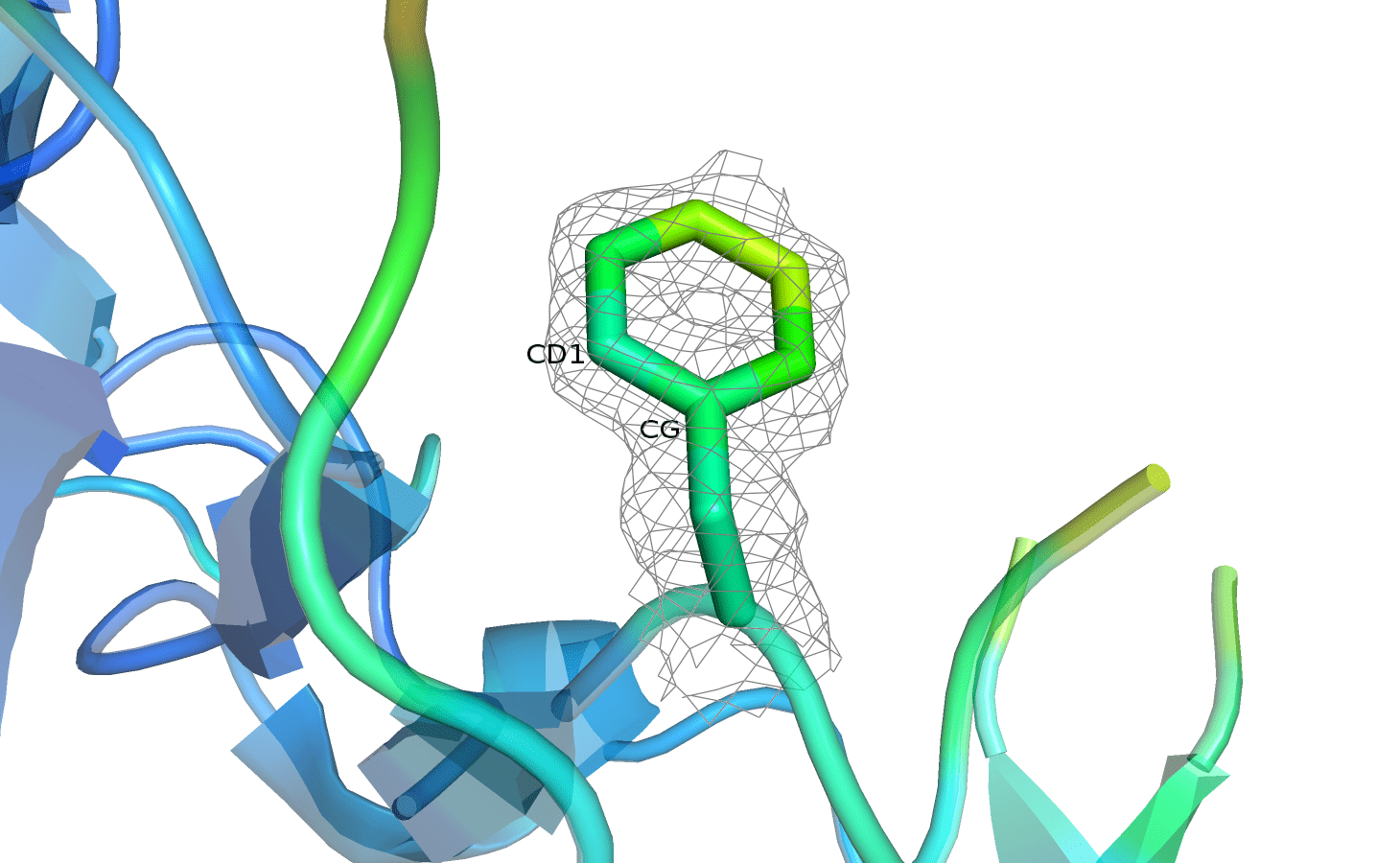
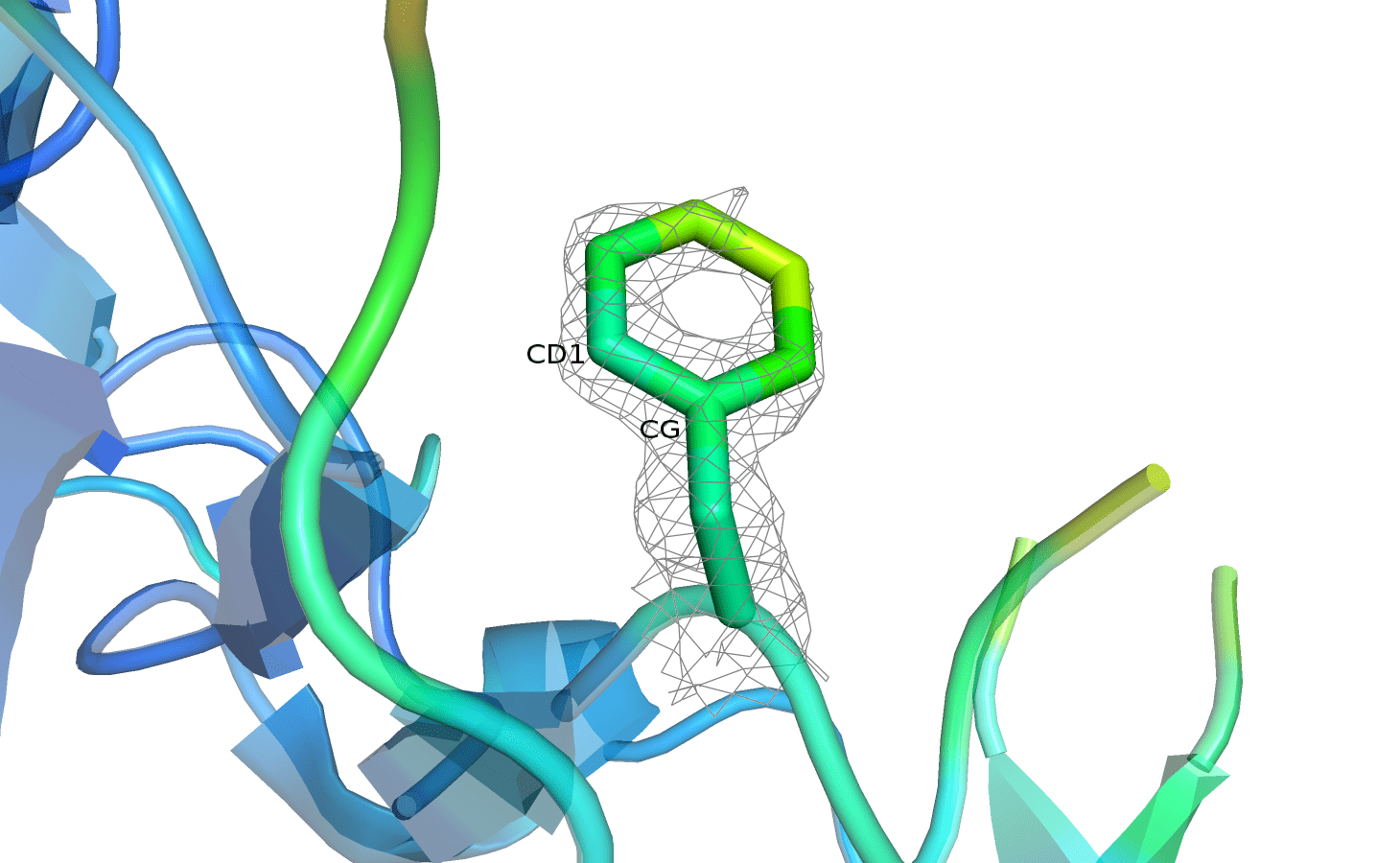
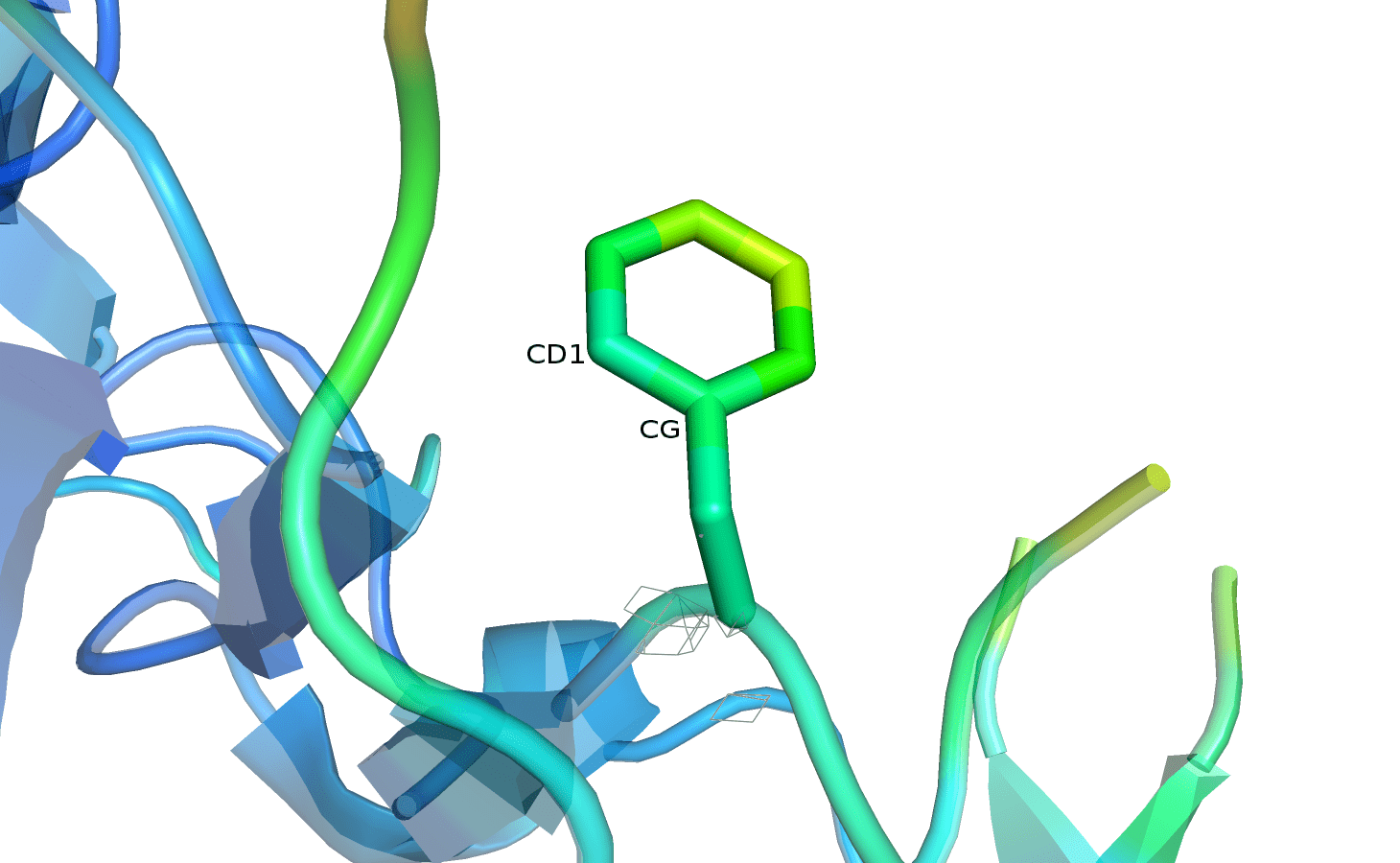
На рисунке 8 представлены изображения PHE-44, покрашенного по B-фактору. Уровень подрезки электронной плотности можно переключать кнопками, параметр отсечения составляет 1,5.
Рисунок 8. PHE-44 с электронной плотностью, carve=1.5.
Можно заметить, что цвет остатка становится более холодным к остову. При этом полностью покрытым ЭП фенилаланин оказался только на уровне подрезки 0,5. Затем поверхность плотности продолжает исчезать, и на уровне 3 практически не видна. Изменение покрытия атомов электронной плотностью согласуется с величиной B-фактора: плотность на более подвижных подвижных атомах исчезает раньше. Показалось немного странным, что фенилаланин не очень точно покрыт плотностью, так как в практикуме 1 ароматические остатки, наоборот, долго сохраняли поверхность плотности при увеличении уровня подрезки. Вероятно, данный остаток недостаточно стабилизирован в структуре белка. Если учесть, что атомы в бензольном кольце обычно жёстко расположены по отношению друг к другу, то логично предположить, что подвижность остатка достигается за счёт единовременного движения всего кольца. Судя по характеру исчезновения ЭП и окраске по B-фактору, можно полагать, что плоскость кольца вращается вокруг связи CD1-CG.
Задание 3. Соседи
По структуре 3Q6Y были построены контактирующие с ней соседи в кристалле на расстоянии 6 ангстрем. Результат генерации представлен на рисунке 9.
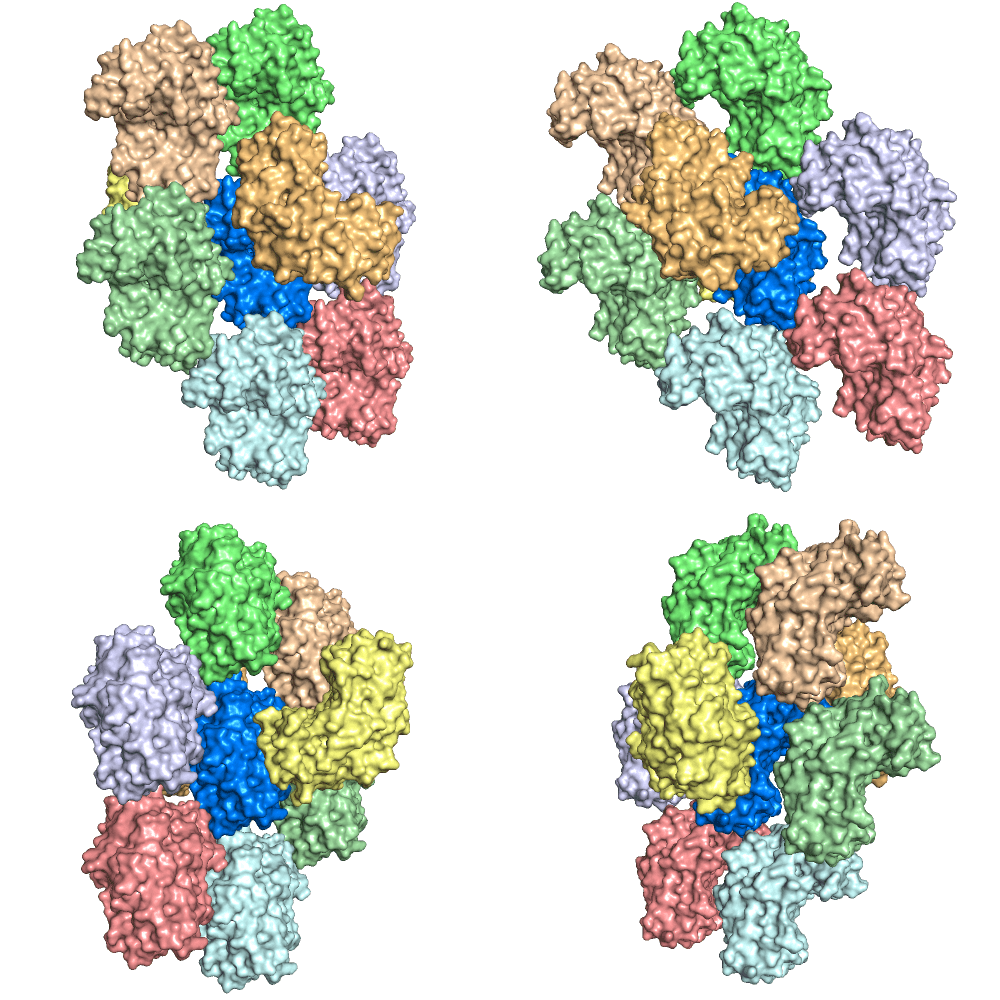
Рисунок 9. 3Q6Y (покрашена синим, в центре) и её соседи в кристалле под разными углами обзора.
Молекула соприкасается со всеми 8 молекулами, которые представлены в коллаже.