Практикум 4. Prody-2. ЯМР vs РСА
Задание 1. Общее сравнение РСА и ЯМР
Целью данного задания было сравнение структур трансмембранного домена белка A внешней мембраны E.coli, полученных с помощью ЯМР (PDB ID: 1G90) и РСА (1BXW) на макро- и микроуровнях. Разрешение РСА структуры составило 2,5 Å. Число посчитанных моделей ЯМР - 10, все они приложены авторами. На рисунке 1 представлен общий вид перечисленных моделей.
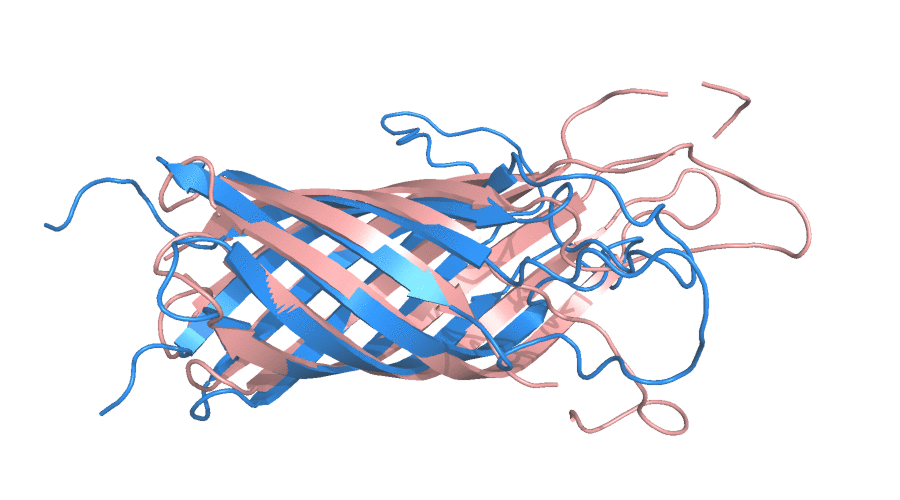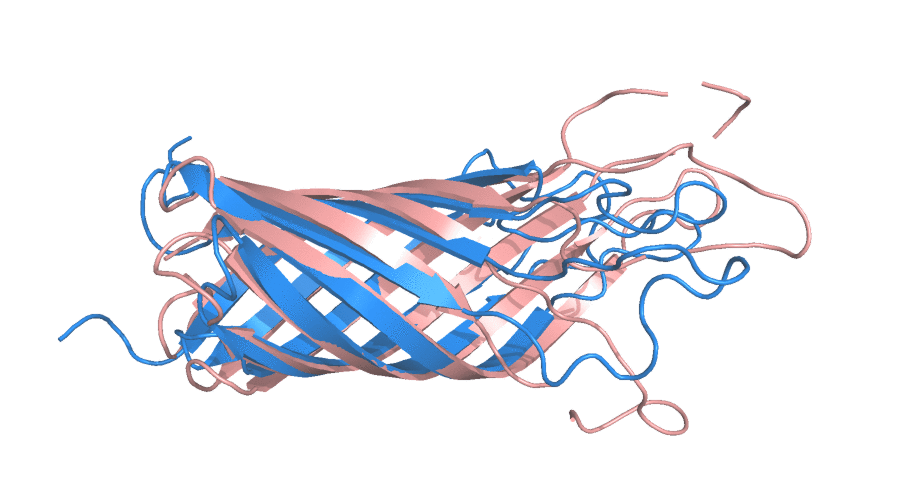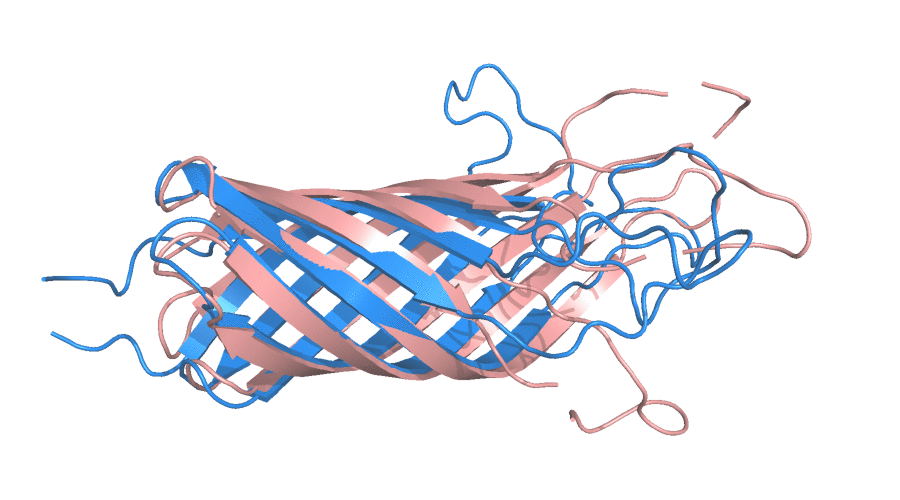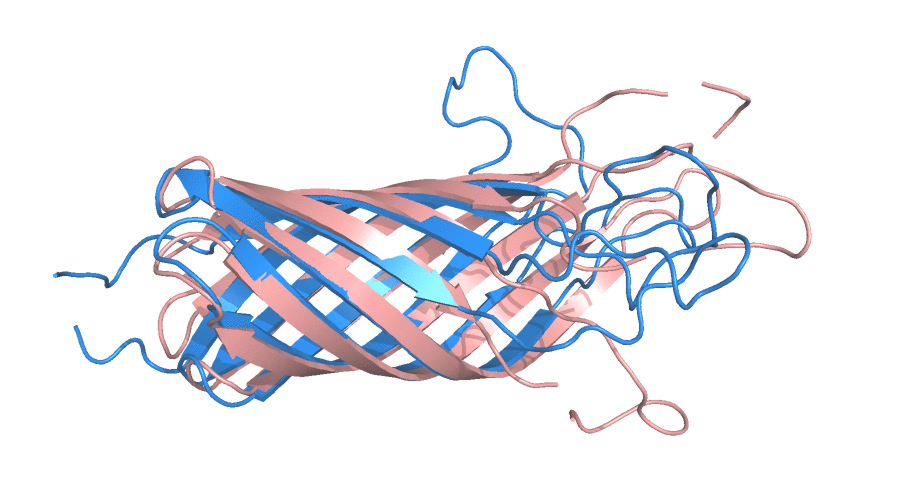
Рисунок 1. Сравнение структур трансмембранного домена белка A, полученных с помощью ЯМР (синий, состояния анимированы) и РСА (розовый).
Как можно заметить, домен состоит исключительно из β-листов и петель. Петли из ЯМР практически не совпадают с петлями, полученными с помощью РСА, β-листы накладываются лучше друг на друга, хотя и там видны небольшие несоответствия. Видно, что ЯМР структуры не обладают высокой сходимостью по петлям, что в данном случае логично связать с их подвижностью. Чтобы проверить это предположение сделал рисунок 2 с РСА-структурой, покрашенной по B-фактору, а также заодно продемонстрировал наличие молекул растворителя в РСА-модели (в ЯМР-модели, ввиду особенностей эксперимента, молекулы воды не видны).

Рисунок 2. РСА-модель, покрашенная по B-фактору. Сферами показаны атомы кислорода воды.
Судя по B-факторам, петли ожидаемо гораздо более подвижны, чем β-листы. Однако показалось двольно странным, что некоторые участки петель тёмно-синие, то есть малоподвижными. В файле PDB у всех атомов этих остатков B-фактор равен 20.00, что наводит на мысль, что они были просто "нарисованы", а не вписаны достоверно в экспериментальную электронную плотность. Также у РСА модели заметны разрывы петель на месте резких смен B-фактора. Более подробно один из разрывов представлен на рисунке 3.

Рисунок 3a. Lys-64 и Gly-65 образуют разрыв в цепи в РСА-модели.
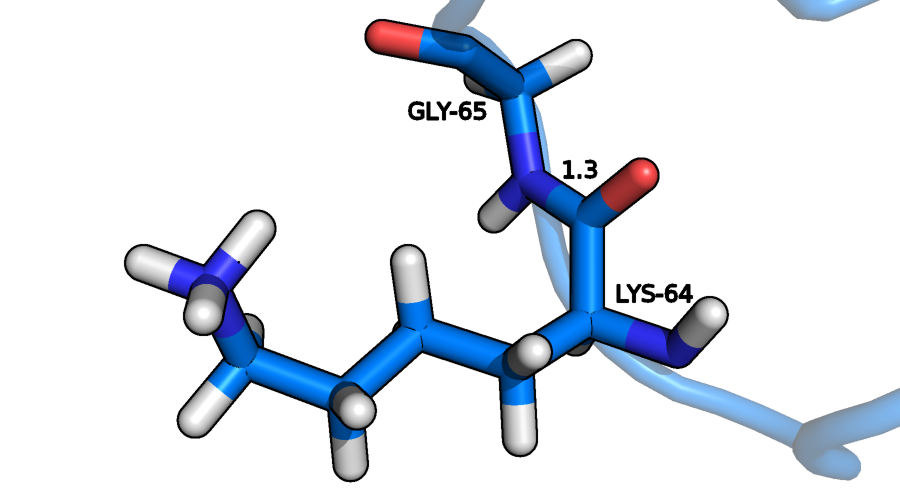
Рисунок 3b. Те же остатки в ЯМР-модели (состояние 10).
На рисунке 3a также отмечено расстояние между атомами, которые должны образовывать пептидную связь между остатками. Оно составляет 3,1 Å, что гораздо больше, чем расстояние в 1,33 Å, свойственное пептидной связи. В то же время на рисунке 3b никакого разрыва не наблюдается, длина связи стандартная, также видна "визитная карточка" ЯМР-структуры – наличие смоделированных водородов.
Из сравнения моделей можно утверждать, что оба метода посредственно справились с определением структуры петель: в ЯМР-эксперименте у них получилась слишком большая амплитуда движения, а в РСА – большой B-фактор, а также, скорее всего, искусственно добавленные в структуру участки петель. С порой из β-листов, на первый взгляд, оба метода справились довольно качественно, хотя и наблюдаются иногда сильные загибы листов в некоторых состояних ЯМР-модели.
Задание 2. RMSF и B-фактор
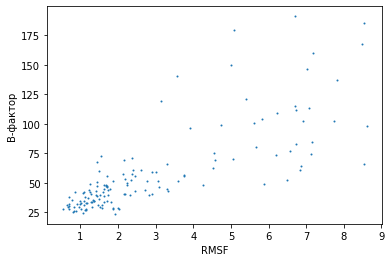
Рисунок 4. Зависимость среднего B-фактора остатка в РСА-модели от RMSF этого остатка в ЯМР-модели.
Для совпадающих остатков в ЯМР и РСА моделях были вычислены средние RMSF и B-факторы, соответственно. Дополнительно были убраны из рассмотрения остатки, средний B-фактор которых точно равен 20.00, так как правдоподобие такого B-фактора, как было рассмотрено в задании 1, сомнительно. Результат представлен на рисунке 4.
В целом, можно утверждать, что большим значениям RMSF соответствуют большие значения B-фактора. Коэффициенты корреляций Пирсона и Спирмена соответственно равны 0,78 и 0,82 (оба p-value меньше 10-30), что подтверждает наличие сильной корреляции между данными величинами. Однако также заметно, что разброс значений B-фактора от RMSF довольно высок по мере увеличения RMSF, что доказывает факт того, что RMSF является не только показателем подвижности элемента структуры, но и качетсва самой модели.
Открыть исходный код в новой вкладке.
Задание 3. Водородные связи
| Тип водородной связи | Остаток 1 | Остаток 2 | Расстояние в РСА (Å) | Число, процент ЯМР моделей со связью | Расстояние в ЯМР (Å) | ||
| Макс. | Мин. | Медиана | |||||
| Между атомами остова в β‑листе (рисунок 5а) | Ala-39 (N-H) |
Tyr-55 (:O=) |
2.9 | 10, 100% | 2.9 | 2.8 | 2.8 |
| Между атомами боковых цепей β‑листов (рисунок 5b) | Gln-78 (=OE1:) |
Arg-96 (H-NH1-) |
2.6 | 2, 20% | 11.3 | 2.8 | 6.8 |
| Между атомами петель (рисунок 5c) | Arg-60 (NH1-H) |
Gly-70 (:O=) |
2.7 | 0, 0% | 21.1 | 4.9 | 12.6 |
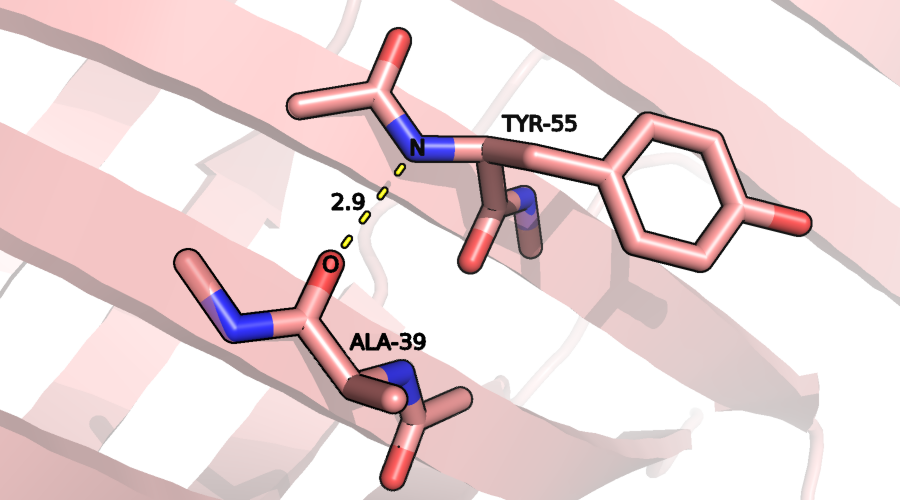 Рисунок 5a. Водородная связь между атомами остова в β-листе
Рисунок 5a. Водородная связь между атомами остова в β-листе
 Рисунок 5b. Водородная связь между атомами боковых цепей β-листов
Рисунок 5b. Водородная связь между атомами боковых цепей β-листов
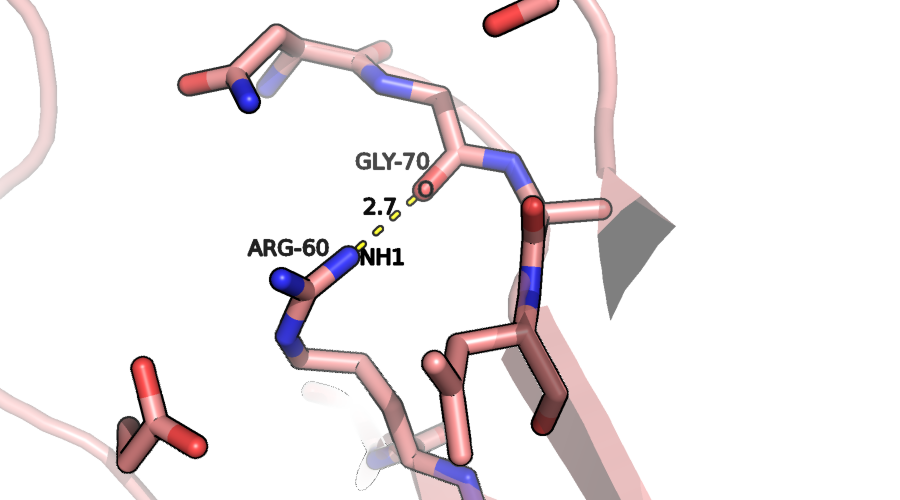 Рисунок 5c. Водородная связь между атомами петель
Рисунок 5c. Водородная связь между атомами петель