Практикум 6. Взаимодействия. Субстратная специфичность
Задание 1. PoseView
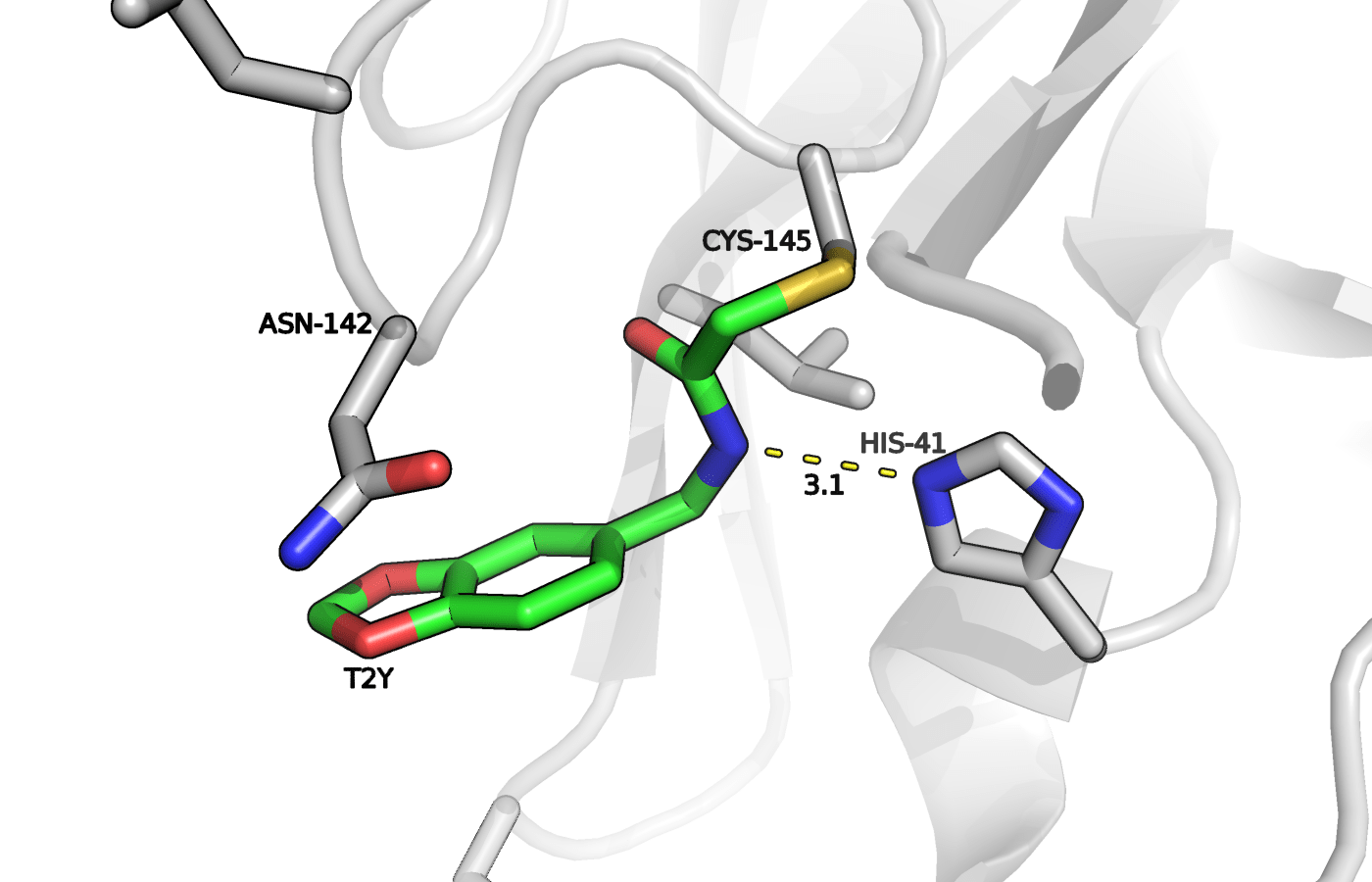
Рисунок 1. Расположение лиганда T2Y по отношению к ферменту. Лиганд связан ковалентно через серу 145 цистеина, а также может формировать водородную связь с 41 гистидином.
Основной целью данного задания была рефлексия насчёт результатов задания 1 практикума 1. Для удобства исходная картинка приведена на рисунке 1. Тогда было необходимо получить приемлемое изображение главной протеазы вируса SARS-CoV-2 (PDB ID: 5REO) с потенциальным лигандом T2Y и по возможности отметить предполагаемые взаимодействия.
В данном задании было предложено воспользоваться программой PoseView на сайте https://proteins.plus/ для автоматической разметки потенциальных взаимодействий и сравнения с полученными ранее результатами. Результат работы программы программы представлен на рисунке 2. Как можно заметить, лиганд действительно не вступает в большое число различных взаимодействий, алгоритмы нашли только 2 водородные связи: между лигандом и остовом Gly143, а также между лигандом и кольцом His41. Мною была отмечена только связь с 41 гистидином. Если бы я делал практикум 1 с имеющейся информацией, результат бы выглядел, как на рисунке 3.
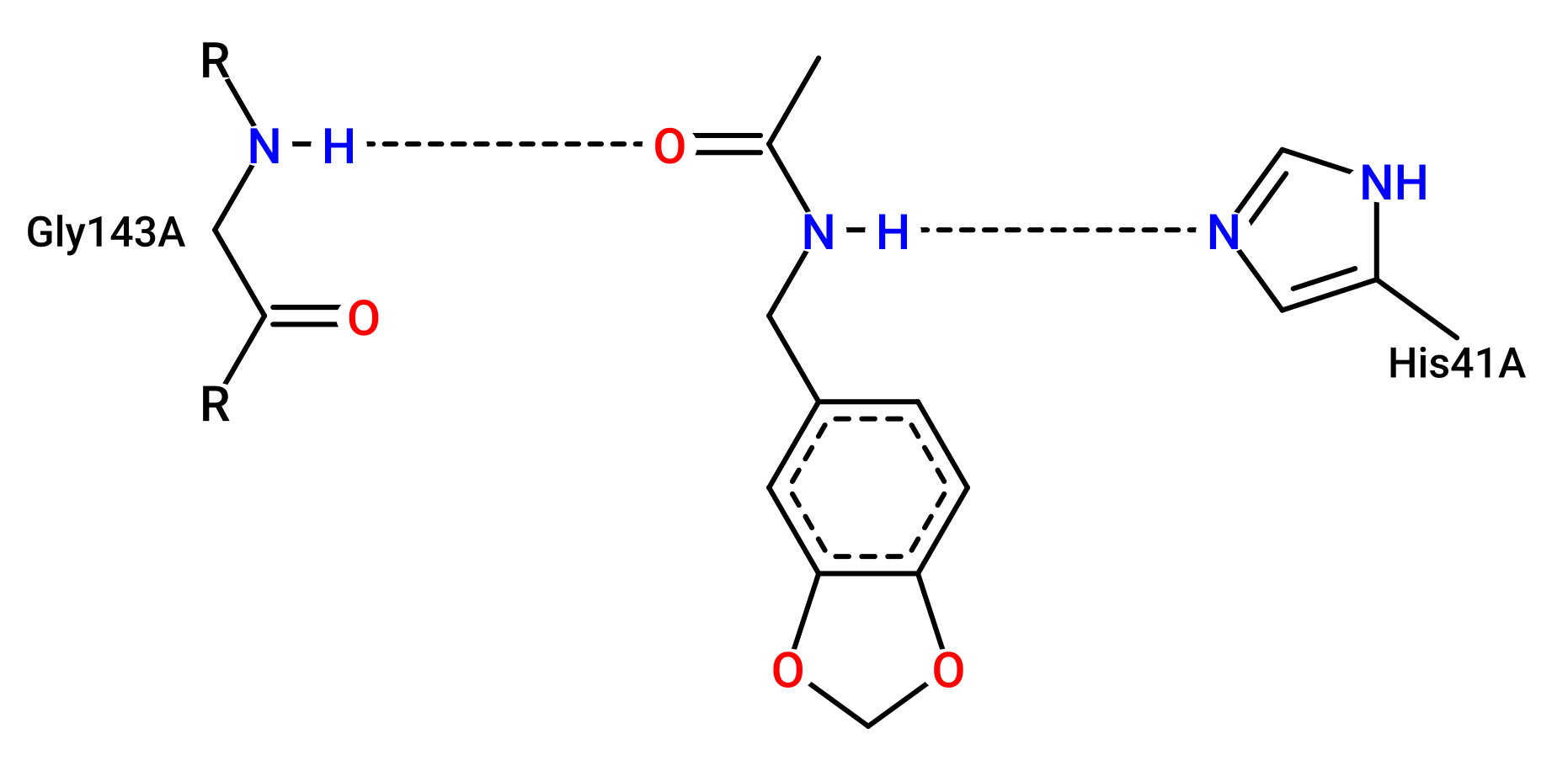
Рисунок 2. Результат работы программы PoseView для структуры 5REO главной протеазы SARS-CoV-2 и лиганда T2Y.
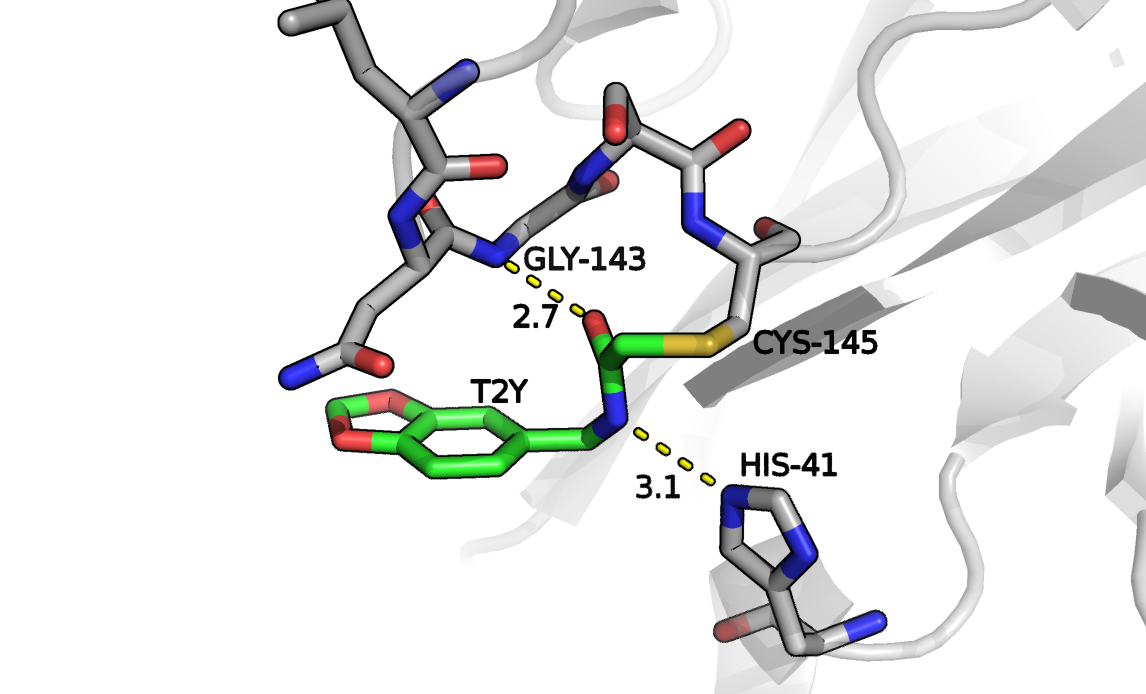
Рисунок 3. Расположение лиганда T2Y по отношению к ферменту, отмечены водородные связи с Gly143 и His41.
Водородная связь между кислородом "ножки" лиганда и азотом азота остова Gly143 действительно может возникать, расстояние даже меньше, чем между лигандом и гистидином. Углы тоже не выглядят противоречиво. Почему же я просмотрел этот контакт в прошлый раз? Оказалось, что у меня был включен режим cartoon_side_chain_helper, который не показывал атомы остова в том числе и у петель, даже если дополнительно было выставлено отображение в виде палочек. Мораль? Не стоит скрывать атомы остова при поиске контактов.
Задание 2. PyMol mutagenesis
Целью данного задания было воспользоваться встроенными возможностями PyMol для модификации остатков и подобрать подходящий остаток на место глицина, которым заменили интересующий остаток авторы задания.
Исходные данные: структуры антител AB1: цепь P, остаток №5 и AB2: цепь P, остаток №7.
Часть 1. Структура AB1

Рисунок 4. Участок структуры AB1, в которой должен находиться радикал. Мутируемый остаток изображен золотистым цветом.

Рисунок 5. Участок структуры AB1, глицин заменён на ротамер глутамина. Обозначены расстояния до Asn35.
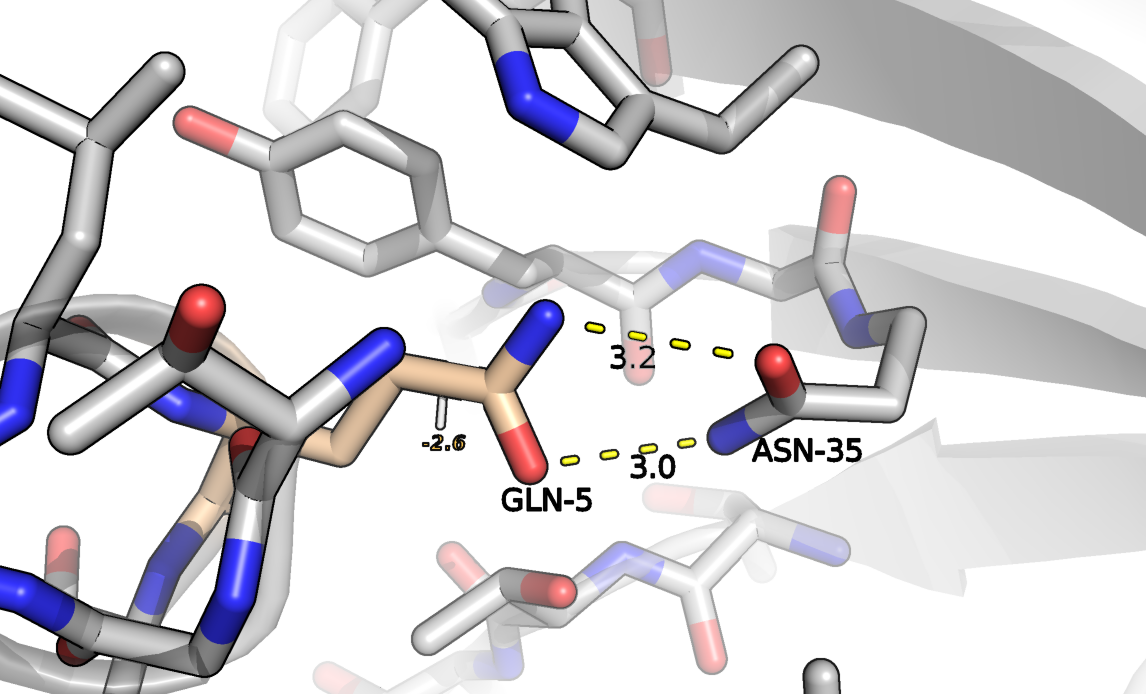
Рисунок 6. Глутамин дополнительно повёрнут для геометрического соответствия двум водородным связям.
На рисунке 4 представлено окружение остатка 5 цепи P в структуре AB1. Исследуемый остаток глицина уже заменён на аланин для понимания направления, куда будет смотреть радикал (спасибо Серёже Пушкарёву за идею). Про данный участок можно сказать следующее: присутствуют преимущественно полярные и ароматические остатки. Особенно примечателен Asn35, который очень заманчиво смотрит в полость. Хотелось бы образовать с ним водородную связь. Кажется, что алифатические остатки дальше можно не перебирать.
Первое предположение - разместить аспарагин, но его длины не хватило, чтобы дотянуться до Asn35 и сформировать с ним водородную связь. Также данный остаток в виде всех предложенных ротамеров только и делал, что приводил к локальной напряжённости структуры за счёт столкновения ван-дер-ваальсовых сфер.
Следующая идея - глутамин. Один из ротамеров с наименьшими затруднениями разместился в полости без каких-либо коллизий (рисунок 5). Ни один из предложенных ротамеров не образовывал сразу 2 водородные связи с 35 аспарагином, но, кажется, что такое вполне возможно при небольшом вращении амидной группы, как на рисунке 6. Если на этом месте в исходной структуре действительно был глутамин, было бы интересно посмотреть на его расположение по отношению к аспарагину, уж слишком привлекательно выглядит возможность образовать с ним сразу 2 водородные связи.
Дополнительно перебрал ароматические полярные остатки в попытках кроме водородных связей задействовать ещё и стэкинг от соседних колец, однако все рассмотренные ротамеры только создавали напряжённость и образовывали коллизии с соседями. Последующий перебор неароматических полярных остатков показал, что серин и цистеин обладают наименьшим фактором напряжённости в этом кармане, однако, они не вступают ни в какие взаимодействия с соседними остатками, так как им просто не хватает длины.
Таким образом, наиболее предпочтительным вариантом для замены 5-го остатка цепи P я считаю глутамин: он, несмотря на большой размер, без коллизий вписывается в рассматриваемую область, при этом его наличие также объясняет положение 35-го аспарагина напротив, с которым возможно образование двух водородных связей при определенном повороте амидной группы.
Часть 2. Структура AB2
На рисунке 7 представлено окружение остатка 7 цепи P в структуре AB2 (исследуемый остаток глицина уже заменён на аланин). Про данный участок можно сказать следующее: как и в случае, в него направлены боковые радикалы полярных остатков. Привлекают внимание аспартат-59, с которым можно было бы образовать солевой мостик, 9-ый серин, который мог бы служить донором водородной связи, а также кислород остова 32-го глутамата.
Первая идея - задействовать как можно больше предоставленных остатков, например, за счёт аргинина. Результат представлен на рисунке 8: из 81 независимых от остова ротамеров с минимальными коллизиями оказался только один, но и он немного "сталкивается" с Asp59 и несколькими другими радикалами.
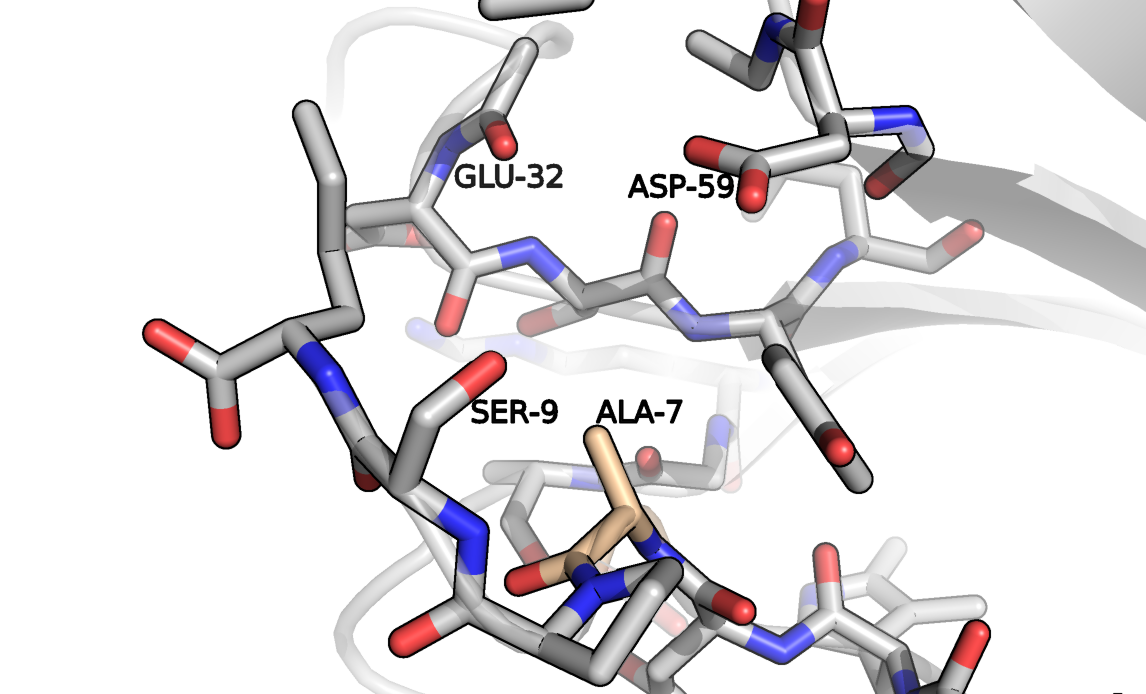
Рисунок 7. Участок структуры AB2, в которой должен находиться радикал. Мутируемый остаток изображен золотистым цветом.
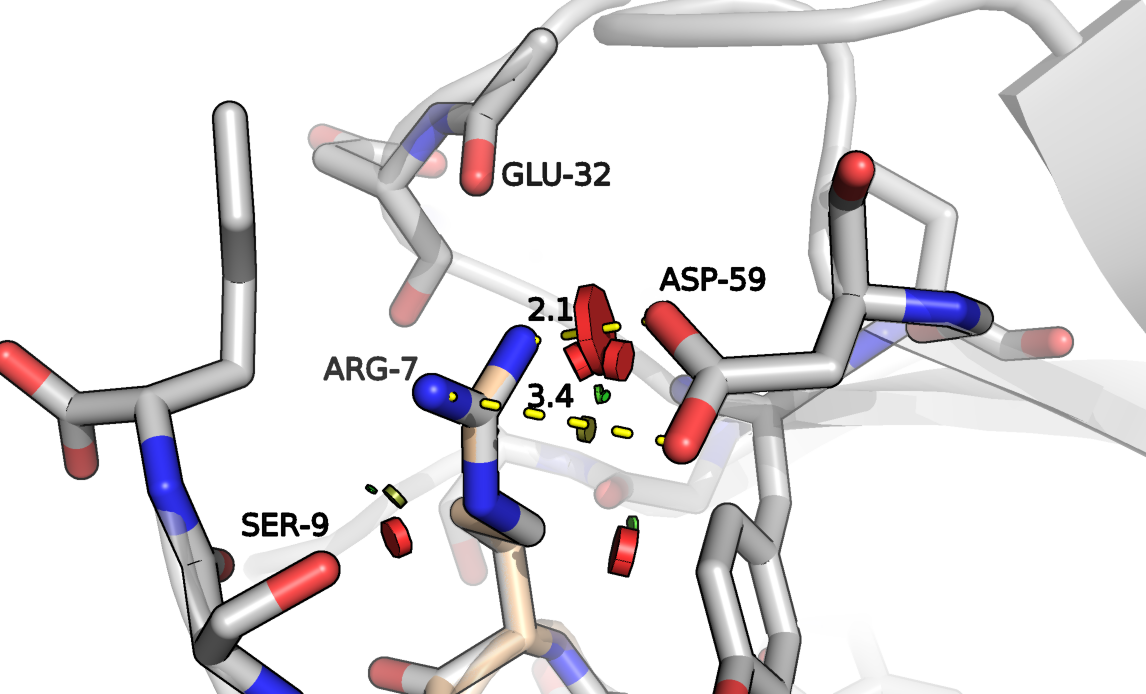
Рисунок 8. Участок структуры AB2, глицин заменён на аргинин. Обозначены расстояния до Asp59.
Следующим предположением стал лизин. По умолчанию был открыт ротамер, направленный в сторону Asp59 (рисунок 9). В целом, расстояния позволяют образовывать как водородную связь, так и солевой мостик между их радикалами. Представленность такого ротамера - 3,6%, strain - 11,2. Из оставшихся 80 ротамеров подходящим оказался ещё один, который направлен на кислород 32-го глутамата (рисунок 10). Представленность оказалась 13,4%, strain - 11,97, так что по напряжённости они практически не отличаются, хотя PyMol и показывает небольшую коллизию.
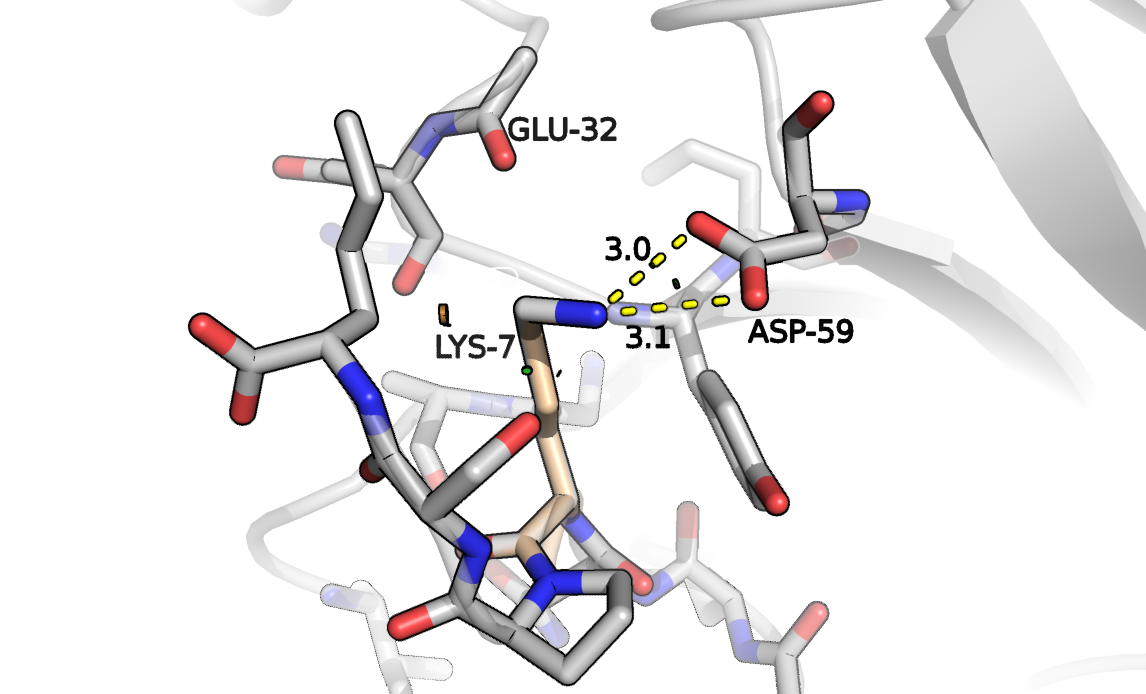
Рисунок 9. Участок структуры AB2, глицин заменён на аргинин. Обозначены расстояния до Asp59.
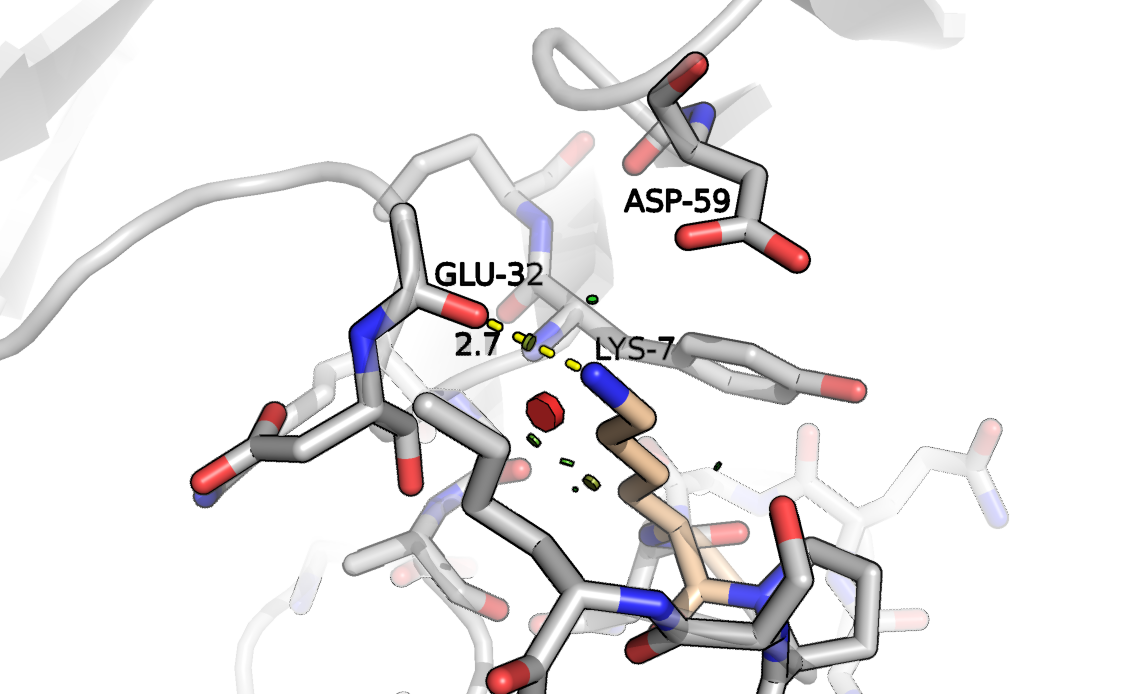
Рисунок 10. Участок структуры AB2, глицин заменён на аргинин. Обозначены расстояния до Asp59.
Затем я перебрал несколько других полярных остатков. Алифатические не рассматривал ввиду окружения. Оказалось, что остальные остатки не вступают в какие-либо взаимодействия с соседними радикалами, так как не дотягиваются до них. Полярные остатки с ароматическими кольцами к тому же образовывали коллизии с соседними радикалами.
Таким образом, наиболее подходящим остатком мне кажется лизин: аргинин всё-таки оказывается слишком близко к аспарагину. Лизину же практически не мешает окружение. При этом остаётся неясным, какой из ротамеров мог бы присутствовать в оригинальной структуре. Думаю, что оба варианта (рисунки 9 и 10) имеют право на существование.