Практикум 7. Поверхности, карманы, pKa
Задание 1. SASA, MSA
Целью данного задания было сопоставить открытую и закрытую конформации митохондриальной аспартатаминотрансферазы, выделенной из курицы. Согласно публикации (Hohenester E., et. al., 1994), сопровождающей структуры данного фермента, это димер, каждая субъединица которого состоит из большого и малого доменов. После связывания фермента с лигандом малый домен поворачивается на 13° относительно большого, полностью закрывая лиганд. Для работы использовались 2 структуры с PDB ID 1TAR и 1TAT, соответствующие открытой и закрытой конформациям. На рисунке 1 представлен общий вид их структурного выравнивания, а на рисунке 2 более подробно показана малый домен.
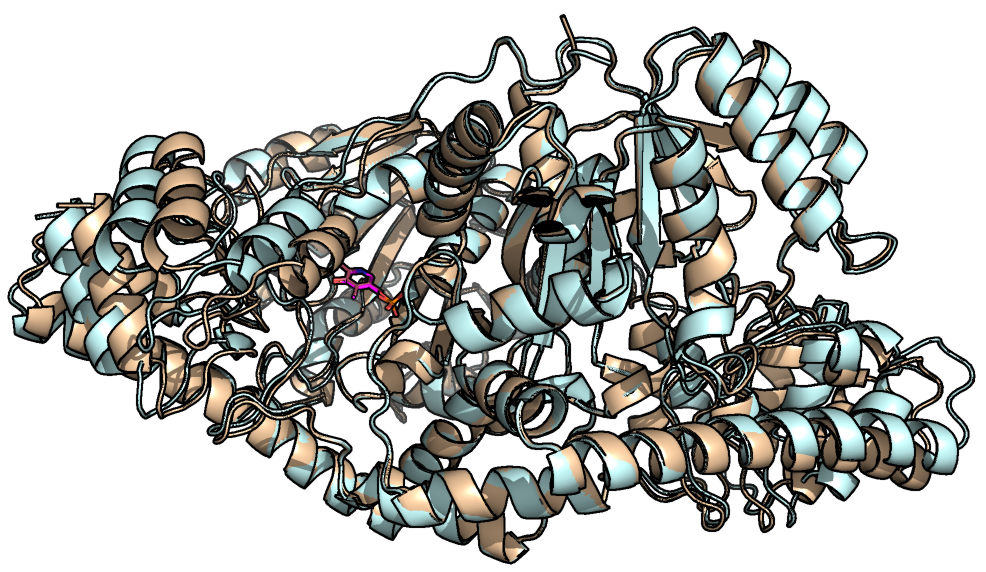
Рисунок 1. Выровненные структуры аспартатаминотрансферазы. Открытая конформация (1TAR) показана голубым, закрытая (1TAT) - золотым.
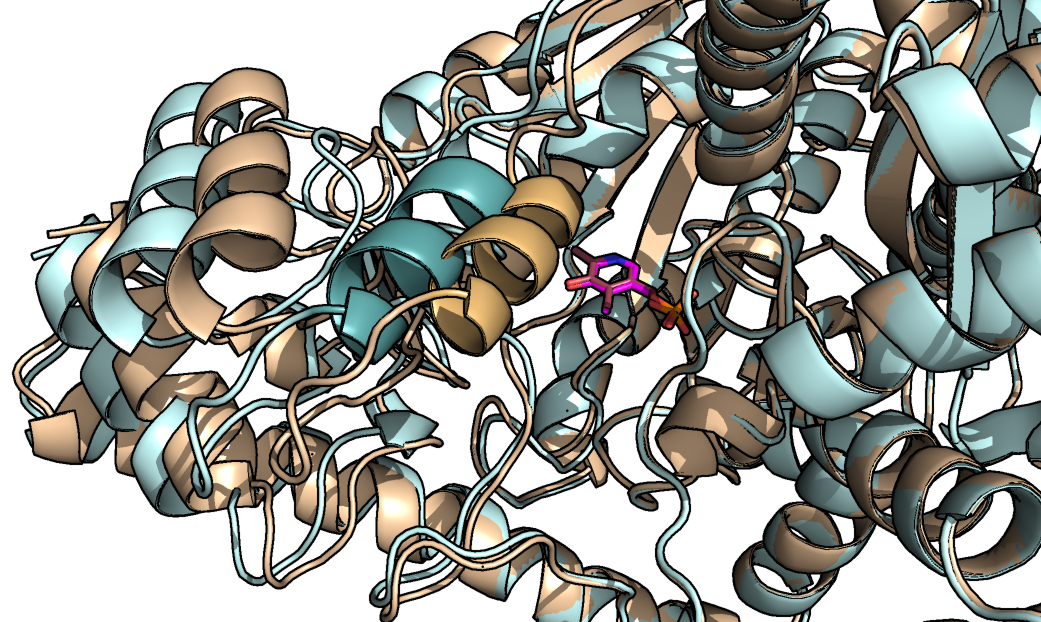
Рисунок 2. Показаны наиболее отличающиеся элементы структуры. Более тёмными оттенками показана спираль, непосредственно закрывающая карман связывания лиганда.
Можно заметить, что большинство элементов структуры не меняются при смене конформации. Подвижны несколько петель, которые, вероятно, и составляют малый домен. Картина, наблюдаемая на рисунке 2, наблюдается и с другой стороны структуры ввиду димерности фермента. На рисунке 3 показано сравнение поверхности открытой и закрытой конформации.
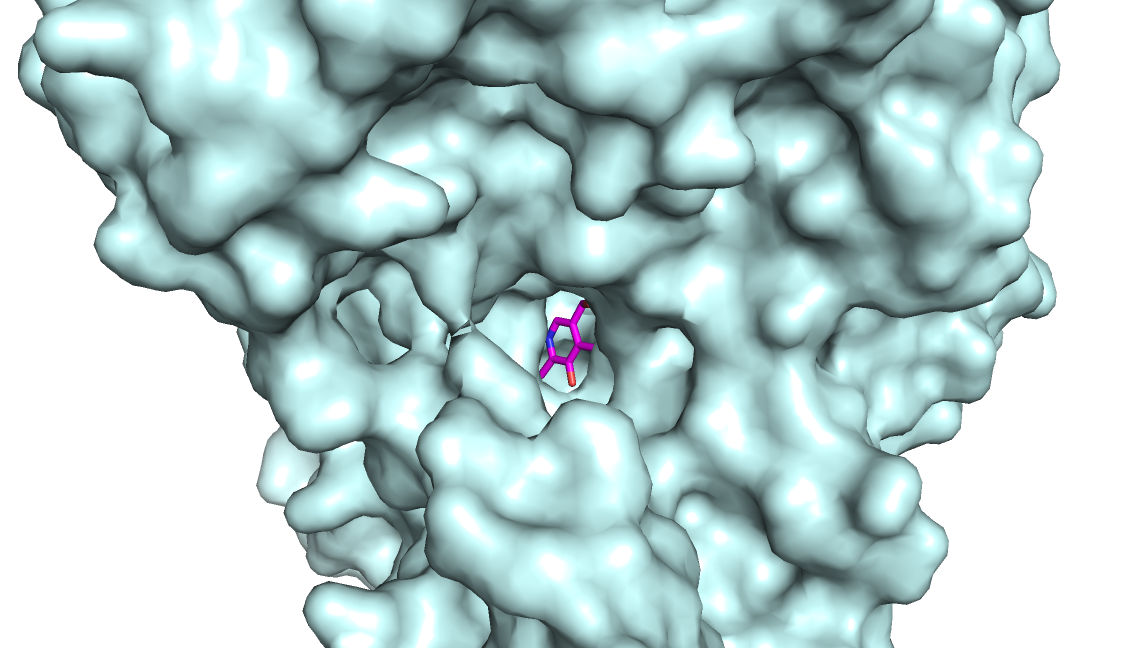

Рисунок 3. Сравнение поверхности открытой и закрытой конформаций аспартатаминотрансферазы.
Таблица 1. Сравнение площадей поверхности (Å2) открытой и закрытой конформаций.
| Конформация | Закрытая | Открытая |
| MS | 79508.8 | 80897.2 |
| SAS | 31040.2 | 31765.1 |
Сравнение площадей молекулярной поверхности (MS) и поверхности, доступной растворителю (SASA) представлено в таблице 1. Для их расчётов использовались структуры после удаления молекул растворителя и лигандов. Ожидаемо оказалось, что MS больше SASA, что объясняется способом расчёта поверхности: MS учитывает больше вогнутостей поверхности. Небольшое уменьшение площади поверхности закрытой конформации также оказалось ожидаемым.
Задание 2. Карманы, объем
На рисунке 4 представлен карман 1, который расположен рядом с центром связывания лиганда, в открытой и закрытой конформации. Объём кармана в открытой конформации - 6961.7 Å3, в закрытой - 2732.7 Å3. Реально для белка уменьшение объема кармана снаружи означает образование полости внутри, в которой происходит химическое превращение субстрата.

Рисунок 4a. Расположение кармана, ассоциированного с карманом связывания субстрата, на поверхности открытой конформации.

Рисунок 4b. Тот же карман на поверхности закрытой конформации.
Задание 3. Экспонированность
В данном задании было необходимо сопоставить экспонированность остатков закрытой и открытой конформаций и выбрать остаток с её наибольшим изменением. Изменение экспонированности нельзя трактовать как-то однозначно, например, какой-то остаток в одной конформации мог быть целиком погруженным в глобулу, а потом оказаться снаружи. Поэтому я решил оценивать абсолютное изменение экспонированности.
Экспонированности остатков были рассчитаны командой mkdssp. Остатком с наибольшим изменением экспонированнсти оказался Ser-3 (открытая: 45, закрытая: 121, абсолютное изменение: 76). Данный остаток представлен на рисунке 5.
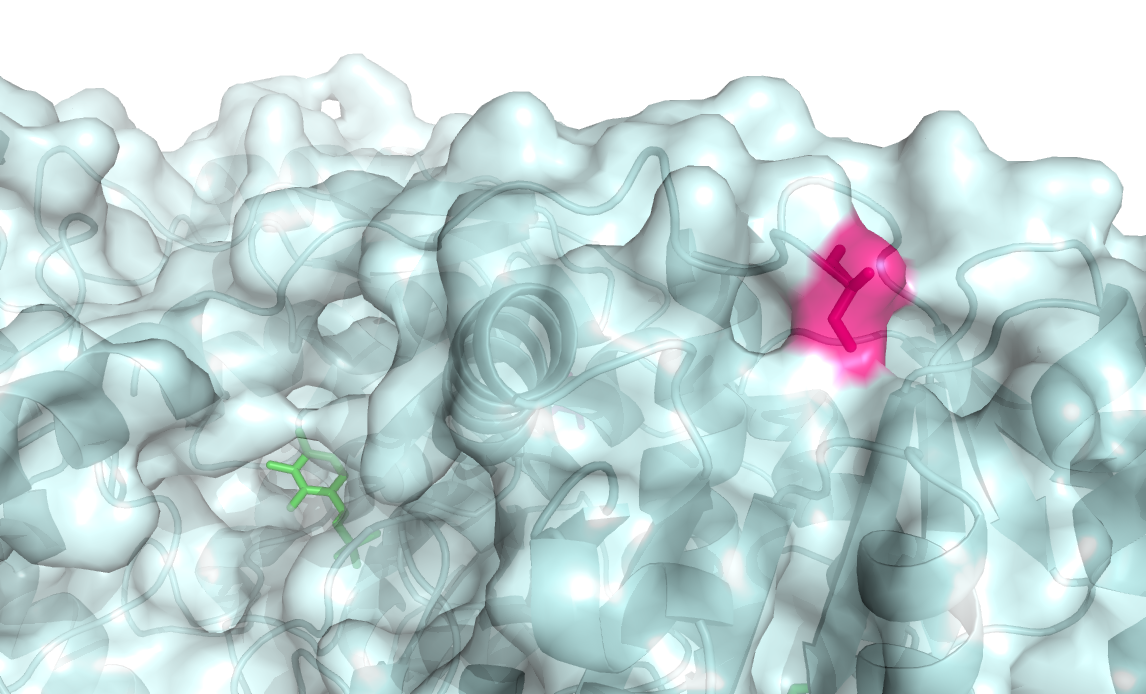
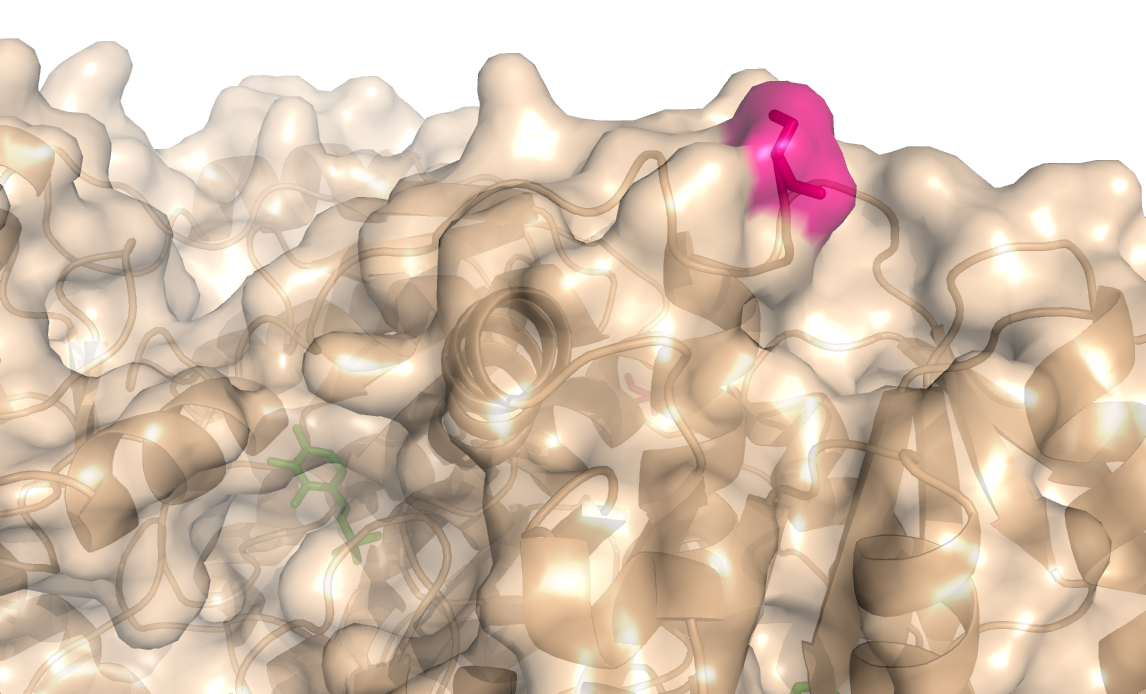
Рисунок 5. Серин-3 - остаток с наибольшим изменением абсолютной экспонированности, показан розовым.
На рисунке 6 представлено окружение Ser-3. В открытой конформации остов третьего серина, вероятно, образует водородную связь с аспартатом-249. В закрытой конформации остаток экспонирован, нет очевидных контактов с соседями. Молекулы растворителя в структуре закрытой конформации отсутствуют.
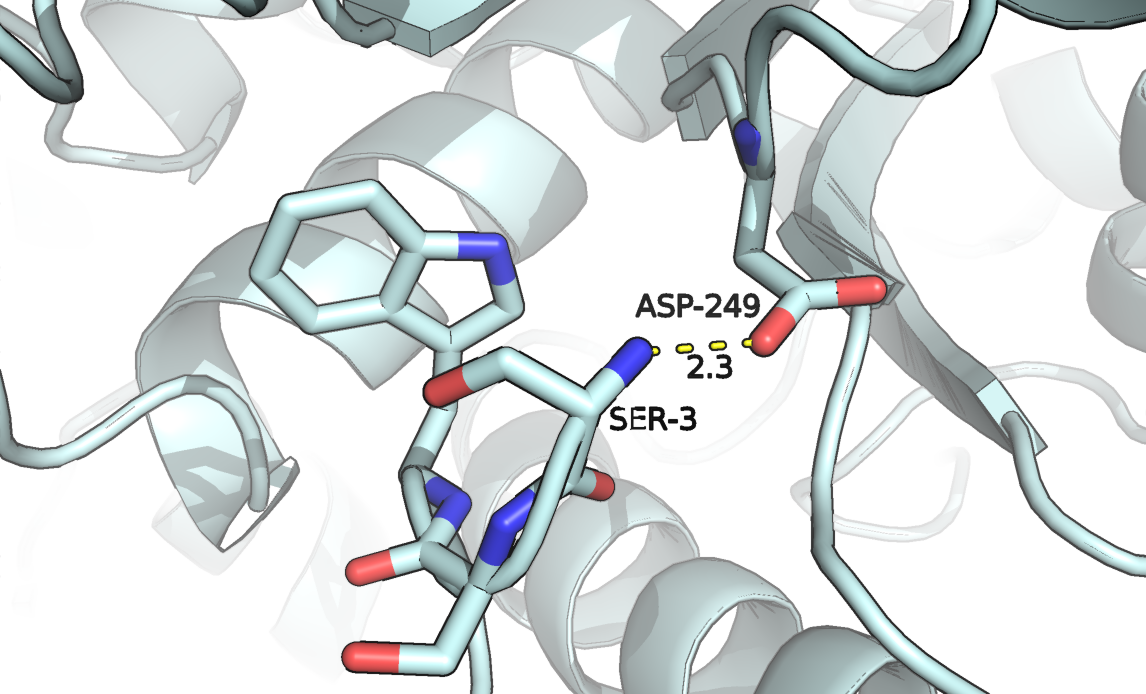
Рисунок 6a. Серин-3 в структуре открытой конформации.
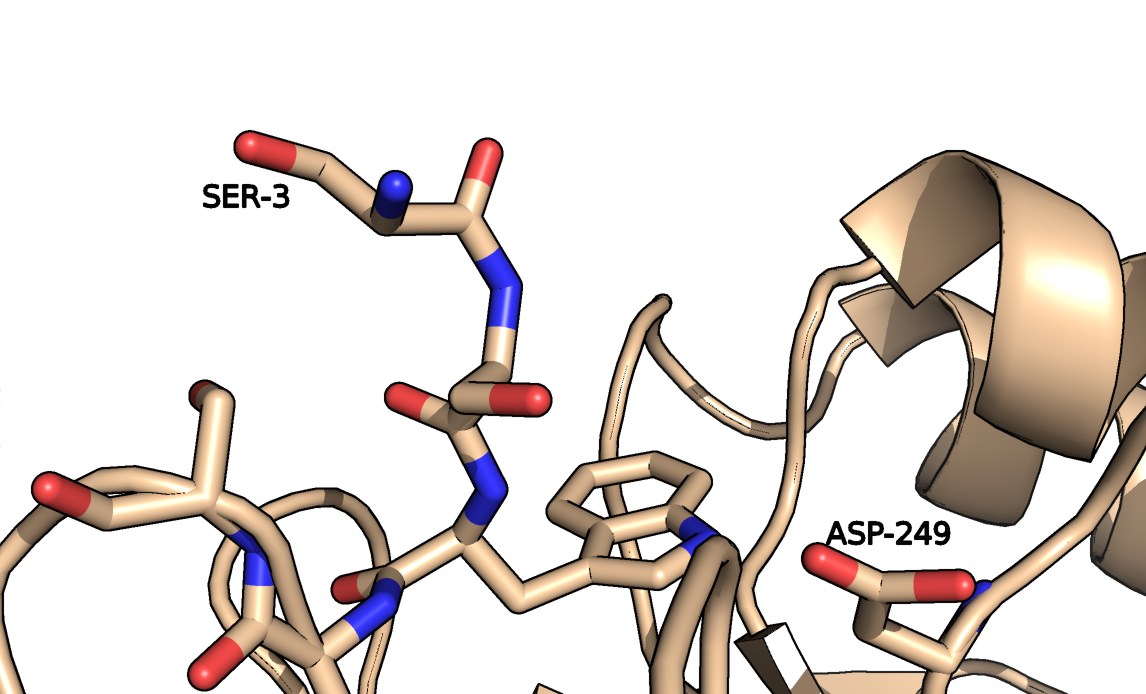
Рисунок 6b. Серин-3 в структуре закрытой конформации.