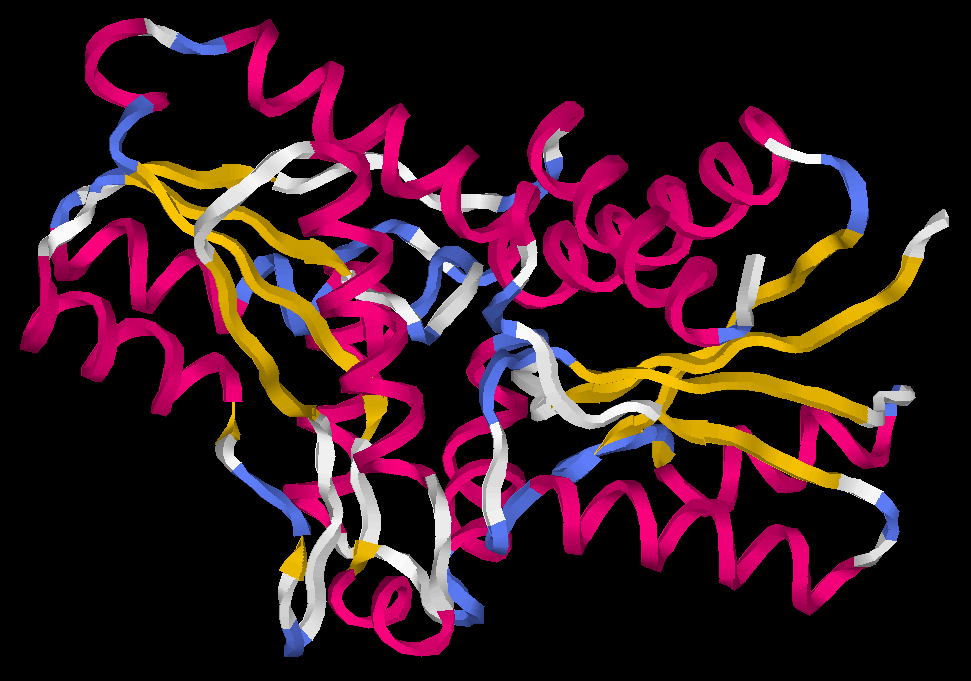
14 α-спиралей
12 β-тяжей
22 β-поворотов (реверсивных поворотов)
- α-спираль SER A 54 - GLN A 75
- β-тяж
- Антипараллельных β-тяжей в моем белке нет. А в белке 1bs2 антипараллельные бета-тяжи: LEU A 100 - ASN A 106; PHE A 109 - PHE A 114
- Параллельные β-тяжи LYS A 4 - ALA A 12; ILE A 78 - LEU A 86
- β-поворот VAL A 112 - LEU A 113
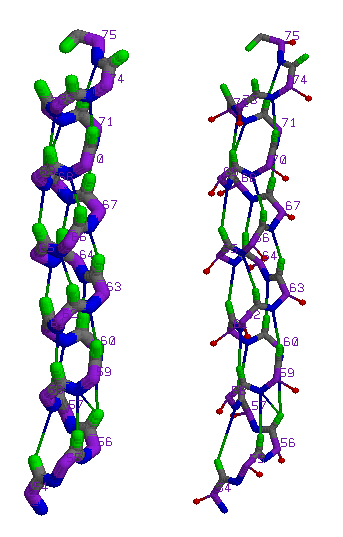
На схеме: самая длинная α-спираль SER 54 - GLN 75, ее остов с раскраской по атомам, а также красные шарики - С-β.
Паттерн Н-связей: H(i,i+4) (где i от 54 до 71).
В структуре ни один С-β атом не заходит внутрь спирали.
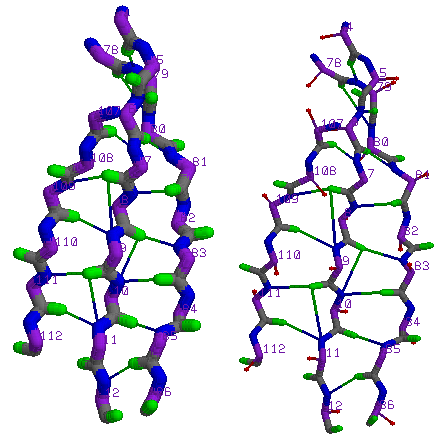
На схеме: β-лист, состоящий из трех β-тяжей - Glu 107 - Val 112, Lys 4 - Ala 12, Ile 78 - Leu 86, , с раскраской по атомам, а также красные шарики - С-β.
C-β атомы лежат вне плоскости β-листа.
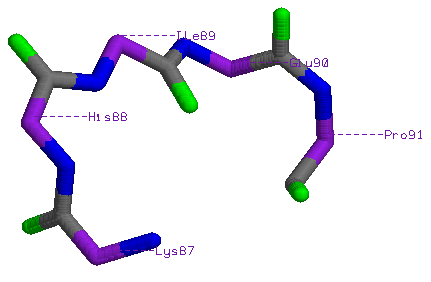
Lys87-His88-Ile89-Glu90-Pro91
В повороте нет Н-связей.