Практикум 4: показатели качества рентгеноструктурной модели
Критический анализ модели феррохелатазы из Bacillus subtilis, представленной в банке PDB, код 1DOZ
D. Lecerof, Department of Molecular Biophysics Lund University, Sweden
В отчете приведены результаты анализа качества структуры феррохелатазы, расшифрованной методом РСА и содержащейся в PDB под кодом 1DOZ.
Феррохелатаза - фермент, катализирующий металлирование протопорфирина IX на последней стадии биосинтеза протогема. В бактериях феррохелатаза находится в цитоплазме, либо ассоциирована с цитоплазматической мембраной, тогда как у млекопитающих и дрожжей фермент расположен в митохондриальной мембране. Также фермент может катализировать хелатирование мезопорфирина IX и дейтеропорфирина IX in vitro дивалентными ионами Zn2+, Cu2+, Co2+. У человека редукция синтеза гема из-за мутаций гена феррохелатазы приводит к эритропоэтической порфирии.
Феррохелатаза из Bacillus subtilis состоит из двух a/b доменов с укладкой Россмана. В статье представлены две структуры: одна, образующая комплекс с N-MeMP, и другая - с металлированным мезопорфирином - Cu(MP) Структуры позволяют идентифицировать активный сайт фермента. Проанализированы конформационнные изменения белка, возникающие при связывании порфирина. Предложен механизм металлирования и конформационных изменений порфирина: феррохелатаза фиксирует пиррольные кольца B, C, D и наклоняет кольцо A для доступа металла в порфирин.
Получена структура кристалла комплекса феррохелатазы Bacillus subtilis с N-MeMP с разрешением 1.9Å. Фазовая проблема решена с помощью молекулярного замещения, R-factor - 18.1% (R-free 23.1%), все остатки соответствуют карте Рамачандрана. Для выявления металл-связывающего сайта и его влияние на связывание порфирина была кристаллизована структура феррохелатазы с N-MeMP в присутствии Cu2+ с разрешением 2.3Å, R-factor - 18.3% (R-free 25.7%).
Для апофермента измерено:
- 27,034 рефлексов,
- минимальное разрешение - 20.0Å,
- максимальное - 1.8Å,
- полнота - 94% (процент использованных рефлексов относительно всех возможных рефлексов с разрешением ниже 1.8Å),
- R-factor - 17.7% (R-free 20.5%), их разница меньше 10%, что говорит о том, что модель не переоптимизована.
PROCHECK
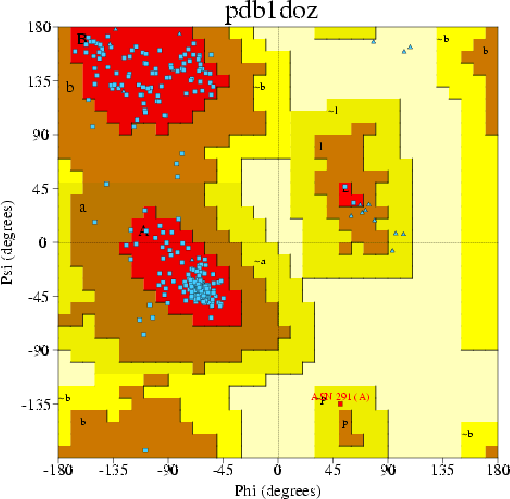
94.1% остатков (отличных от Gly и Pro) попали в предпочитаемые области на карте.
G-Factors
Average
Parameter Score Score
--------- ----- -----
Dihedral angles:-
Phi-psi distribution 0.08
Chi1-chi2 distribution 0.09
Chi1 only 0.16
Chi3 & chi4 0.38
Omega 0.35
0.21
=====
Main-chain covalent forces:-
Main-chain bond lengths 0.52
Main-chain bond angles 0.28
0.38
=====
OVERALL AVERAGE 0.28
=====
Значения G-фактора меньше -0.5 показывают необычность признака. Так, в структуре только длины связей главной цепи -0.52.
Таким образом, программа PROCHECK показала, что структура соответствует всем ее параметрам проверки.
Asn291(A) - маргинальный остаток, на карте Рамачандрана попал в запрещенную зону.
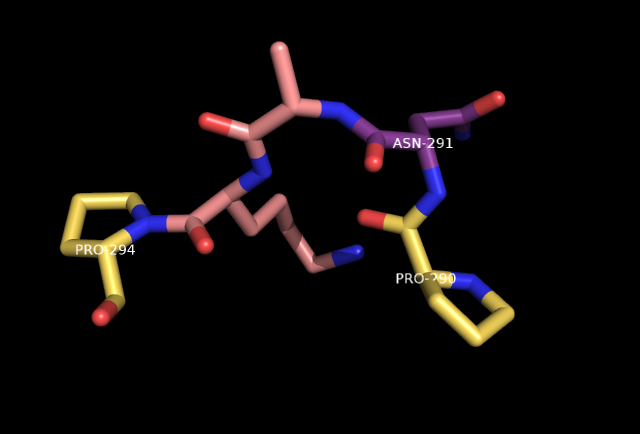
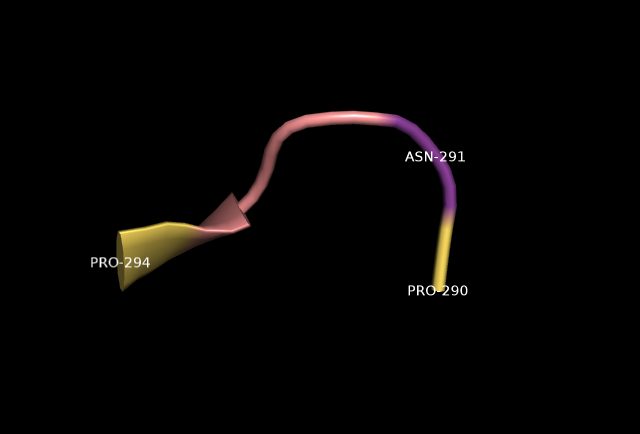
На рисунках показано, что остаток аспарагина находится в повороте, соседствуя с двумя пролинами. Pro290 может оказывать большое влияние на главную цепь Asn291.
EDS
EDS показывает Pro227, как единственного outlier'а, RSR=21,6%.
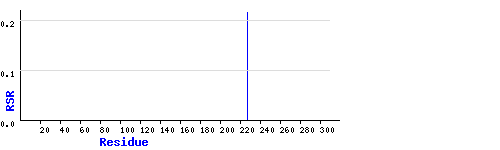
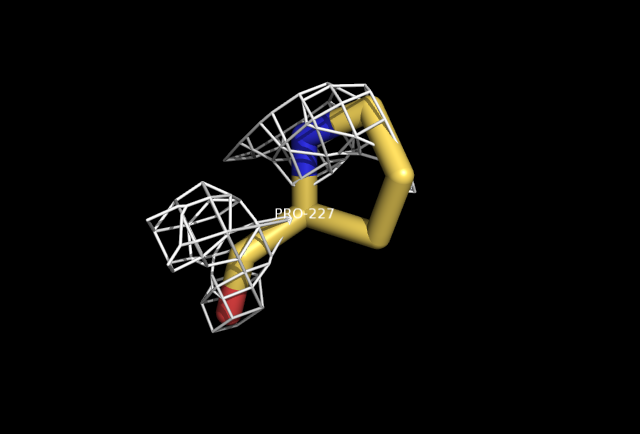
Из рисунка видно, что остаток Pro227 плохо вписан в электронную плотность (уровень подрезки 1.5).
Заключение
Структура имеет хорошие значения R-фактора, свободного R-фактора, 94.1% остатков
(отличных от Gly и Pro) попали в предпочитаемые области на карте Рамачандрана. Real-space R-value: 8.9%.
Был найден маргинальный остаток Asn291(A),но его маргинальность можно объяснить необходимым условием
для существования структуры, и программой EDS найден остаток Pro227, как маргинальный.
Нет подозрения на переоптимизацию (overfitting) модели: (R-free - R-factor = 2.8%, что меньше 10%).
Обзор протокола WHAT_CHECK
-
Structure Z-scores, positive is better than average: 1st generation packing quality : 1.0 2nd generation packing quality : -1.1 Ramachandran plot appearance : 0.2 chi-1/chi-2 rotamer normality : -0.4 Backbone conformation : -0.0 RMS Z-scores, should be close to 1.0: Bond lengths : 0.589 (tight) Bond angles : 0.766 Omega angle restraints : 0.382 (tight) Side chain planarity : 0.448 (tight) Improper dihedral distribution : 0.762 B-factor distribution : 0.700 Inside/Outside distribution : 0.909
-
chi-1/chi-2 correlation Z-score : -0.704 89 GLU ( 90-) A PRO omega poor 112 LEU ( 113-) A Poor phi/psi 120 SER ( 121-) A Poor phi/psi 221 SER ( 222-) A Poor phi/psi 231 GLY ( 232-) A PRO omega poor 290 ASN ( 291-) A Poor phi/psi
В таблице ASN(291)A - остаток, который и на карте Рамачандрана оказался маргинальным. А вот про остаток Pro227 WHAT_CHECK ничего не сказал.
WHAT_CHECK ничего нового, особенного не показал, вопиющих ошибок-нарушений в модели не выявил.
Structural and mechanistic basis of porphyrin metallation by ferrochelatase.
Lecerof, D., Fodje, M., Hansson, A., Hansson, M., Al-Karadaghi, S.
Journal: (2000) J.Mol.Biol. 297: 221-232
© Migur Anzhela 2012