Мне было предложено 2 PDB ID: 1EF3 и 6TUC . Под обоими идентификаторами представлена структура фермента альдозоредуктазы человека. Известно, что для многих ферментов структура расшифрована много раз, в том числе в комплексе с различными лигандами. В моём случае в структуре 1EF3 представлен комплекс альдозоредуктазы с ингибитором фидарестатом. В этой структуре 2 идентичные субъединицы. Под 6TUC - комплекс с ALP25 (1 субъединица).
При первичном анализе различий структур я обратила внимание, что по-разному размечены альфа-спирали, не совпадает их начало и окончание. При этом расположение консервативных структур, альфа-спиралей и бета-структур, практически идентично. Наибольшие отличия в ходе белковой цепи наблюдались в участках между альфа-спиралей и бета-листов. Кроме того, для структуры 6TUC, кажется, анализ проводился несколько раз и подвижные области в различных положениях наложены друг на друга.
При изучении карты ЭП с помощью mesh стало сразу понятно, что качество структуры 1EF3 гораздо хуже. Электронная плоность вокруг атомов неровной формы, часто прерывается. При общем взгляде на структуру преимущественно видны области ЭП вокруг наиболее электрооотрицательных атомов (S,P,N). При анализе с помощью volume было сложнее делать какие-либо выводы, изображения слишком загромождены.
После визуального анализа я нашла на PDB реальные значения разрешения. Для 1EF3 разрешение составляет 2.80 Å, 6TUC 1.06 Å (качество гораздо выше). Таким образом, мой прогноз был верным.
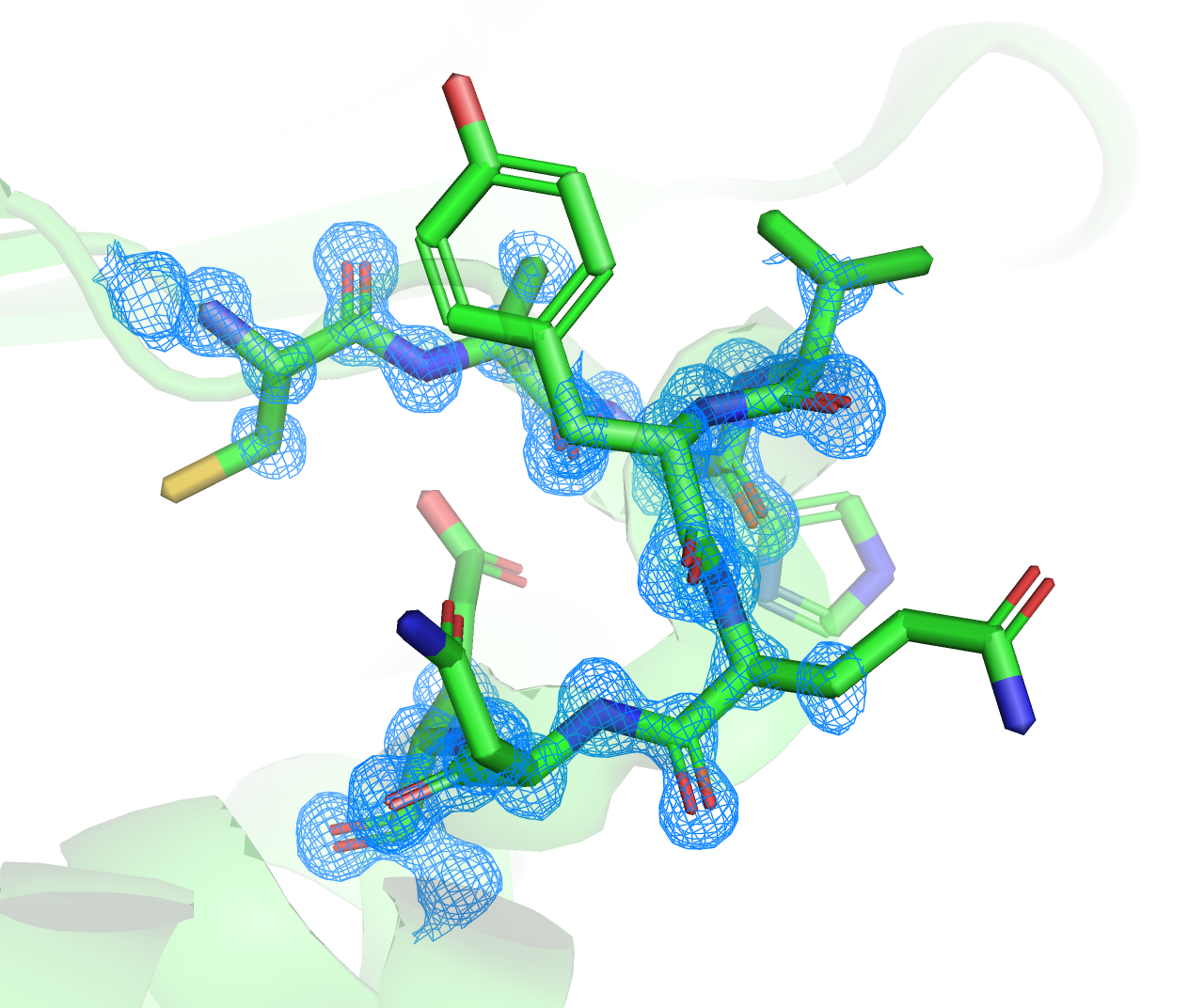
Для структур с разным качеством я выбрала одинаковый участок длиной восемь аминокислотных остатков (позиции 44 по 51). Структуры этих участков отличались, особенно заметны различия в ориентации боковых радикалов аминокислот GLU-51 и GLN-49. Результаты представлены на Рисунке 1. Для получения изображений применялась следующая команда:
isomesh XXXX_mesh, XXXX_2fofc, 2, loop and backbone, carve=2


Видно, что для структуры 6TUC ЭП различима для разных атомов и представлена в виде сфер вокруг центров атомов. Такой вид обеспечивает более простую и качественную расшифровку. В случае 1EF3 ЭП "размазана" по остову, и в нее будет сложнее вписать структуру.
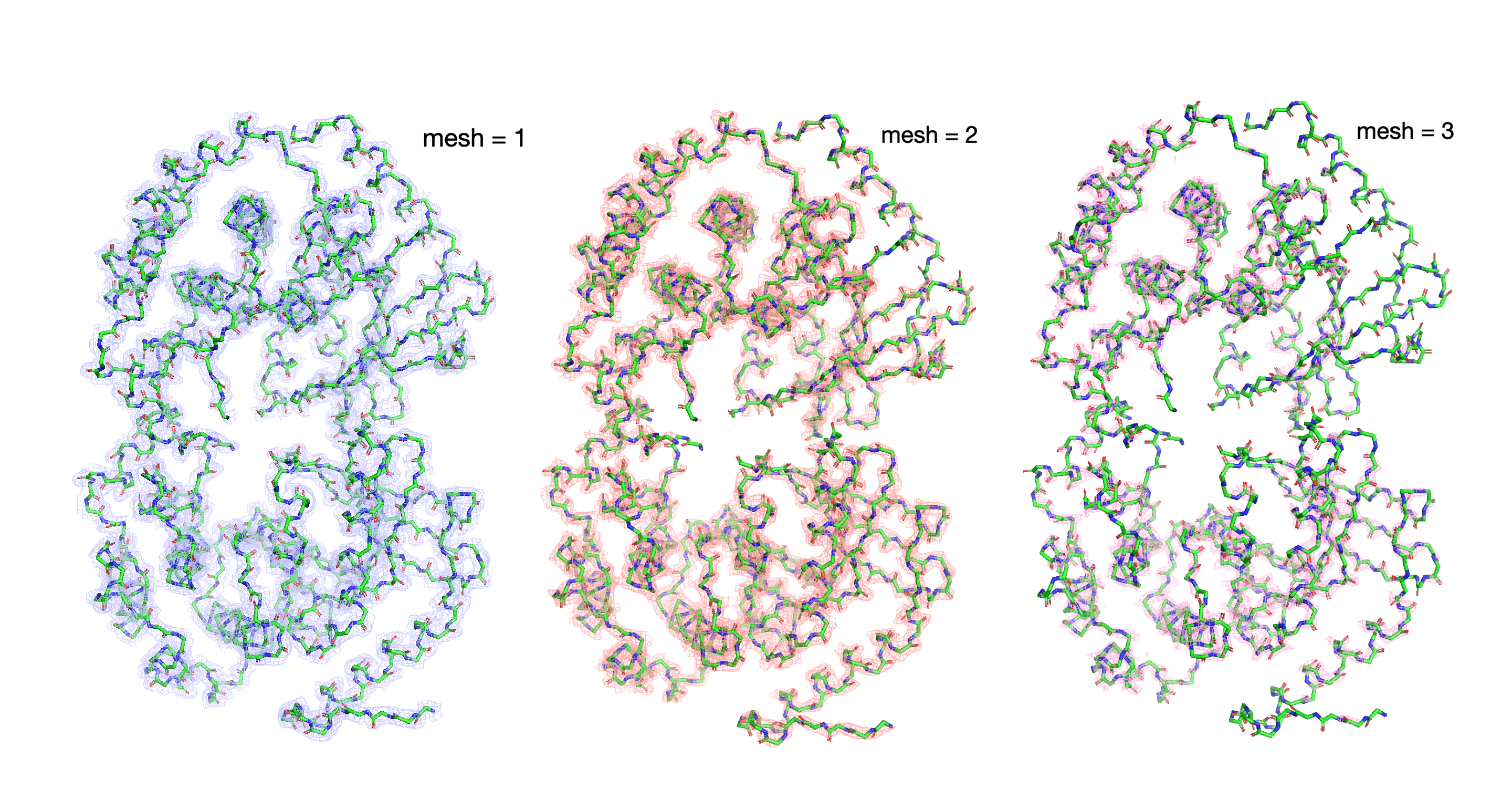
Далее я анализировала структуру 7B94. Это митоген-активируемая протеинкиназа 1 (MEK1), в её структуре 2 цепи. Для неё была построена серия mesh, с разным уровнем подрезки (1, 2, 3 Рисунок 2). С увеличением параметра уровня mesh мы оставляем наиболее плотные участки электронной плотности. Carve был выбран равным 1,5.
Я заметила, что "концевых остатков", где полипептидная цепь прерывается, больше, чем 2 для каждой цепи. Когда я стала разбираться, выяснилось, что в структуре имеются "пропущенные" остатки. Пример таких гэпов в структуре представлен на Рисунке 3. Такая проблема характерна для поверхностных петель кристаллизованного белка. Такие петли часто внутренне неупорядочены, и в таких участках карты электронной плотности бывают размыты. Таким образом, остатки могут быть пропущены в структуре [1].
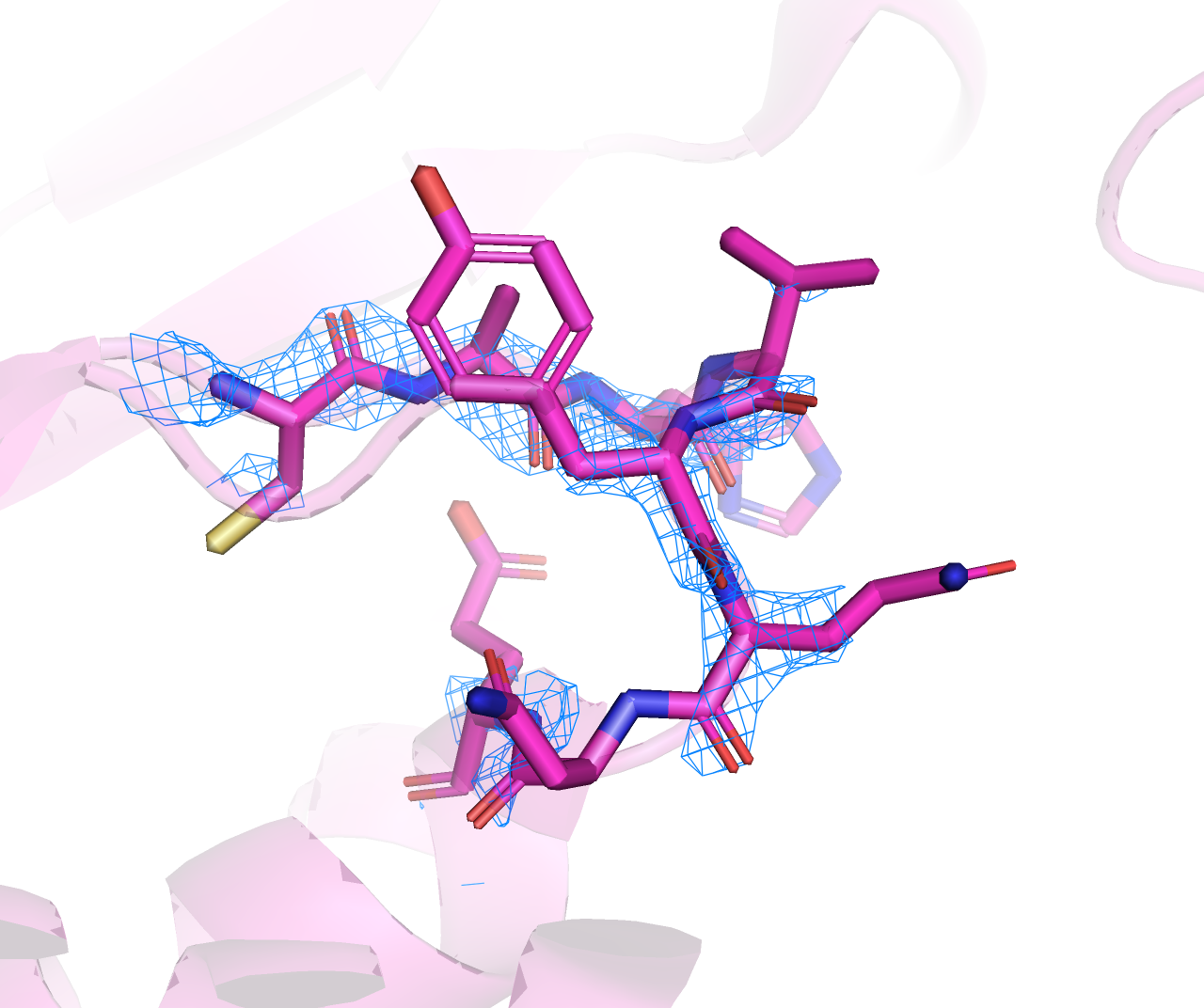
При переходе 1->2->3 сетка перестает покрывать весь белковый остов. В первую очередь сетка пропадает на N и C концах цепей, а также на прерывающихся участках, которые обсуждались выше. Кроме того, электронная плотность ниже в зонах с высоким B-фактором (Рисунок 4). B-фактор выше в подвижных частях белка [2].
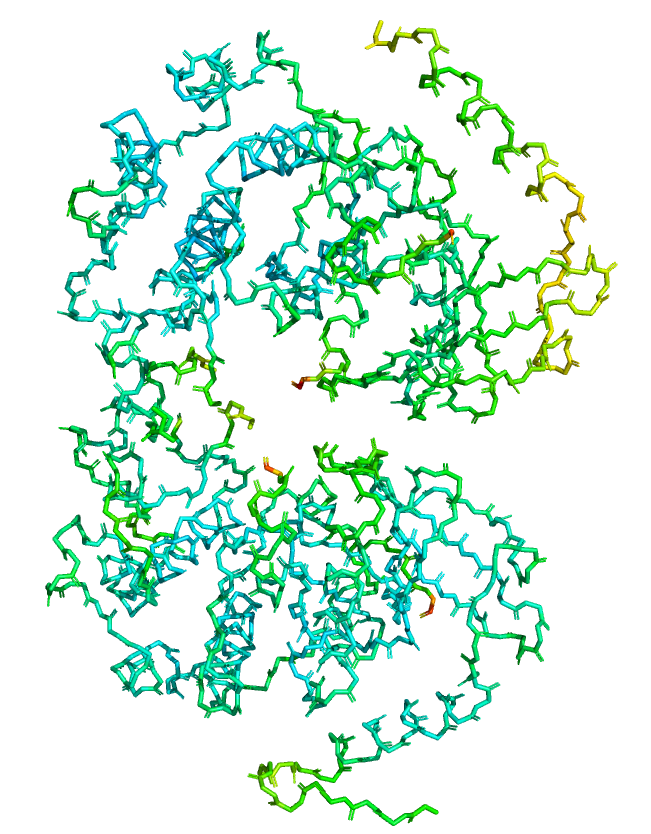
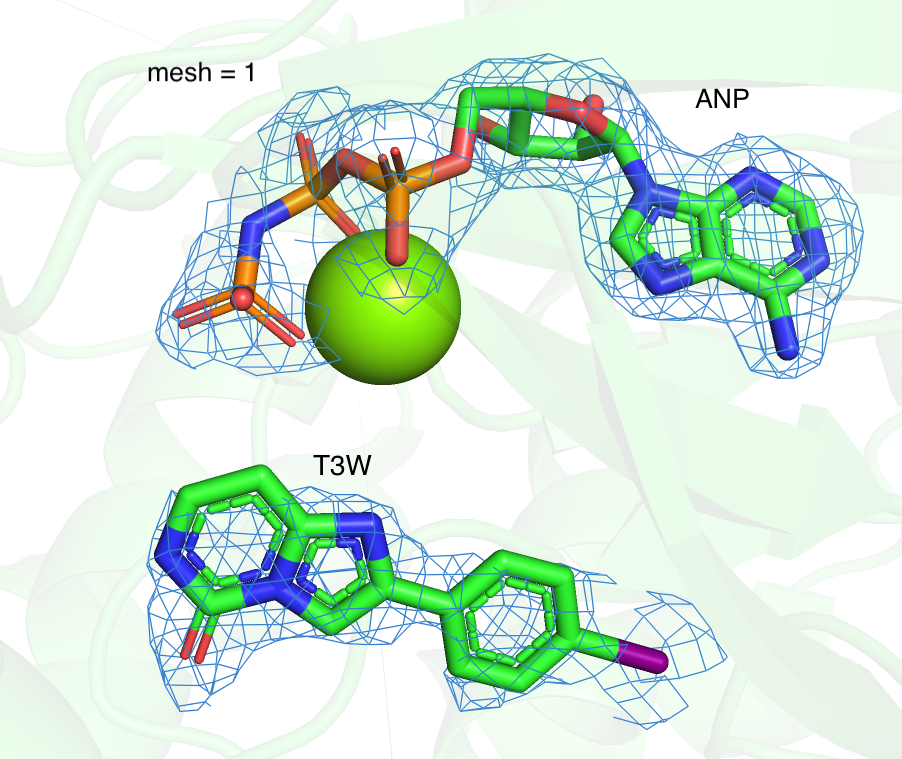
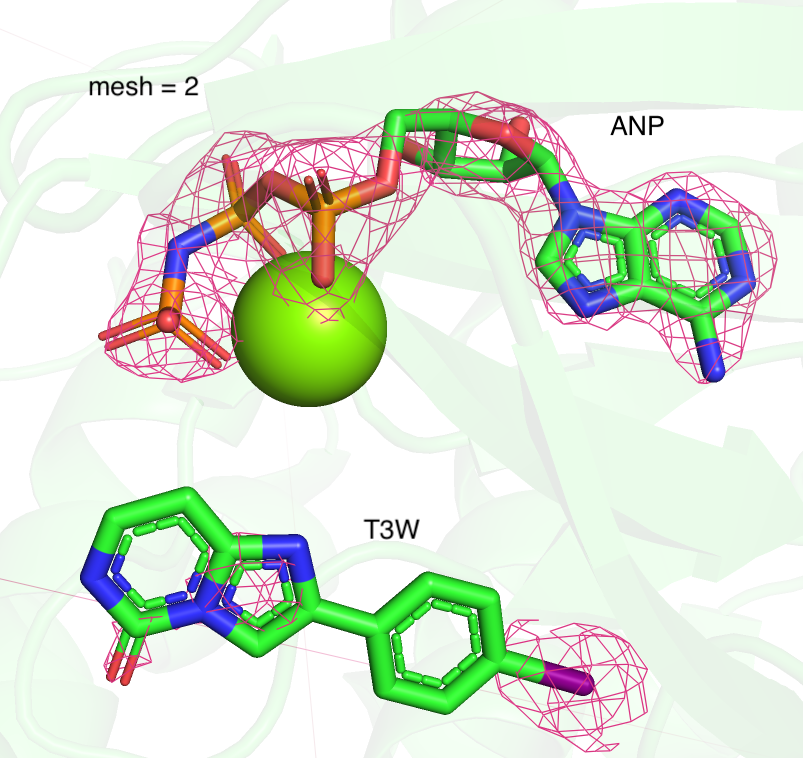
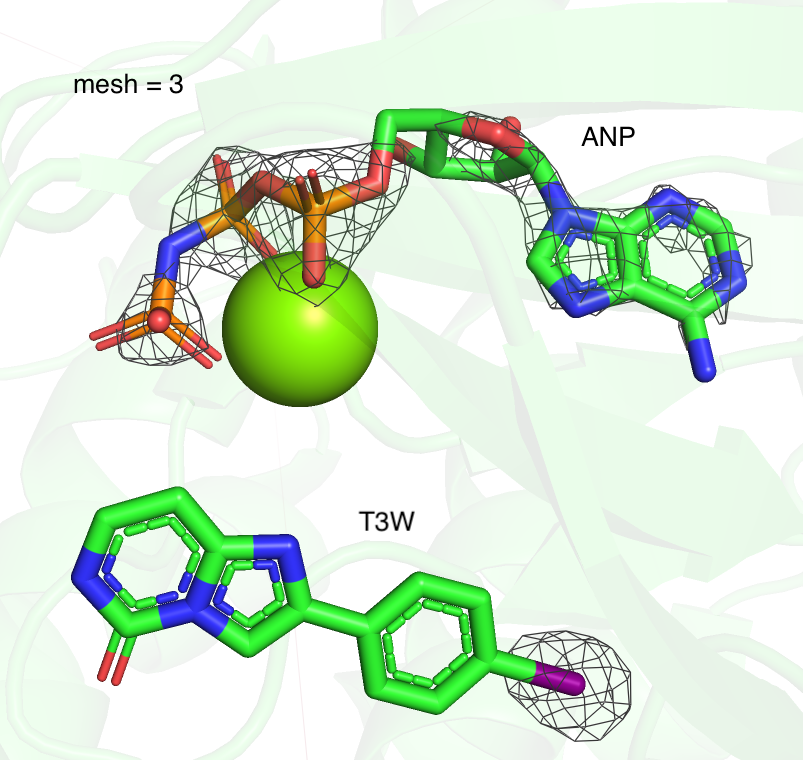
Я рассмотрела 2 лиганда моего белка (структура 7B94): ANP и T3W. Аналогично заданию 2, для неё была построена серия mesh, с разным уровнем подрезки (1, 2, 3 Рисунок 4). При увеличении параметра подрезки довольно сильно сокращается число отображаемых областей для лиганда T3W. При mesh = 3 электронная плотность сохраняется только вокруг крупного электроотрицательного атома йода. В целом наблюдается тенденция, что более плотно покрыты электроотрицательные атомы.