Я рассматривала белок под идентификатором 6KAX в PDB. Этот фермент кодирует лиганд-связывающий домент рецептора, активируемого пероксисомными пролифераторами, альфа (PPARa). PPARa относится к семейству ядерных рецепторов и является лиганд-активируемым транскрипционным фактором. Активируясь, PPARa меняет экспрессию генов, вовлеченных в бета-окисление жирных кислот. Этот важный фермент является мишенью лекарственных молекул, статинов и фибринов, прием которых приводит к уменьшению содержания триглицеридов и липопротеинов низкой плотности. Благодаря липидснижающему эффекту, эти препараты используют для снижения риска сердечно-сосудистых заболеваний. [1]
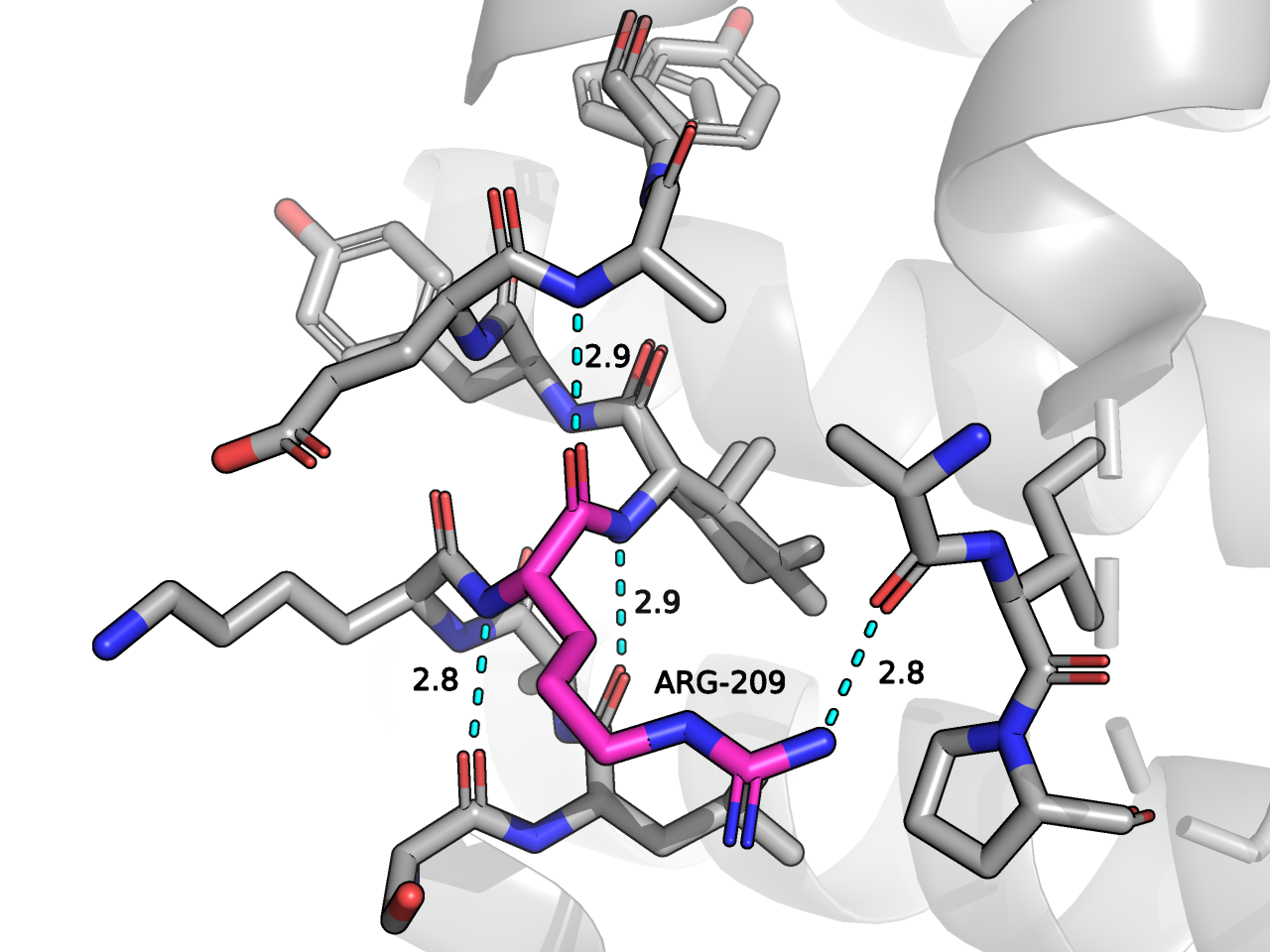
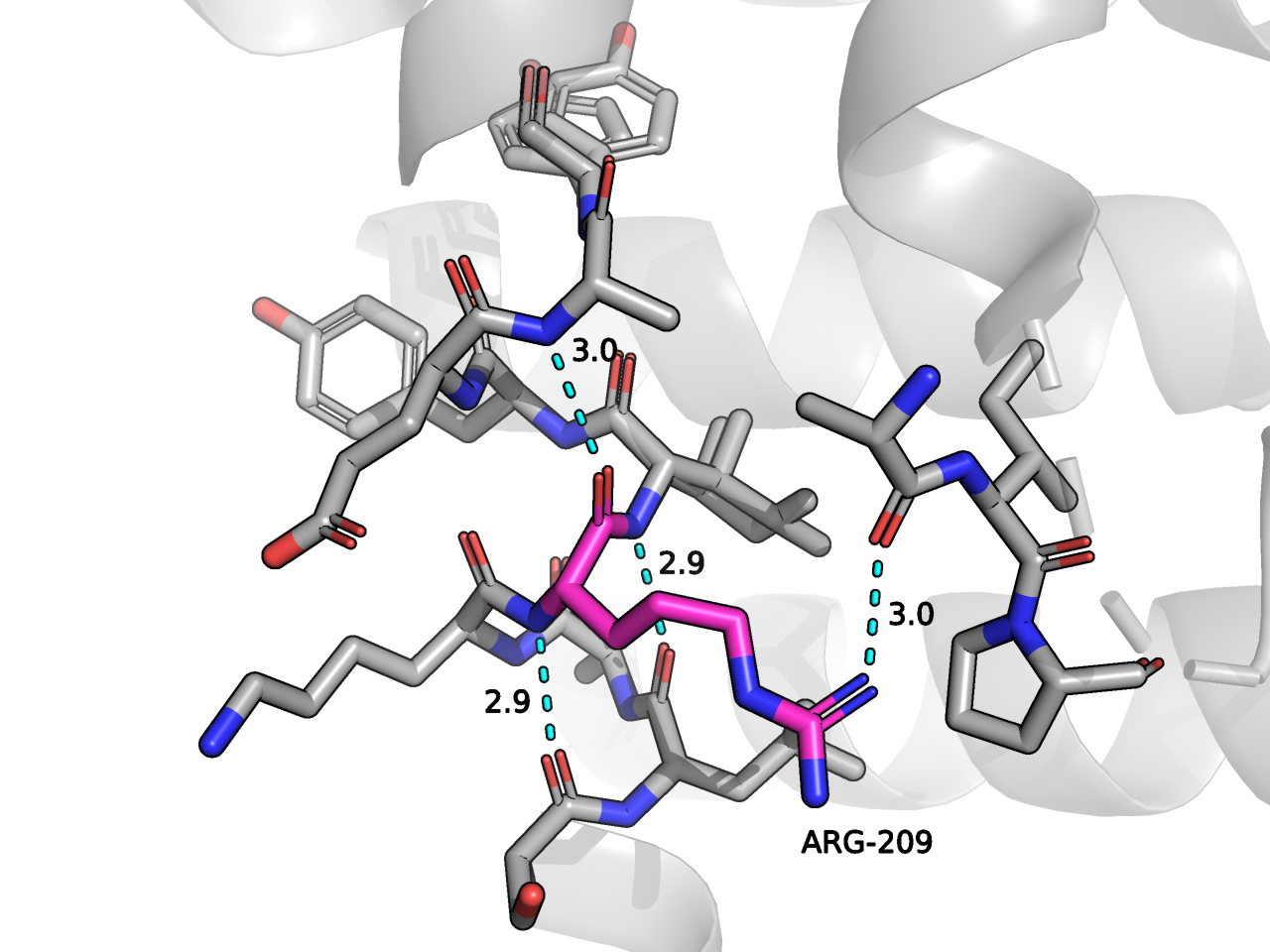
Для участков этого фермента существует несколько вариантов конформации. Я изучила альтернативные конформации остатка ARG209. Я проверила, насколько "выгодна" та или иная конформация с точки зрения взаимодействий этого остатка с окружением. Результаты представлены на Рисунке 1.


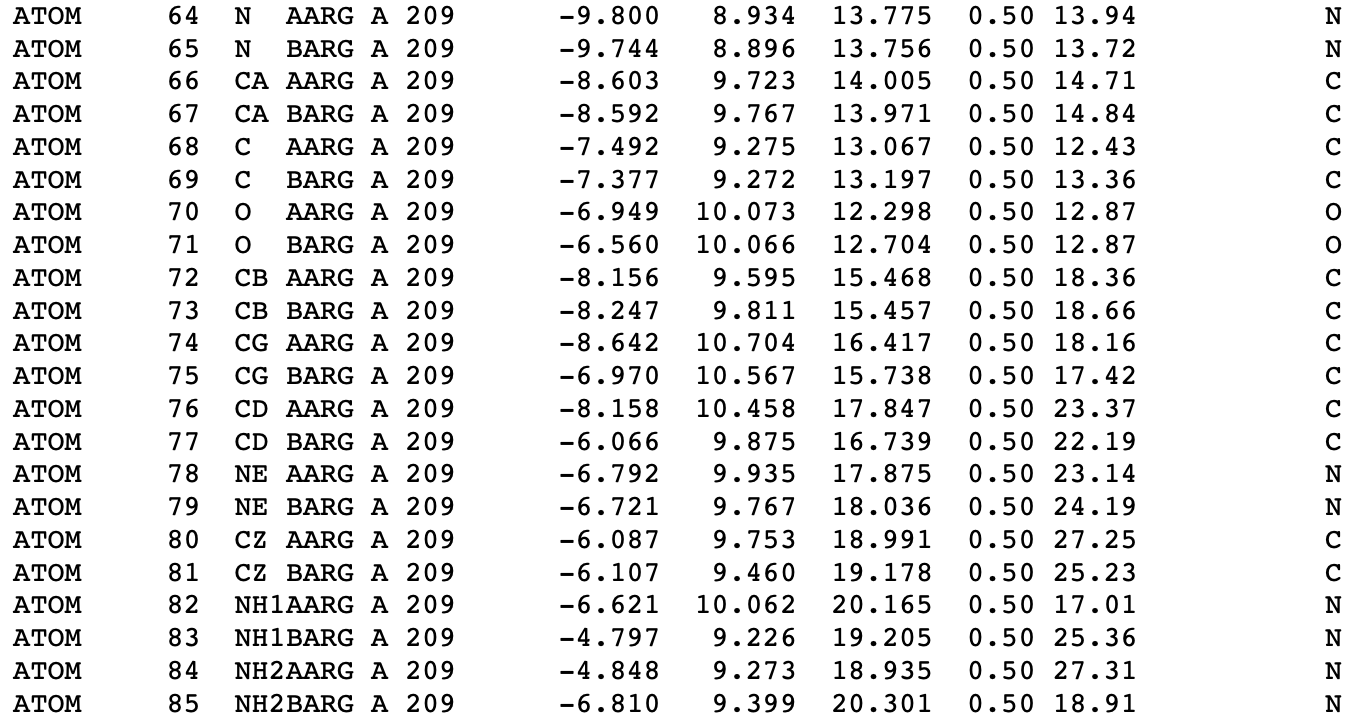
Исследуемый остаток входит в состав альфа спирали белка, и я нашла характерные водородные связи между C-O и N-H атомами белкового остова. Кроме того, образуется водородная связь между NH1 атомом ARG209 и кислородом остова. Сравнивая альтернативные структуры, я пришла к выводу, что конформации мало отличаются по взаимодействию с окружающими остатками. Я проверила свой прогноз в PDB файле и, действительно, "населенность" составляет 0.5 для обоих вариантов - ни один из них не преобладает. Фрагмент PDB-таблицы представлен на Рисунке 2 .
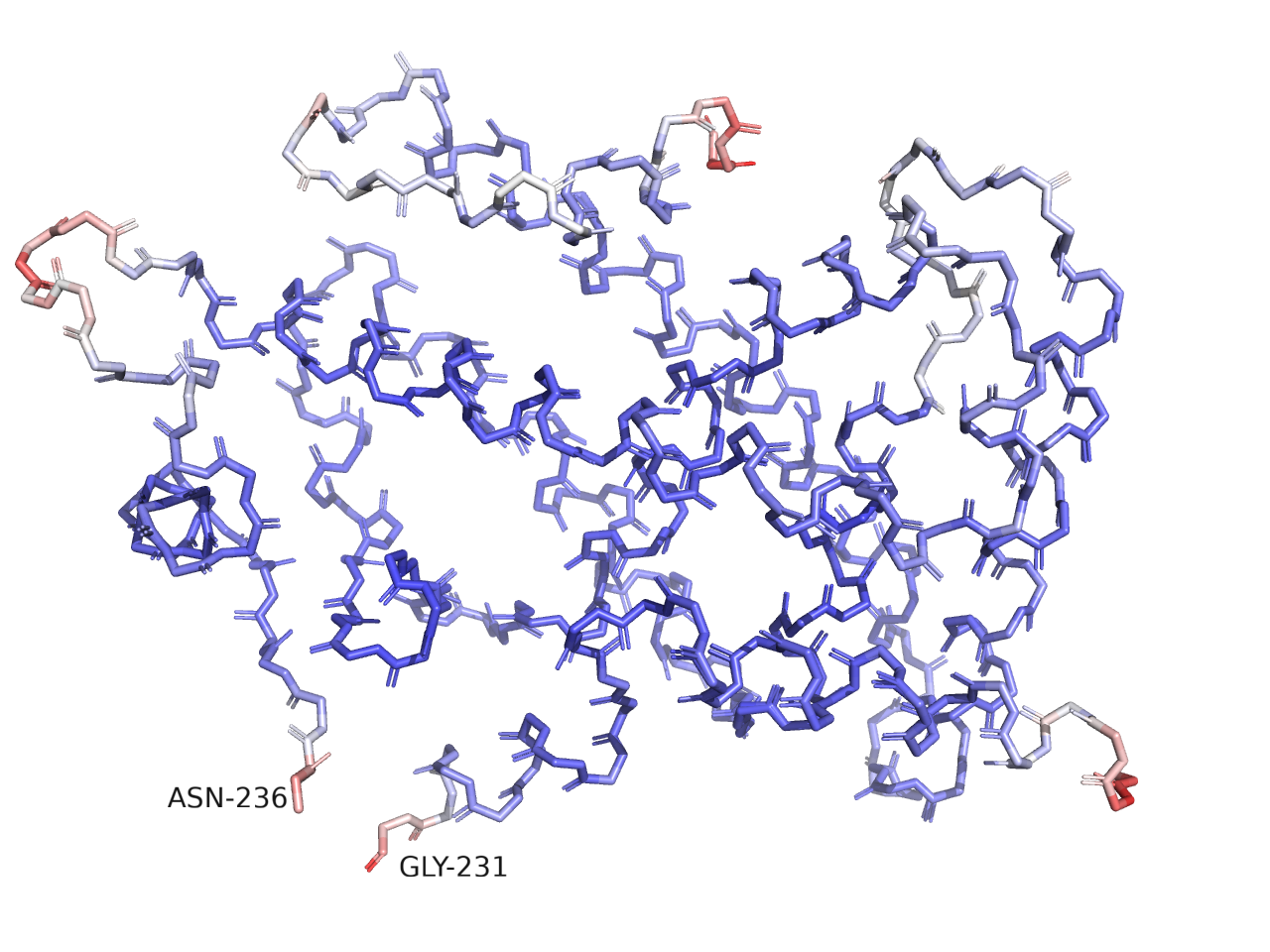
В кристаллографии неопределенность положения атомов возрастает в неупорядоченных структурах белка. Для характеристики неопределенности позиции служит B-фактор. Высокое значение B-фактора характерно для атомов с низким экспериментальным значением электронной плотности. Обычно, значение ниже 30 Å2 обозначает уверенность в позиции атома, а значения > 60 Å2 говорят о беспорядочной позиции. [2]
Для исследуемого белка 6KAX я оставила атомы остова и покрасила атомы по значению B-фактора (Рисунок 3). Атомы с низким B-фактора покрашены синим, а с выским значением - красным. Можно заметить, что выскоким значением B-фактора обладают атомы, принадлежащие поверхностным петлям, и концевым участкам. От этих участков мы как раз и ожидаем большую подвижность.
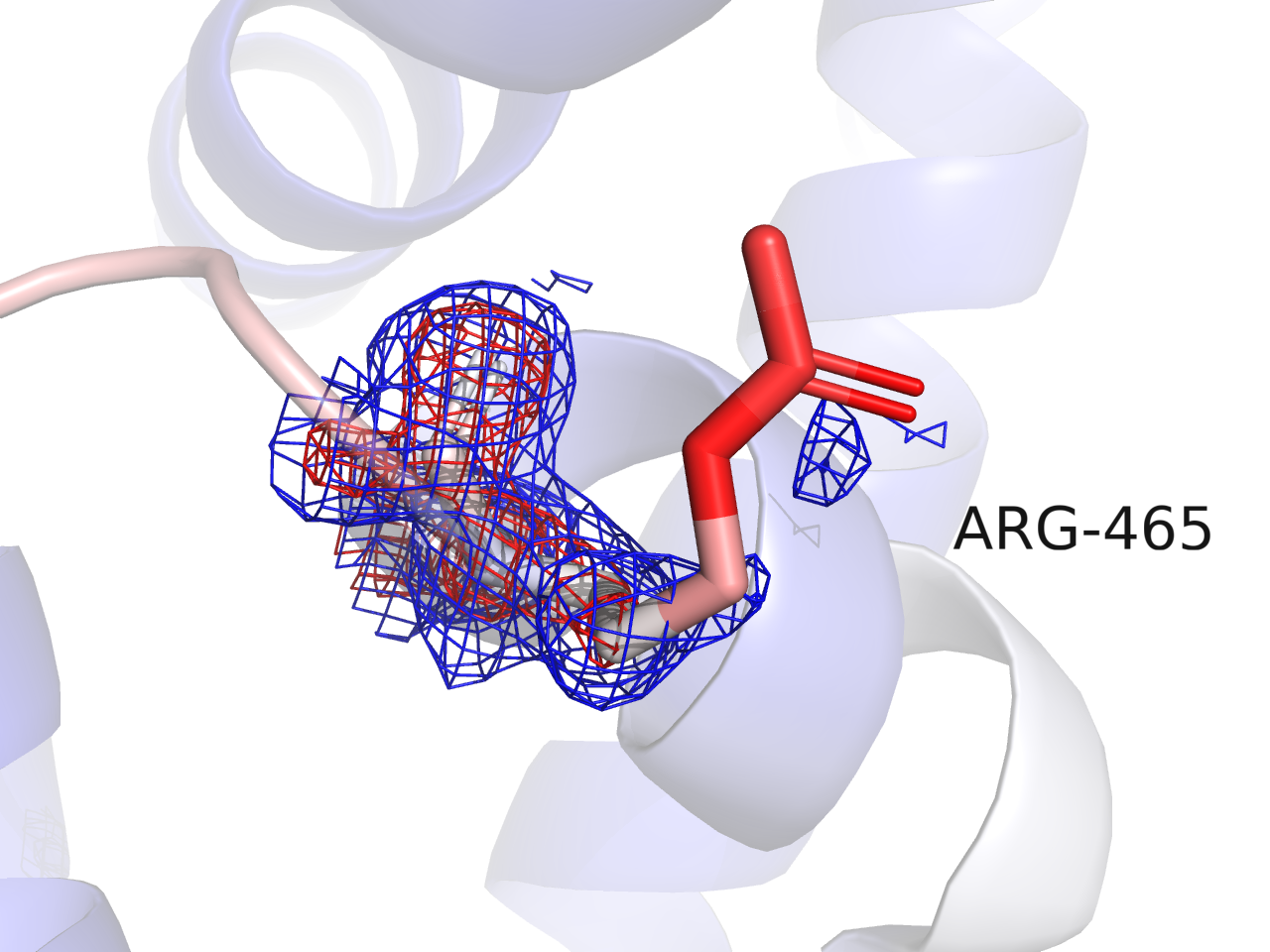
Затем я выбрала аминокислотный остаток ARG465 (Рисунок 4), поскольку его атомы обладают большим значением B-фактора. Для него была построена сетка электронной плотности для уровня подрезки 1 (синяя сетка), 2 (красная сетка) и 3 (не видна) с параметром carve = 2. Сетка не покрывает боковой цепь ARG при всех трех значениях подрезки и вариации параметра carve. Таким образом, для остатка с высокой подвижностью электронная плотность плохо определена.
Анализируемый белок находится в кристалле. Соседей в регулярной структуре можно отобразить, воспользовавшись командой symexp objects prefix, 1xyz, all, 5. При данном значении отсечки два мономера были убраны, так как находились дальше от исходного белка (дальше 5 анстрем). Структура из исходного белка и соседей представлена на Рисунке 5.
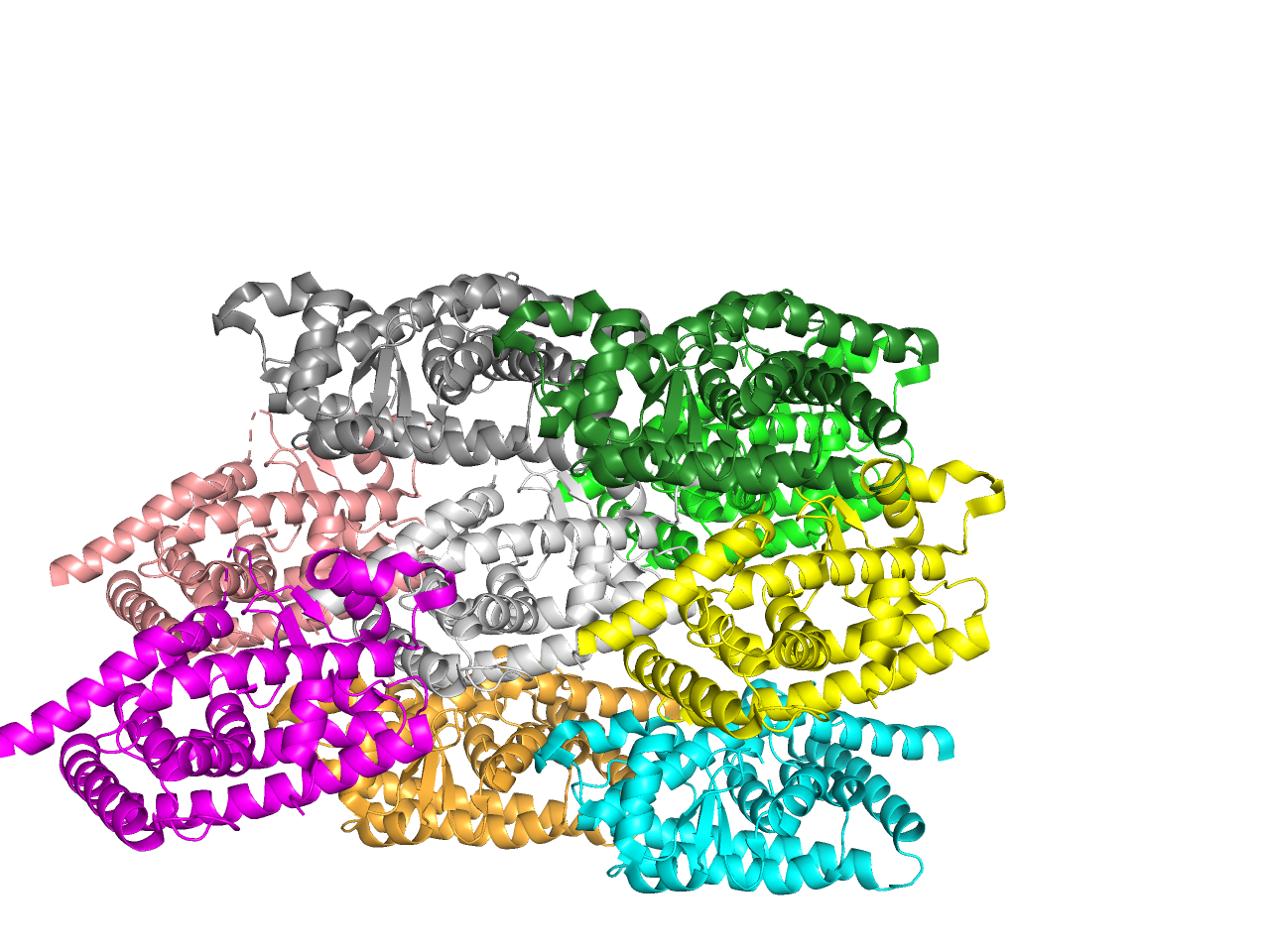
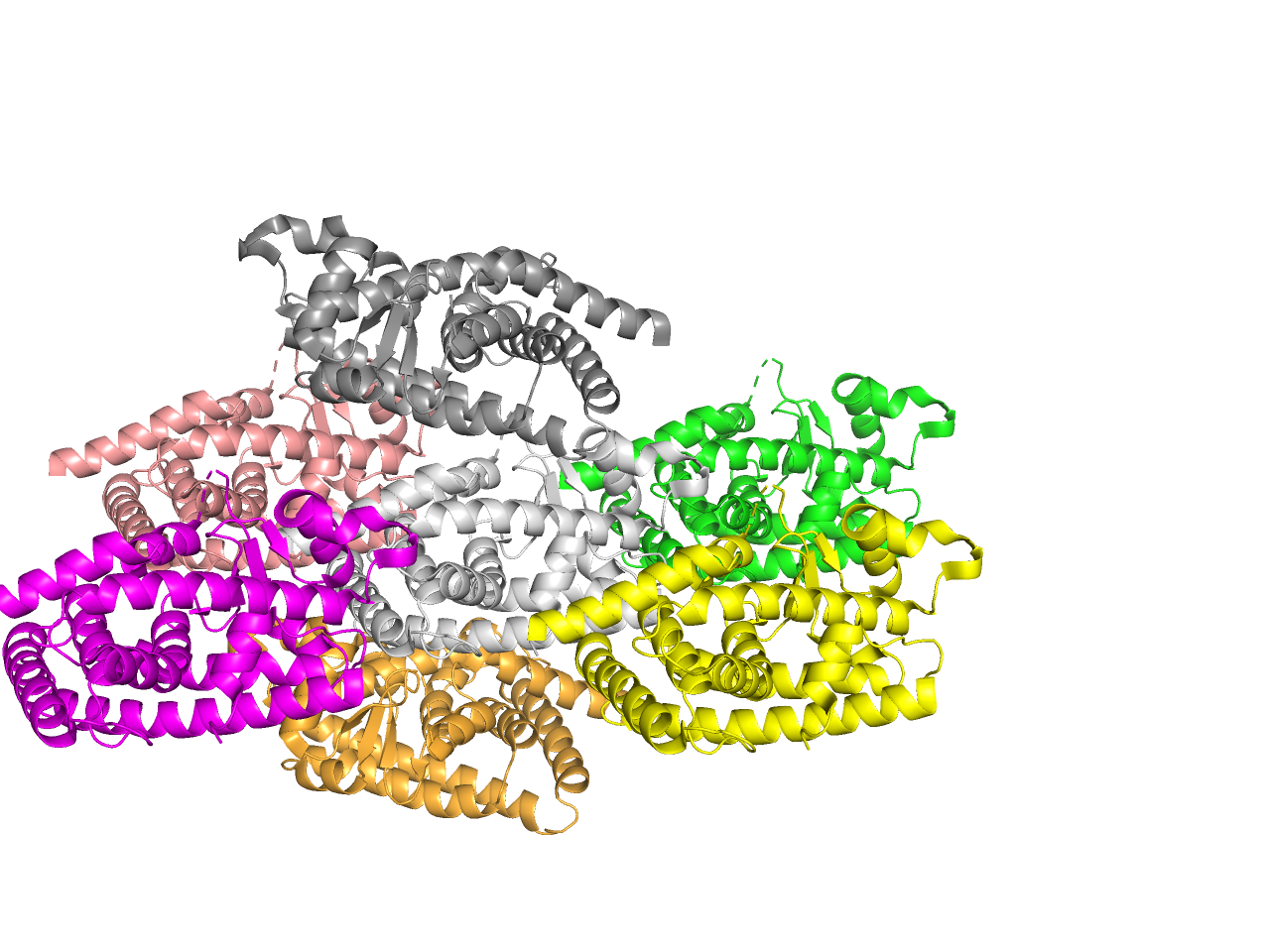
Из шести «соседей» уникальных контактов оказалось 3. Совпадают контакты белков лежащих на одной оси, проходящей через «центр» исходного белка и добавленных.
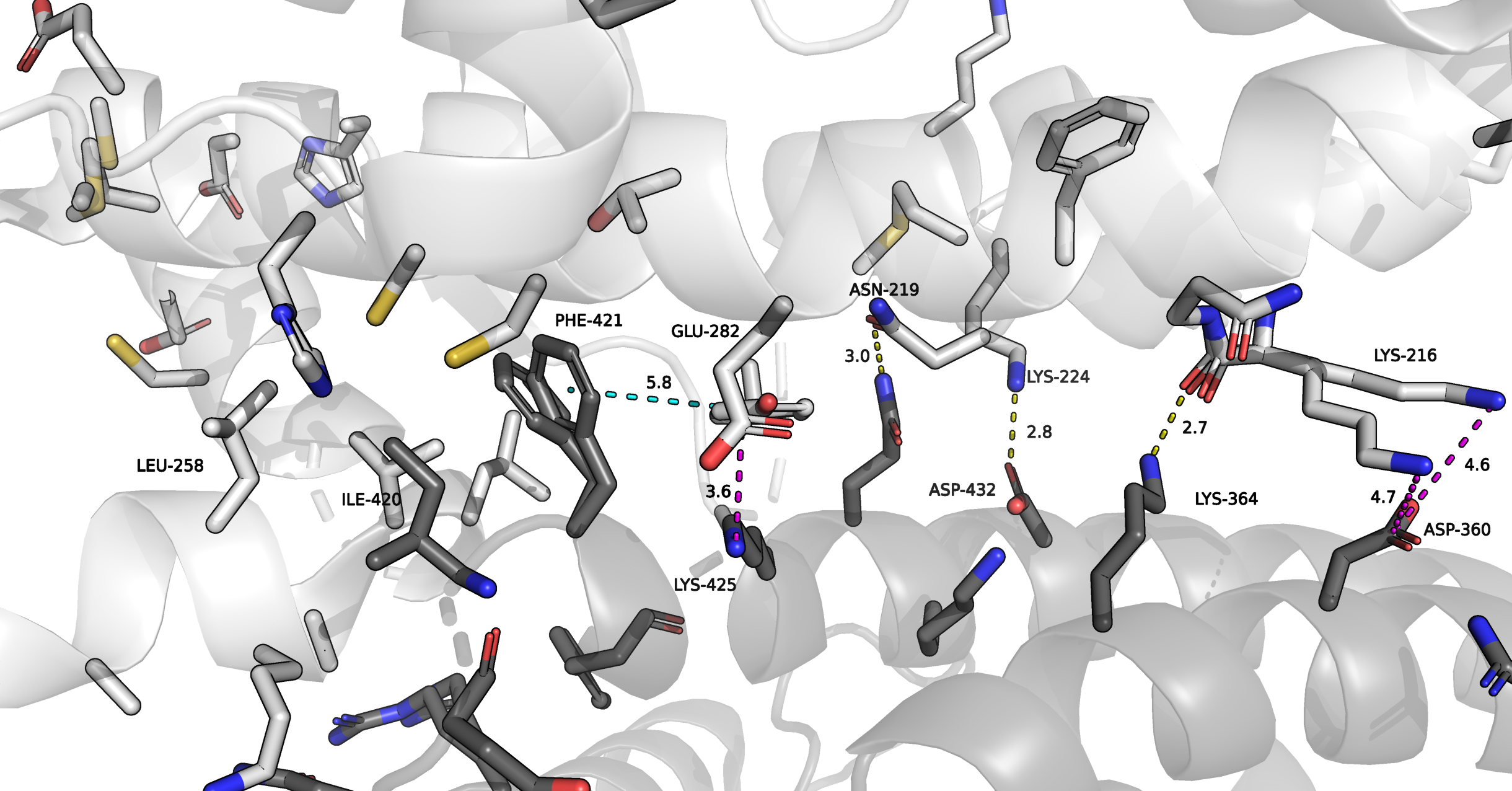
Первая зона контакта. Встречается при контакте исходного белка с мономерами, покрашенными серым и оранжевым. Наибольшая площадь контакта наблюдалась для исходного белка с мономером серого цвета. Часть взаимодействий отражена на Рисунке 6. Я нашла несколько возможных солевых мостиков, причем в роли положительно заряженного остатка во всех случаях выступает лизин. Контакт LYS-216 с ASP-360 возможен для двух альтернативных структур, однако расстояние между заряженными областями довольно большое. Кроме того, я отметила возможные водородные связи в месте контакта. На том же рисунке слева - область менее богатая на полярные связи. Здесь связь между мономерами может поддерживаться с помощью гидрофобных взаимодействий. Рядом с гидрофобными остатками PHE-421 и ILE-420 одного белка расположены VAL, LEU, гидрофобная часть LYS исходной молекулы (немного дальше в окружении однако появляются полярные группы). Также я предположила возможность T-стекинга между кольцами PHE-421 и TYR-334, хотя расстояние между ними довольно велико.
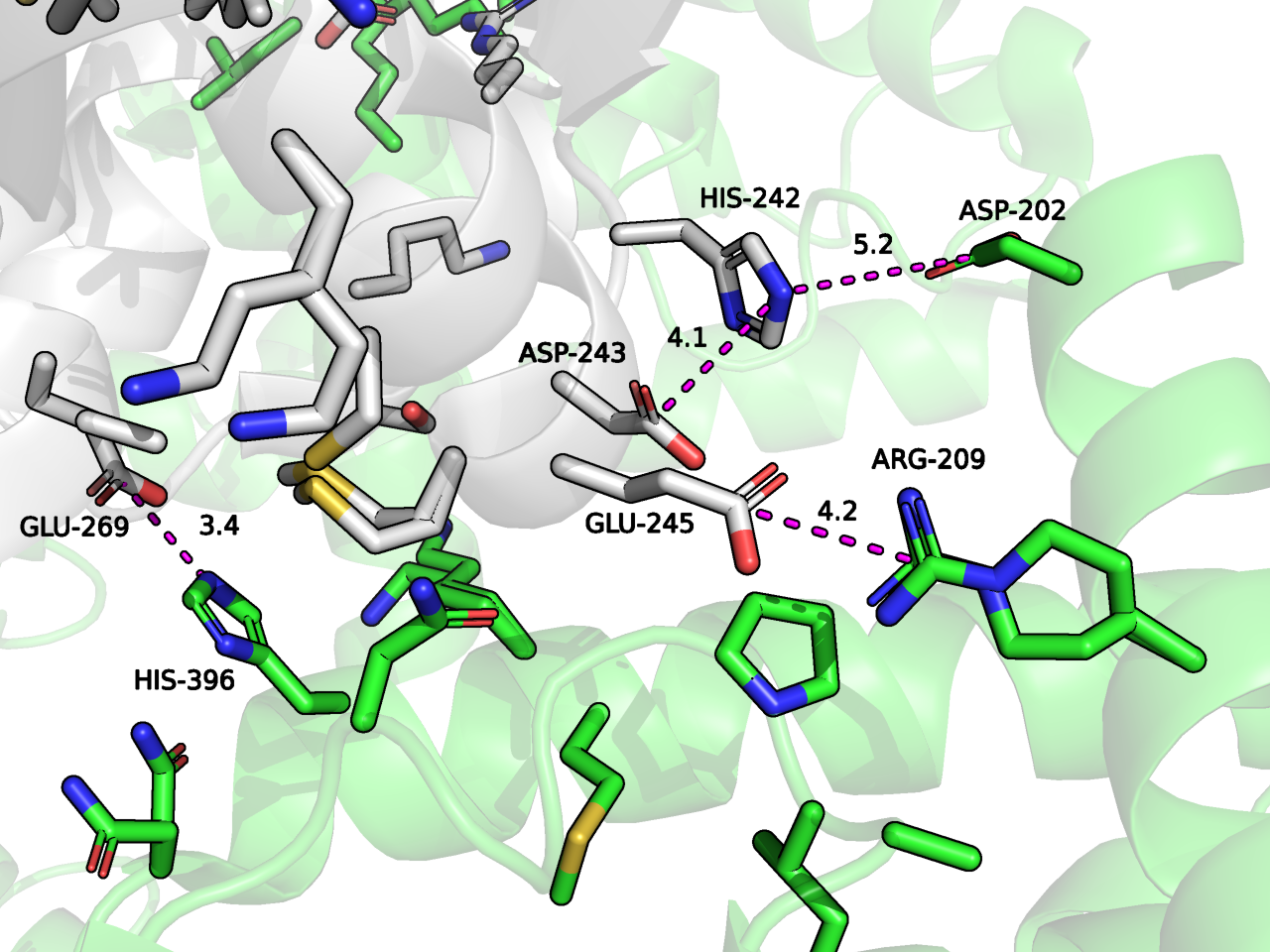
Вторая зона контакта. Bстречается при контакте исходного белка с мономерами, покрашенными зеленым и пурпурным. В этой зоне можно отметить солевые мостики, однако дистанция между ними тоже немного больше общепринятой (считается, что должна быть < 4 A [3]). Если гистидины протонированы, то они могут вступать в электростатические взаимодействия с окружающими остатками ASP и GLU. Потенциальные контакты изображены на Рисунке 7.
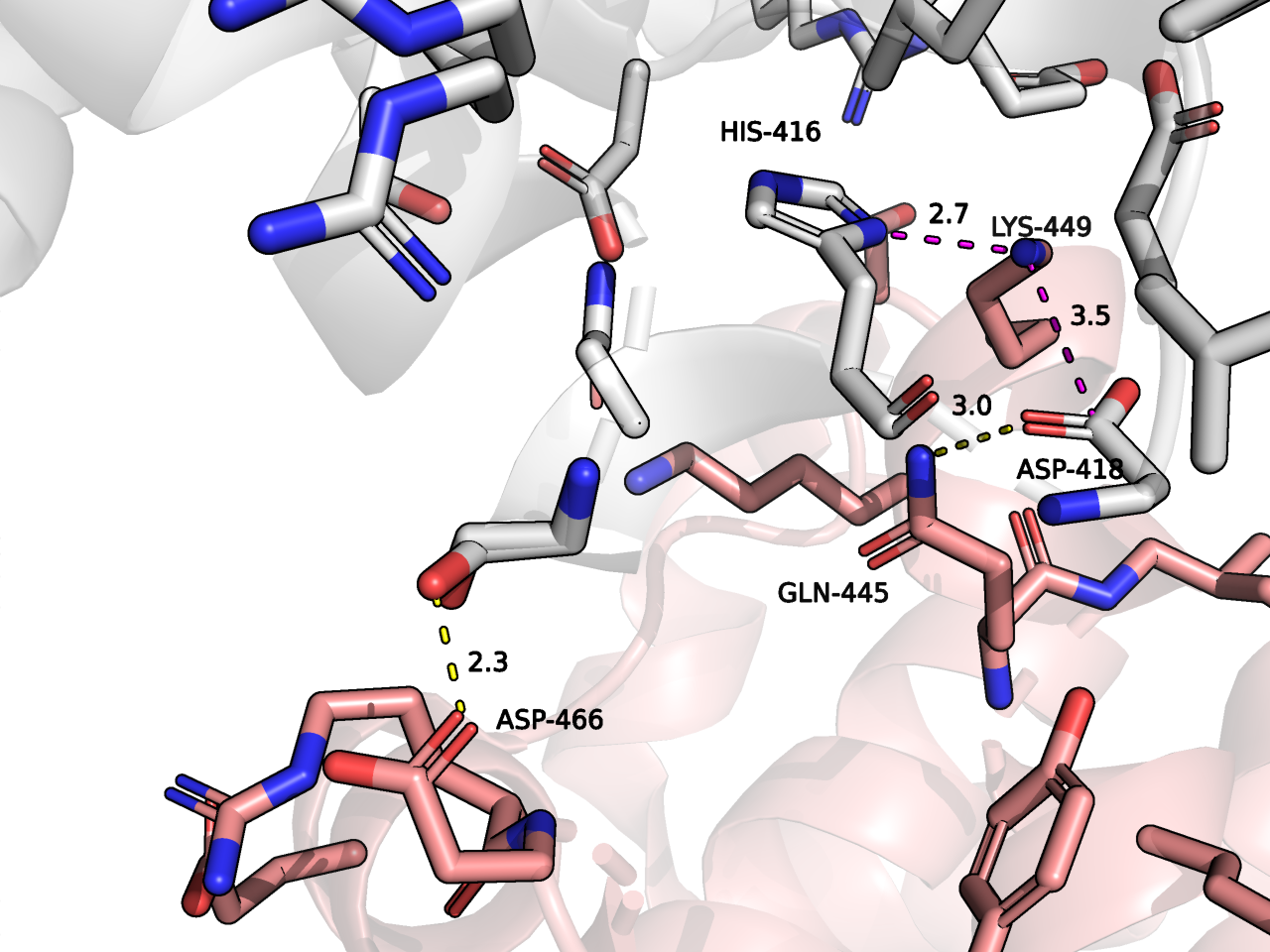
Третья зона контакта. Встречается при контакте исходного белка с мономерами, покрашенными розовым и желтым. Зона контактов небольшая (Рисунок 8). Здесь можно выделить солевые мостики между LYS-449 и остатками HIS-416 (если протонирован) и ASP-418. Также я отметила водородные связи.
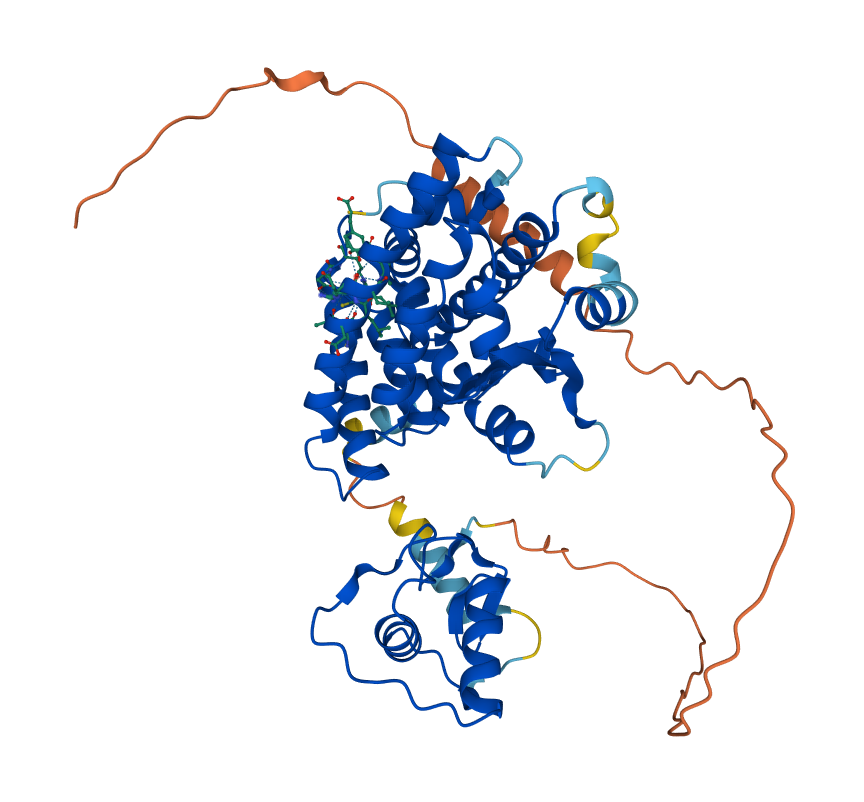
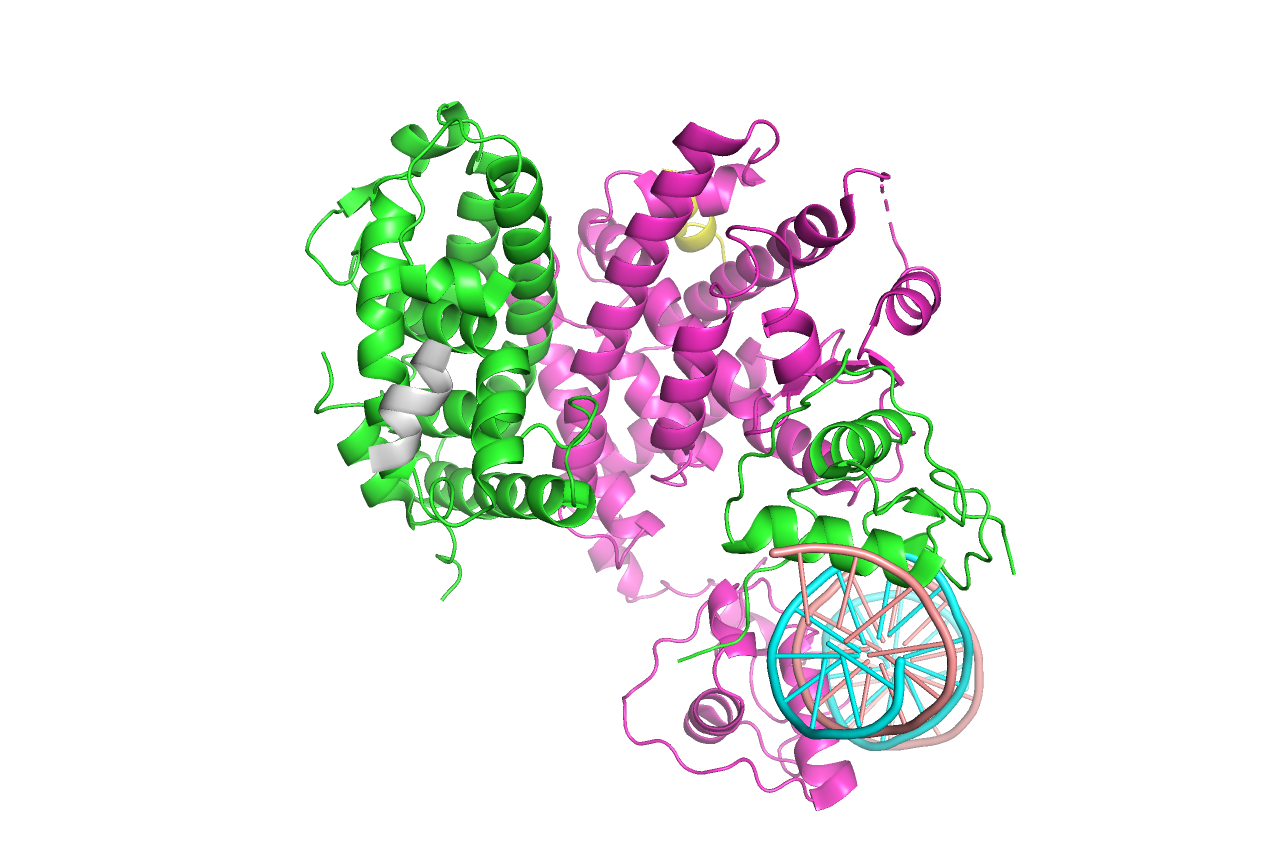
В отличие от ядерных рецепторов гормонов, PPAR не димеризуется, а формирует гетеродимер с ретиноид X рецептором (RXR). [4] При этом моя структура 6KAX включается в себя только лиганд-связывающий домен рецептора PPARa, а не весь белок. В PDB хранятся еще 55 структур с позиции лиганд-связывающего домена с позиций примерно с 200 по 468, а полная структура только одна - по предсказанию AlphaFold (Рисунок 9). Точность прогноза многих участков оценивается как высокая для консервативных участков. Также известно, что лиганд-связывающие домены беков семейства PPAR очень похожи. [5] Чтобы прикинуть расположение других доменов (ДНК-связывающего), можно посмотреть на PPAR гамма в комплексе с RXR (PDB 3E00) на Рисунке 10.
Если говорить о теоретической возможности димеризации конкретно рассмотренного лиганд-связывающего домена, а не всего белка, то комплекс, как в кристалле, вряд ли будет возникать. Поверхности контактов не очень большие, наблюдаются довольно крупные щели, куда может попасть много молекул растворителя. Я заметила, что полярные группы в местах контакта образуют довольно много связей с водой. Водородные связи могут образовываться не между остатками мономеров, а между полярными группами и молекулами воды, что не приведет к формированию комплекса. Соляные мостики чувствительны к окружению. Притяжение противоположных зарядов может быть экранировано полярными молекулами воды, и вместо контакта тогда будут наблюдаться две отдельные сольватированные заряженные группы. Кроме того, в живой клетке окружение белка содержит не только воду, но и ионы и другие ко-растворители. Свободные ионы также могут экранировать заряды и образовывать пары с аминокислотными остатками. [6]
Сcылки:
[2] Macromolecular Crystallography
[3] Close-range electrostatic interactions in proteins
[4] The Mechanisms of Action of PPARs
[5] Scaffold-Based Pan-Agonist Design for the PPARα, PPARβ and PPARγ Receptors
[6] Salt Bridge in Aqueous Solution: Strong Structural Motifs but Weak Enthalpic Effect