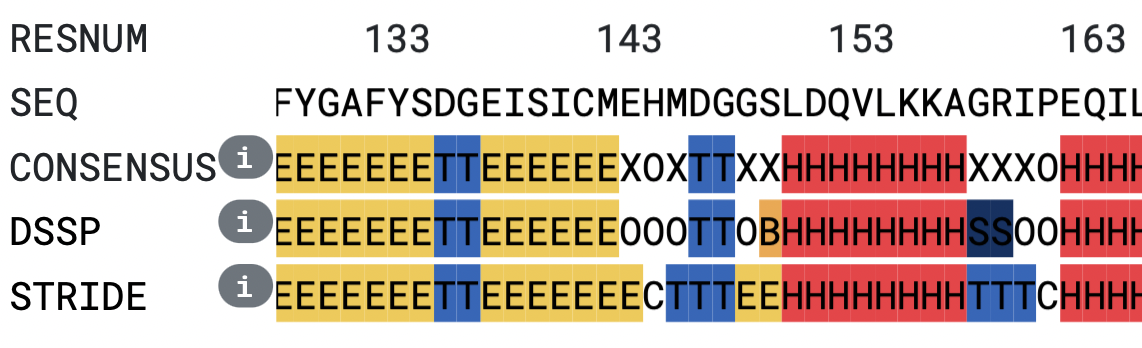
Для структуры 7b94, которую я ранее анализировала а практикуме 2, была сгенерирована аннотация вторичной структуры с помощью 2Struc . Я сравнивала разметку, предложенную алгоритмами DSSP и STRIDE. В числе различий STRIDE и DSSP разные способы определения водородных связей, а также проверка углов в случае алгоритма STRIDE.
Хочу заметить, что аннотация похожа у двух программ. Различия в основном наблюдались при классификации остатков, принадлежащих концам альфа-спиралей и бета-структур. Также расхождения периодически наблюдались в разметке поворотов, бета-мостиков и изгибов (bend). Рассмотрим некоторые ситуации подробнее.
GLU-144 не отмечен как остаток бета-тяжа в DSSP, однако считается его продолжением по мнению STRIDE (Рисунок 1). В алгоритме DSSP мостик между i и j остатком в антипараллельном листе считается по формуле Bridge(i,j) =: [Hbond(i,j) and HBond(j,i)] или [Hbond(i-1, j+1) and HBond(j-1, i+1)]. Получается, что GLU-144 по DSSP мостиком не будет, так как его кислород остова развернут и остаток не образует требуемого паттерна из двух водородных связей. В рассматриваемом случае образуется одна остовная водородная связь между азотом GLU-144 и кислородом GLY-128. Кроме того, здесь встречается структура, называемая бета-выступ - нарушение, которое нередко встречается в антипараллельных бета-структурах. [1]
В данном случае я согласна с DSSP и считаю, что последним остатком должен считаться остаток под номером 143. GLY-144 скорее уже не считается частью бета-структуры, я не увидела в нем требуемого паттерна для водородных связей в бета-структуре. GLY-128, с которым у него обнаруживается водородная связь, обоими алгоритмами отнесен к Other/Coli, что верно.

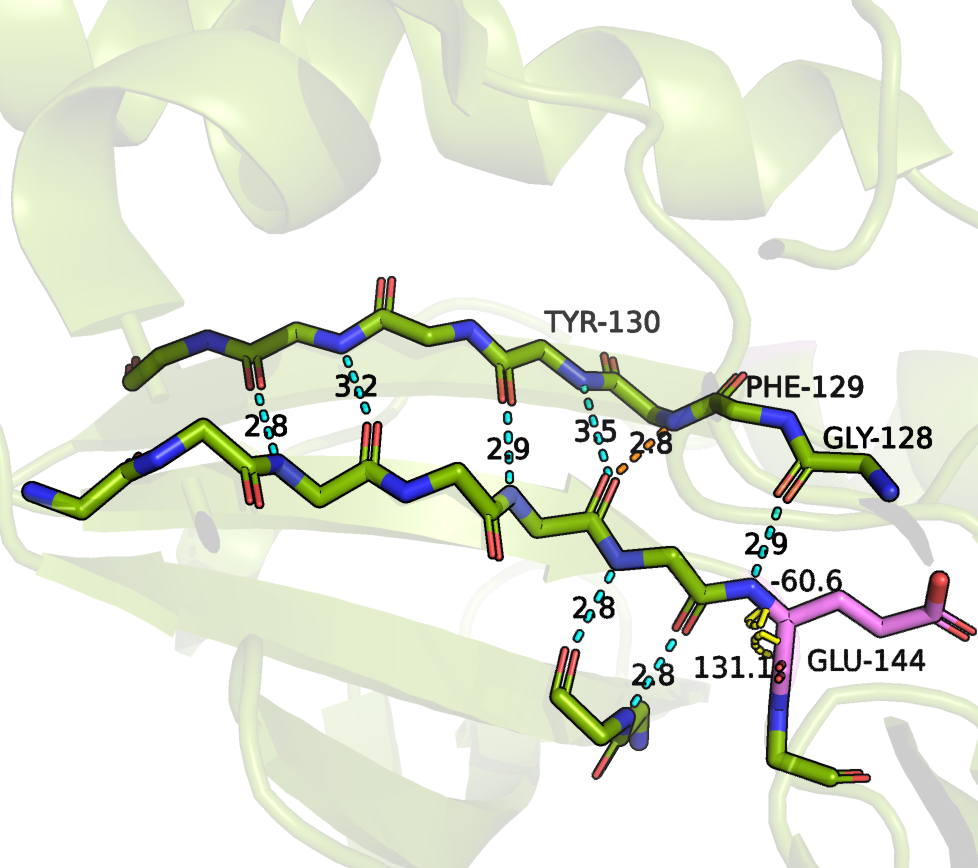
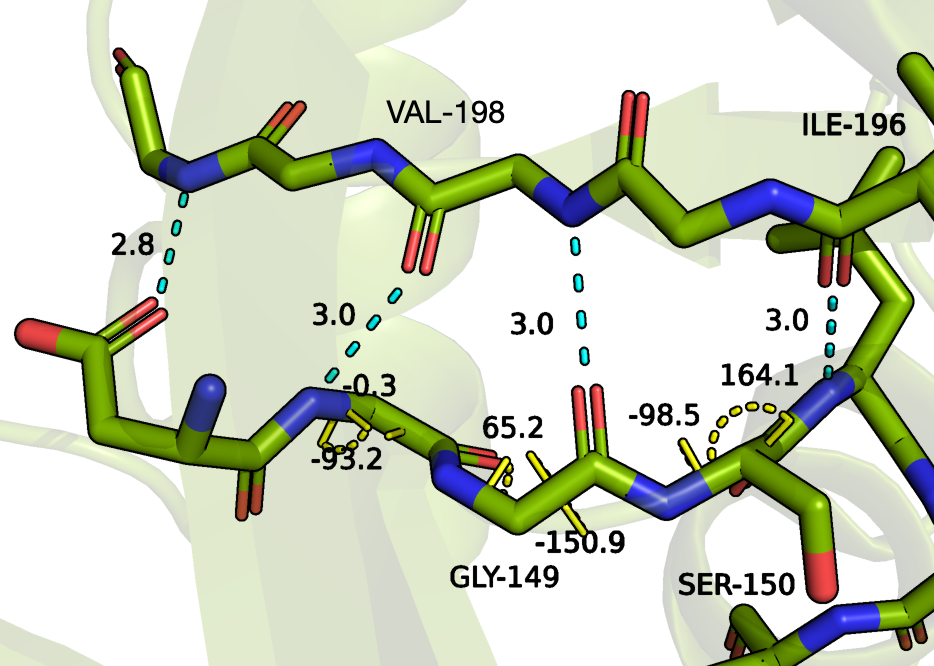
Позиции 149 и 150 были определены STRIDE как бета-структуры. Наблюдаемый участок действительно похож на связанные бета-тяжи (Рисунок 2). Остаток SER-150 по углам попадает в разрешенную область, определенную для бета-структур, что нельзя сказать про GLY-149, и в целом глицин дестабилизирует бета-структуры. Атом азота GLY-149 не будет образовывать водородную связь с кислородом остова VAL-198. Здесь я склоняюсь к версии STRIDE, по которой остаток 150 является бета-мостиком (единичный фрагмент, а котором обнаруживаются паттерны бета-структуры), а GLY-149 не относится к определенному типу вторичной структуры. Определение STRIDE могло оказаться правильным из-за учета углов.
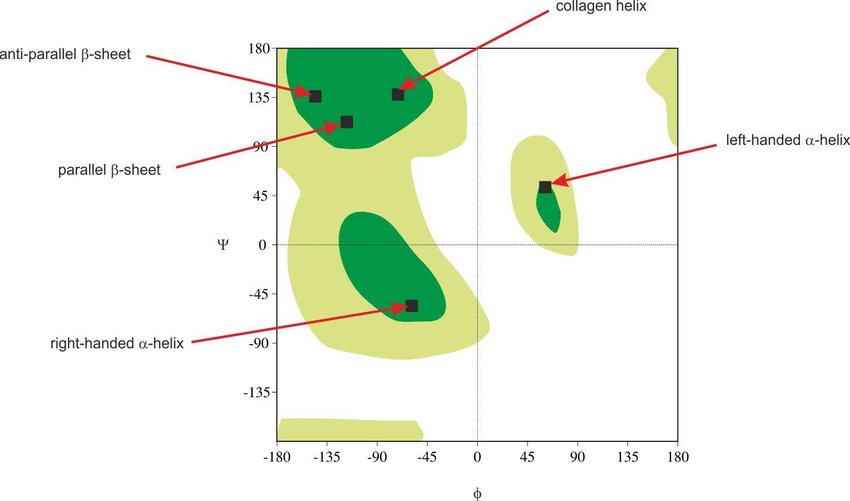
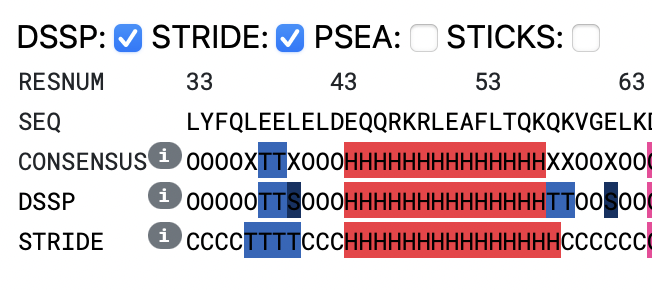
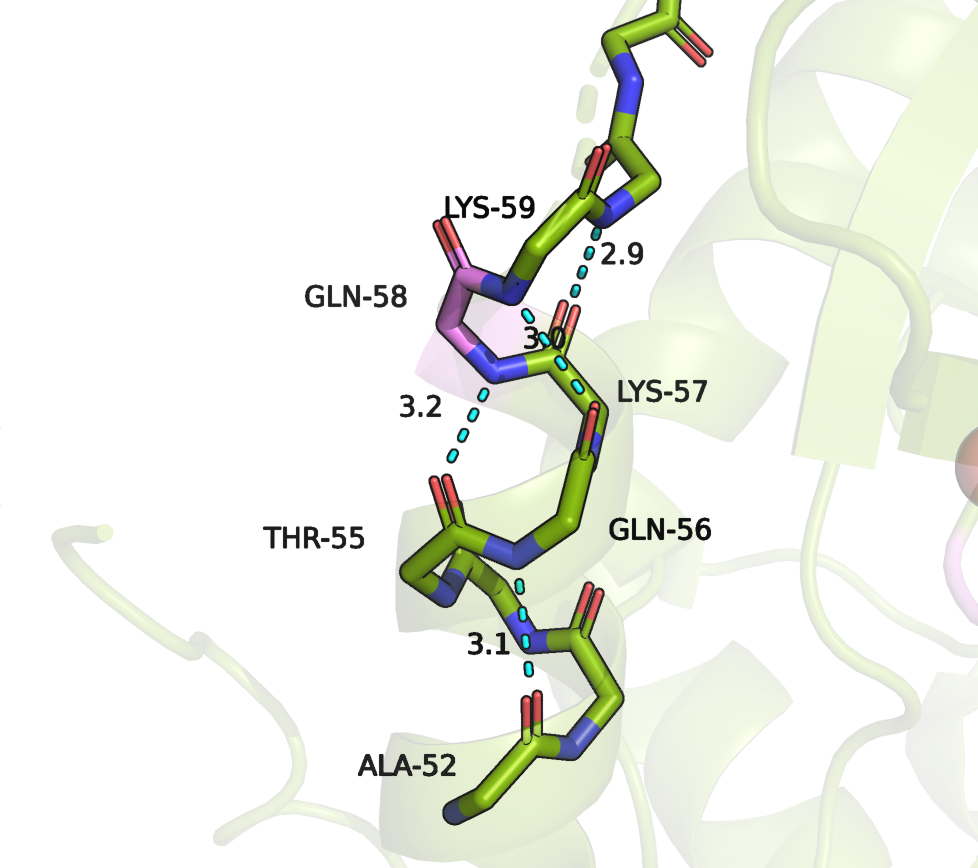
В третьем примере были по-разному размечены концы альфа спирали. На Рисунке 3 можно увидеть, что начиная с THR-55 (i), расстояние между C-O [i] и N-H [i+4] LYS-59 велико, и водородной связи не будет в этом случае. Здесь возможна связь между 55 и 58 остатками, 56 и 59, 57 и 60 остатками (i и i + 3). Я склоняюсь к тому, что LYS-57 - последний остаток в спирали, так как он еще участвует во взаимодействии с остатком под номером 53 [i-4]. Остатки 58 и 59 по результатам моих изменений попадали в области, характерные для 3,10-спиралей. В данном случае я скорее согласна со DSSP, что GLN-58 и LYS-59 - это повороты.
Я рассмотрела набор из 30 белков и для каждого сгенерировала разметку вторичной структуры с помощью DSSP. Данные из разных белков были объединены в один набор, и для каждого типа аминокислоты была посчитана метрика popensity, которая отражает склонность к образованию определенной вторичной структуры. Для подсчета использовалась следующая формула:
P_ik = (n_ik/n_i) / (N_k/N),
P_ik - это propensity аминокислотного остатка i образовывать тип вторичной структуры, n_ik - это количество остатков i в датасете, образующих тип вторичной структуры j n_i - это общее количество остатков i в датасете N_k - это общее количество остатков, образующих тип вторичной структуры j во всем датасете N - это общее количество остатков в датасете
Использовалсь упрощенная классификация, по которой считалось, что остаток может принадлежать к трем классам вторичной структуры: "E" (бета тяж), "H" (альфа-спираль), "C" (другое). Таблицу можно загрузить по ссылке: Таблица (.tsv)
[1] The beta bulge: a common small unit of nonrepetitive protein structure
[3]The Supramolecular Chemistry of β-Sheets