Макромолекула представляет из себя консервативный гипотетический белок локуса AF2008.
Этот белок состоит из двух полимерный цепей A и В, идентичных по аминокислотному составу, но незначительно отличающихся расположением малых молекул.
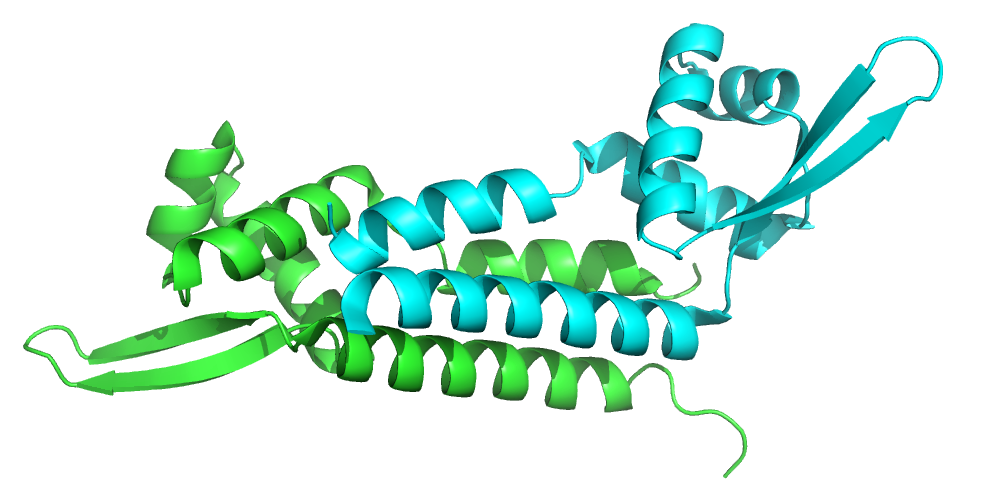
Данная макромолекула принадлежит Archaeoglobus fulgidus, ее uniprot_id O28271. Это консервативный гипотетический белок AF2008 с не определенной функцией. Относительно референса из Uniprot последовательность содержит 3 мутации. Так же в цепи есть модифицированные аминокислотные остатки (MET)
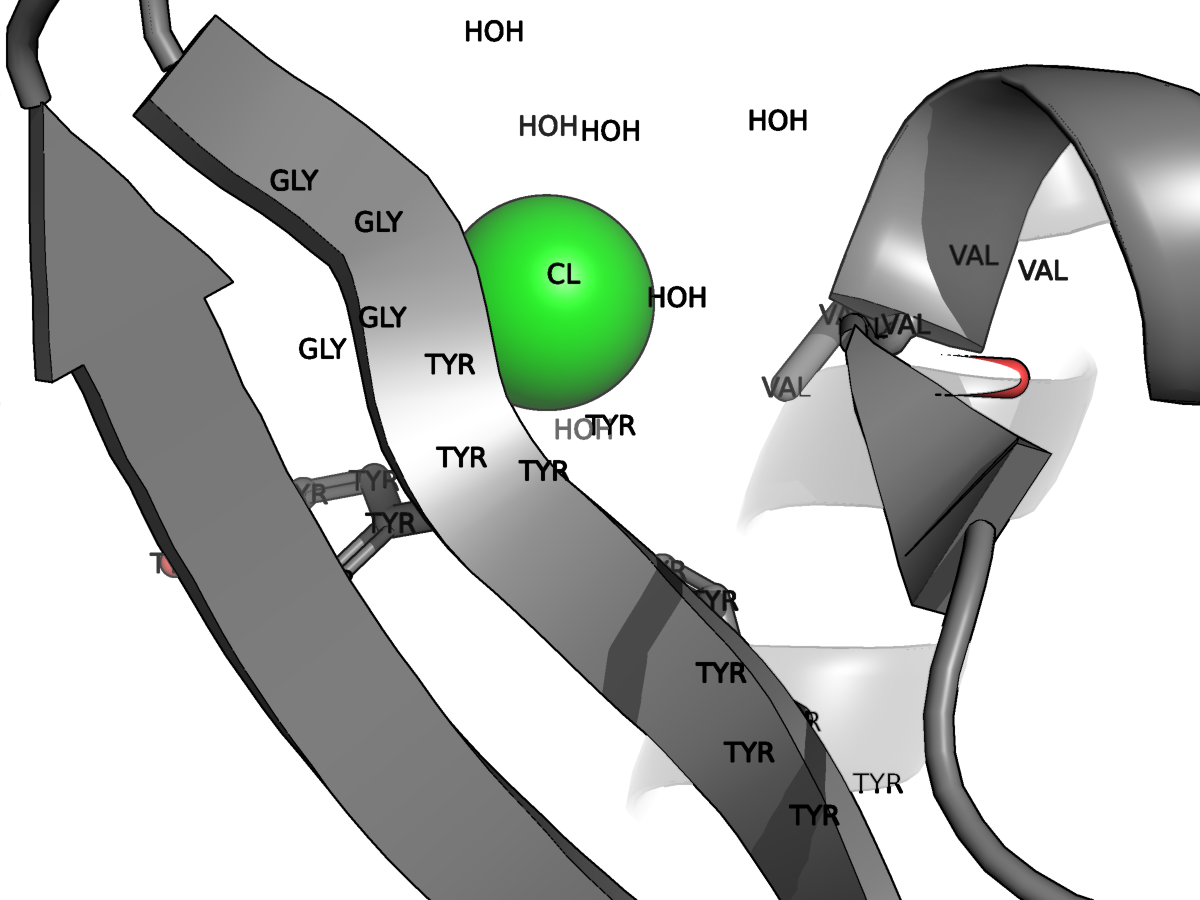
Последовательность содержит 2 малых молекулы: хлорид-ионы (CHLORIDE ION, CL) и молекулы этиленгликоля (1,2-ETHANEDIOL, EDO). Ссылки на файлы с соответствующими строками из PDB: хлорид-ионы , молекулы этиленгликоля.
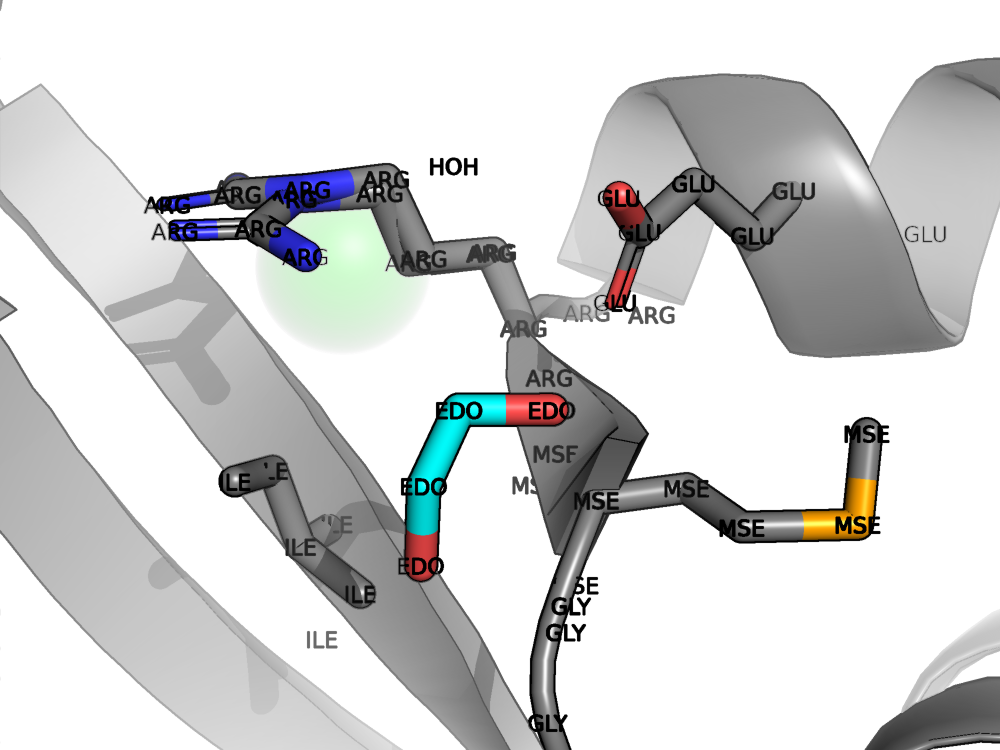
Водородная связь, затрагивающая атомы остова белка
Вторичные структуры белка - α-спирали, β-слои - формируются при участии водородных связей между участками пептидного остова.
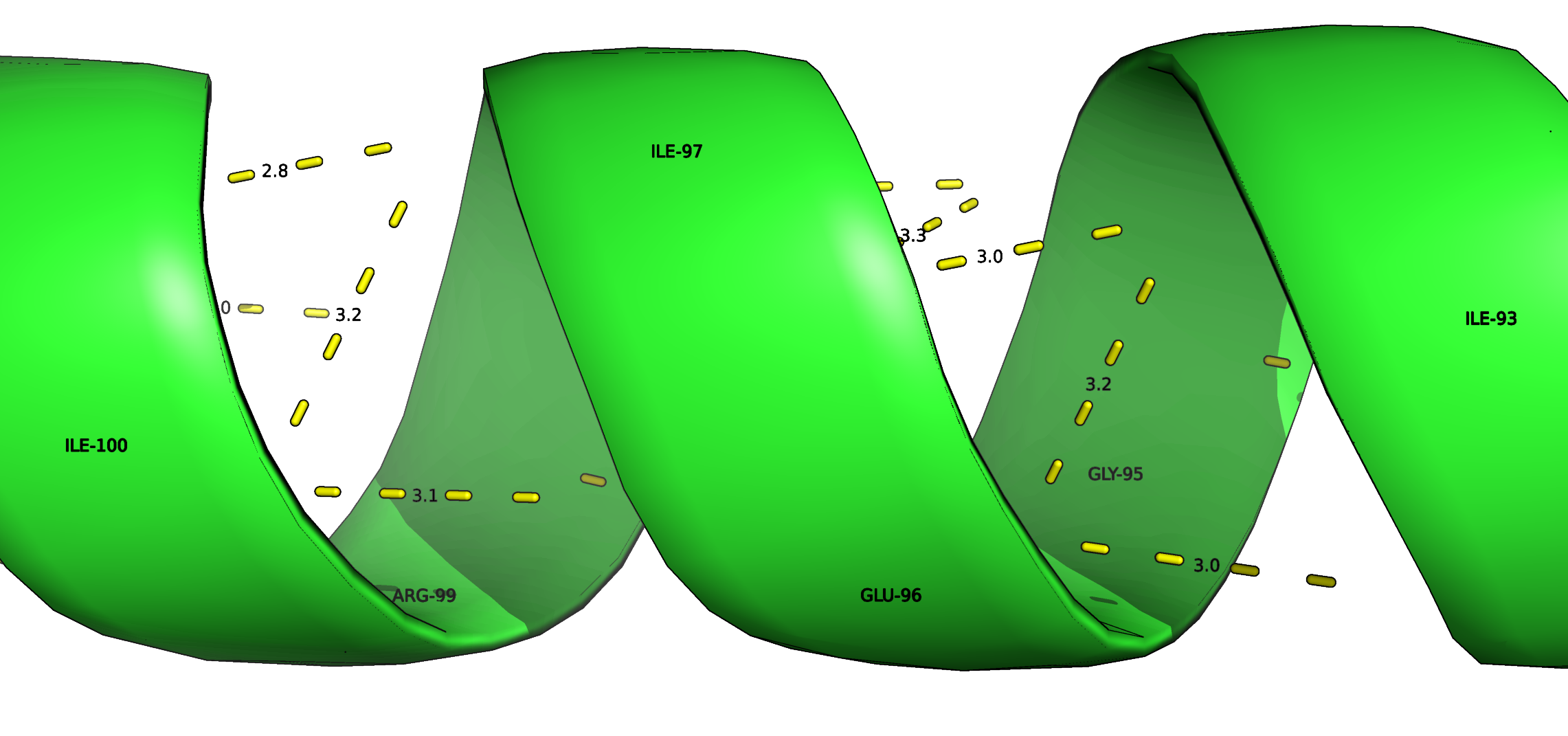
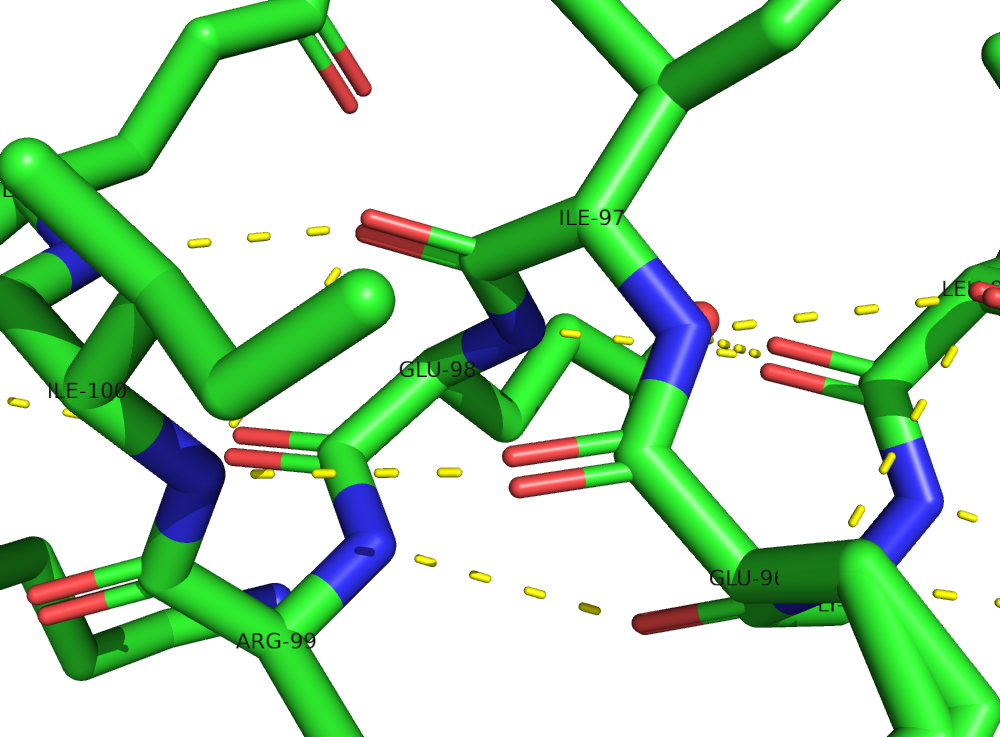
Рисунок 6. Водородные связи в α-спирали. Длины связей указаны в ангстремах. Рисунок 7. Водородные связи между аминогруппой изолейцина(ILE-100)
и карбоксильной группой изолейцина (ILE-97). Длины связей указаны в ангстремах.Водородная связь, затрагивающая атомы боковых радикалов аминокислот
Водородные связи, затрагивающие атомы боковых радикалов аминокислот обычно участвуют в формировании третичной структуры белка. Водородная связь является разновидность донорно-акцепторной. Расстояние между донором и акцептором: 2.5-3.5A.
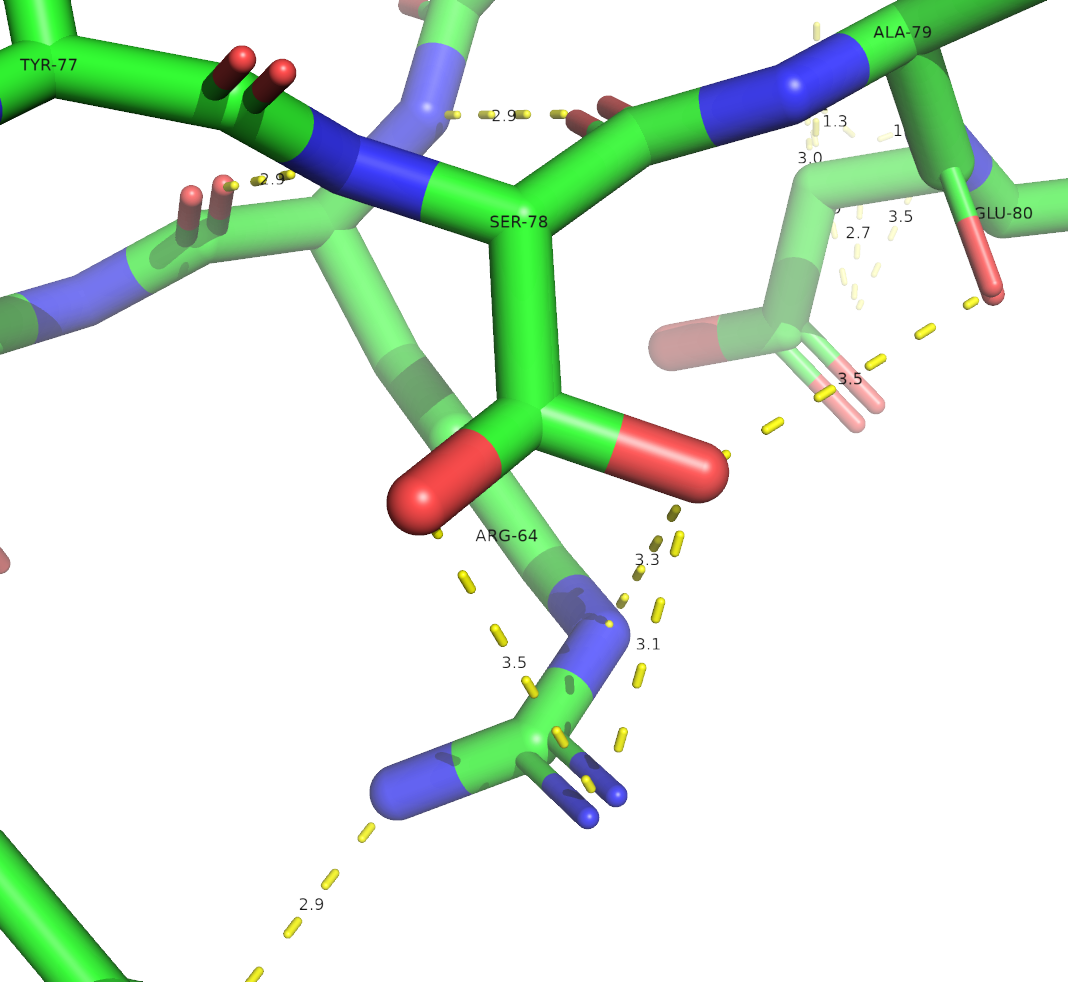
Солевой мостик
Солевой мостик - это ионная связь между боковыми карбоксильными группами и аминогруппами. Солевые мостики участвуют в формировании третичной структуры белка. Расстояие между противоионами: 3-4.5A.
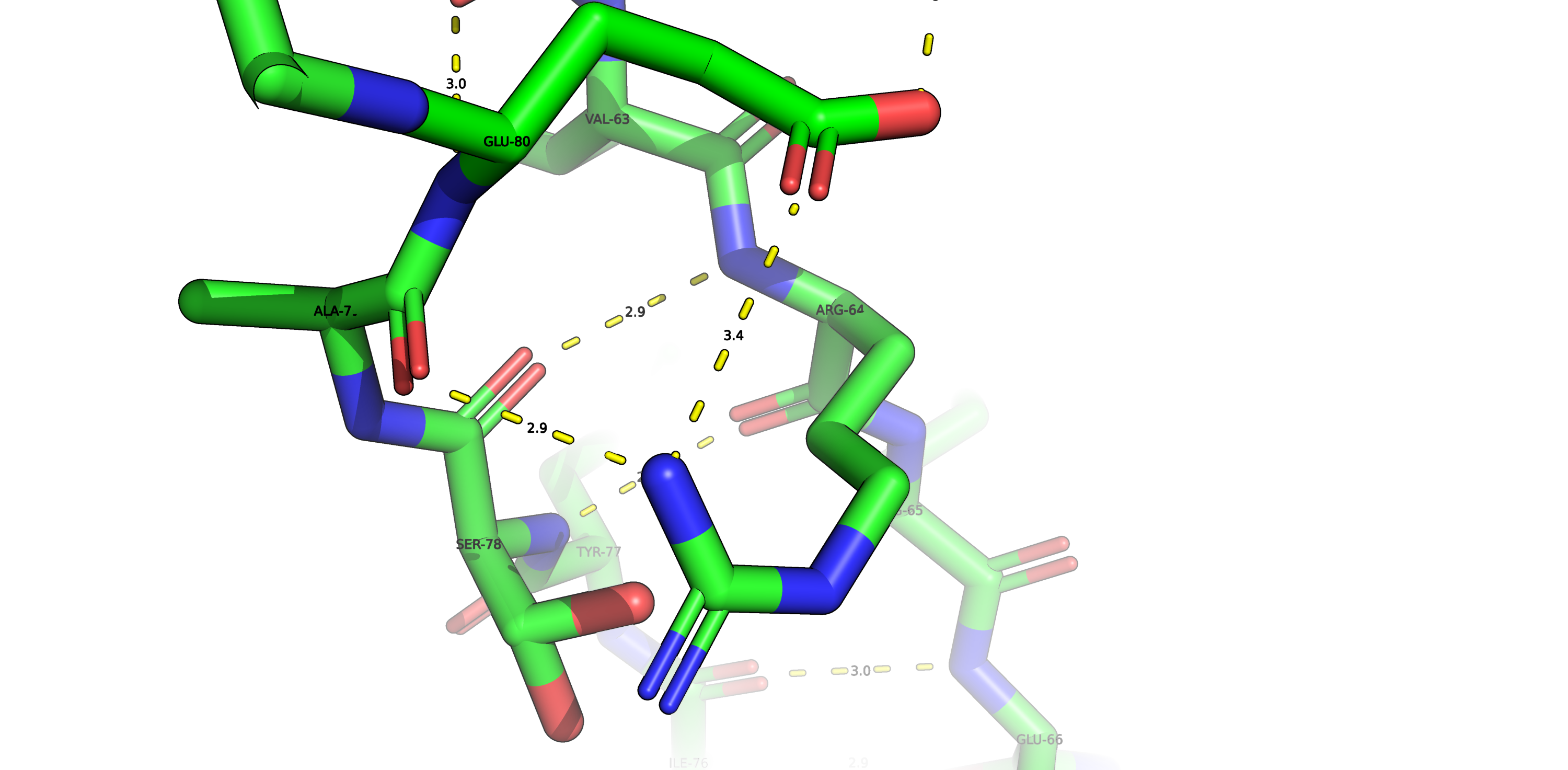
Дисульфидная связь
Дисульфидная связь образуется между атомами серы цистеинов
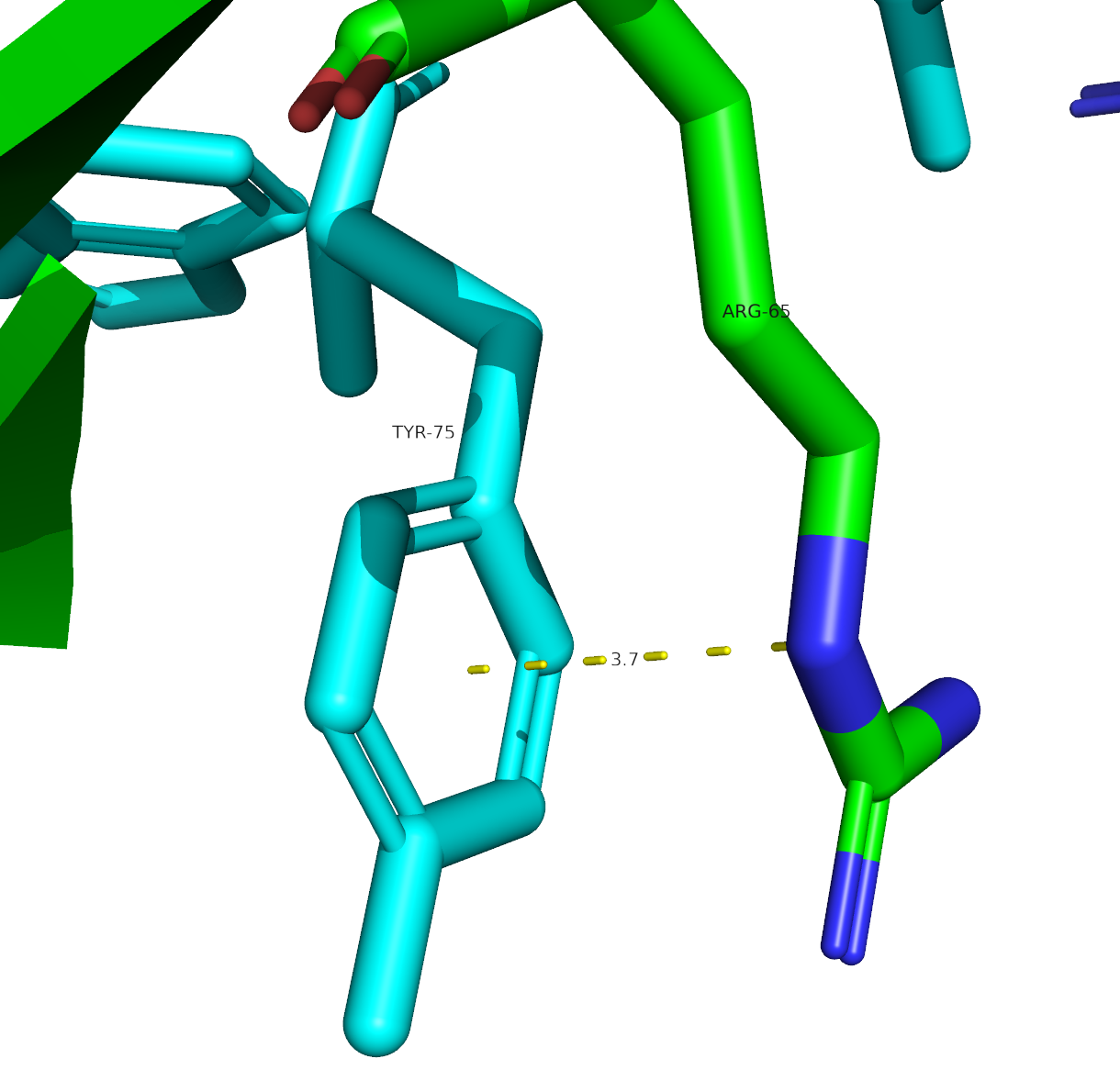
Стекинг
Стекинг представляет собой связь, образуемую электростатическими взаимодействиями между ароматическими кольцами. В центре ароматического кольца сосредотачивается отрицательный заряд, а положительный - распределяется по поверхностям с обеих сторон. Выделяют три вида стекинга: параллельно сдвинутый, T-стекинг и π-катионный. Среднее расстояние между кольцами: 4-6A.