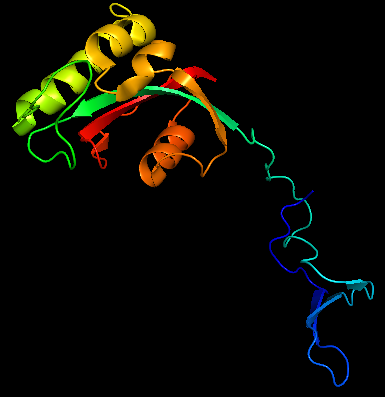
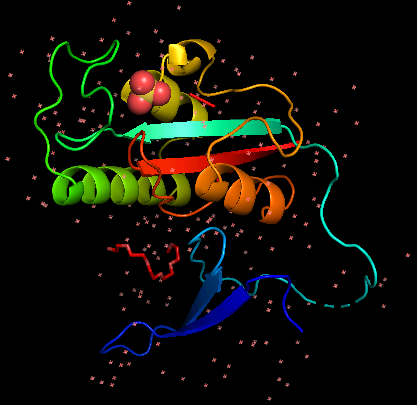
Анализ ЯМР и РС файлов, задание 4Задание выполнено на Pin1 - пептидил-пролил цис-транс изомераза, участвующая в регуляции митоза. Для этой изомеразы есть как модель, полученная при рентгеноструктурном анализе (РСА), так и модель, полученная при ядерно-магнитно-резонансном исследовании.
align 1nmv, 1pin (файлы 1nmv.pdb и 1pin.pdb загружены в PyMol 2.0.4) показывает хорошее совмещение по ядру белка, но "хвосты" смотрят в разные стороны, как головы гербового орла РФ: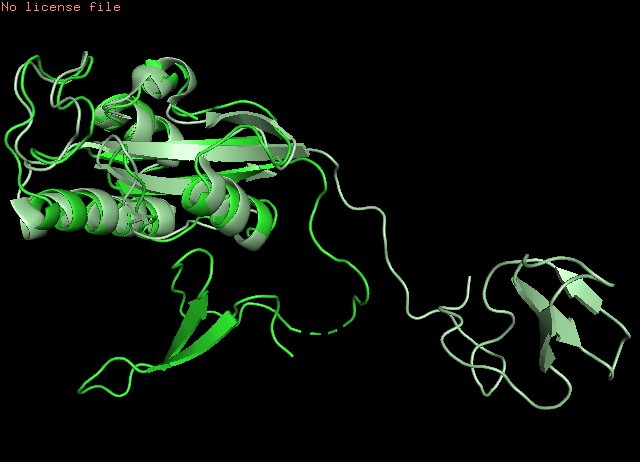 Рис. 3 Структурное выравнивание ЯМР и РСА моделей белка Pin1 За критерий наличия водородной связи принималось расстояние между потенциальными донором и акцептором, меньшее 3,5Å. Для анализа выбраны водородные связи в остове α-спирали, в хвостах остатков спирали и в хвостах остатков петли:
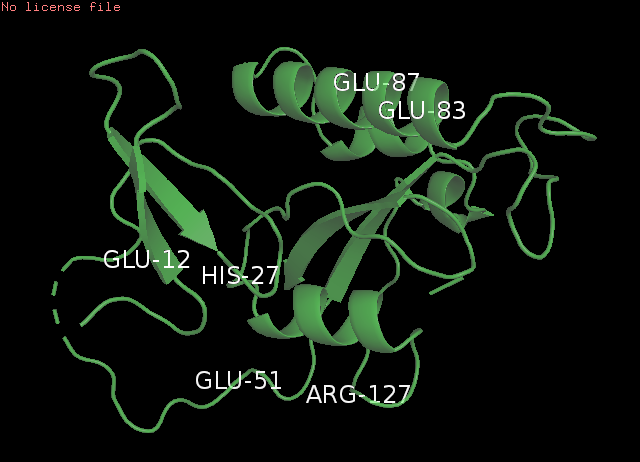
Рис. 4 Локализация выбранных связей: РСА(слева) и ЯМР(справа)
Крупный план выбранных атомов:
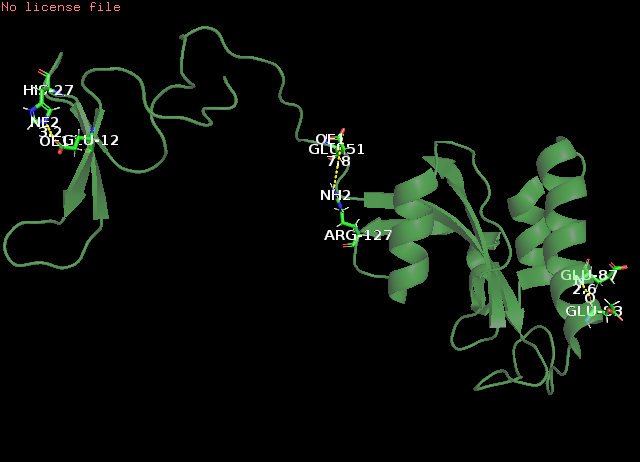
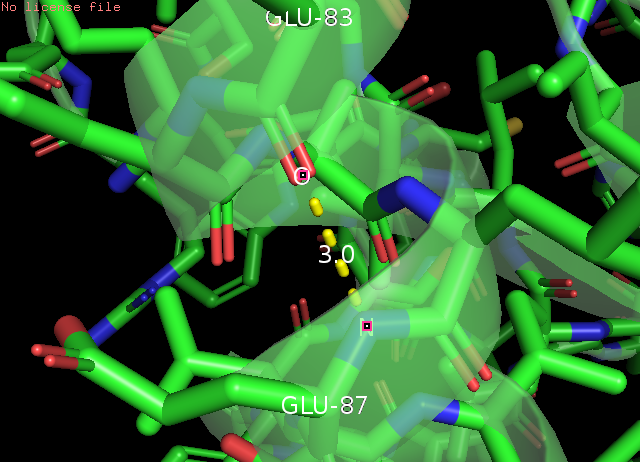
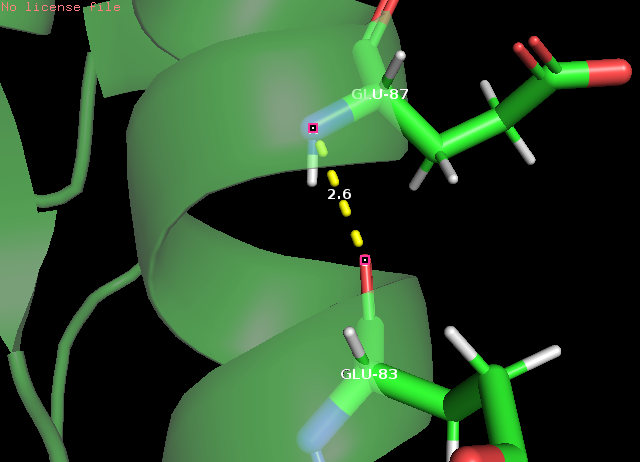
Рис. 5 α-спираль: водородная связь остовного азота Glu87 и остовного кислорода Glu83, РСА(слева) и ЯМР(справа)
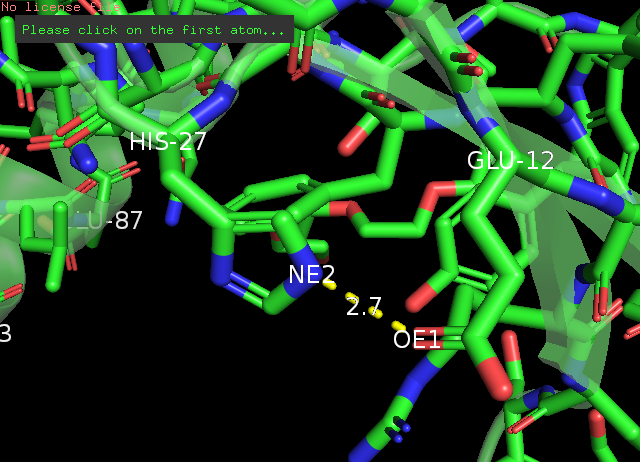
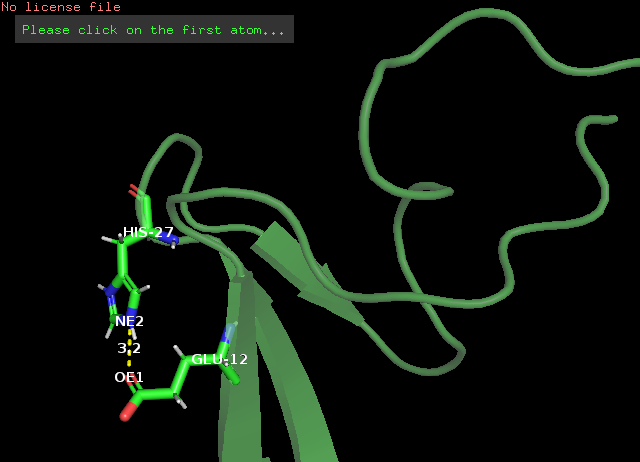
Рис. 6 β-слой и его поворотная петля: водородная связь азота имидазольного кольца His27 и карбоксильного кислорода в хвосте Glu12, РСА(слева) и ЯМР(справа)
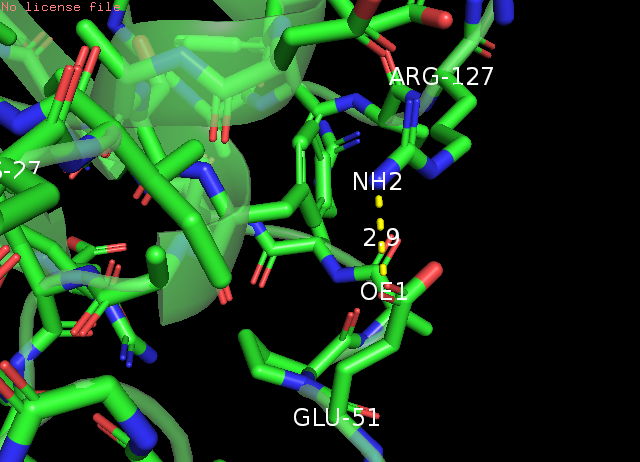
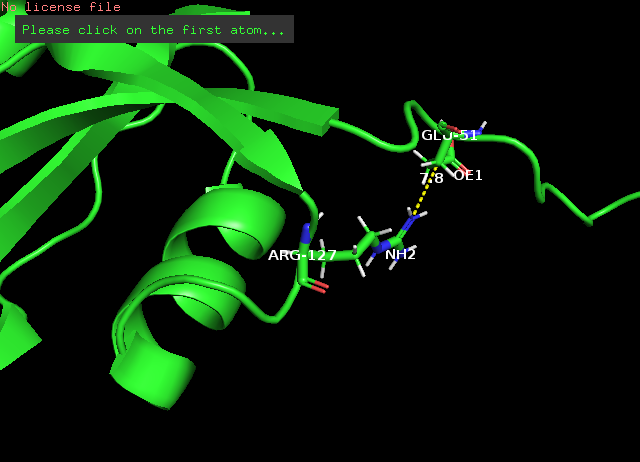
Рис. 7 Боковые петли: водородная связь азота гуанидиновой группы Arg127 и карбоксильного кислорода в хвосте Glu51, РСА(слева) и ЯМР(справа) Измерения расстояний проводилось в PyMOL (Меню Wizard->Measurement) на суммарной модели, потом выполнялось split_states 1nmv, и переключениями по состояниям (стрелки в меню инструмента Measurement) можно было наблюдать измеренное в каждой модели.
Сводная табличка по водородным связям:
В структуре поворотной петли бета-слоя хвоста белка в растворе водородные связи наблюдаются только в двух из 10 моделей ЯМР. Альфа-спираль ожидаемо самая стабильная: водородные связи постоянные как в кристалле, так и в растворе. А вот место выхода хвоста из глобулы очень подвижно - водородные связи в ЯМР-модели в этом месте вообще отсутствуют. |