Поиск гидрофобных кластеров
Практикум №11
Cтруктура для анализа
Для выполнения задания была взята структура белка AhpE (Alkyl hydroperoxide reductase E) с PDB ID 5ID2.
Использование сервиса CLuD
Для поиска гидрофобных поверхностей был использован онлайн-сервис CLuD. Выдача сервиса была, мягко говоря, ужасна и совершенно не годилась для работы, поэтому я написал скрипт, который превращает выдачу сервиса (скрипт для программы RasMol, которой уже почти не пользуются) в приемлемый для работы скрипт PyMol.
Поиск гидрофобных кластеров
Вначале сервис был запущен со стандартными параметрами:
Atom list: strict
Model number (for NMR): 1
Restriction: none
Distance threshold: 5.2 Å
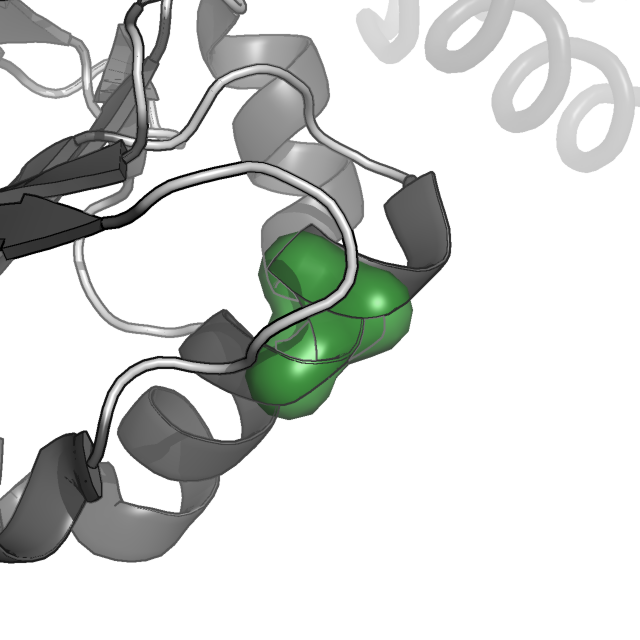
В выдаче оказалось 24 гидрофобных ядра, из них существенным размером обладало только три. Была произведена визуализация молекулярной поверхности этих кластеров и кристаллической единицы целиком.
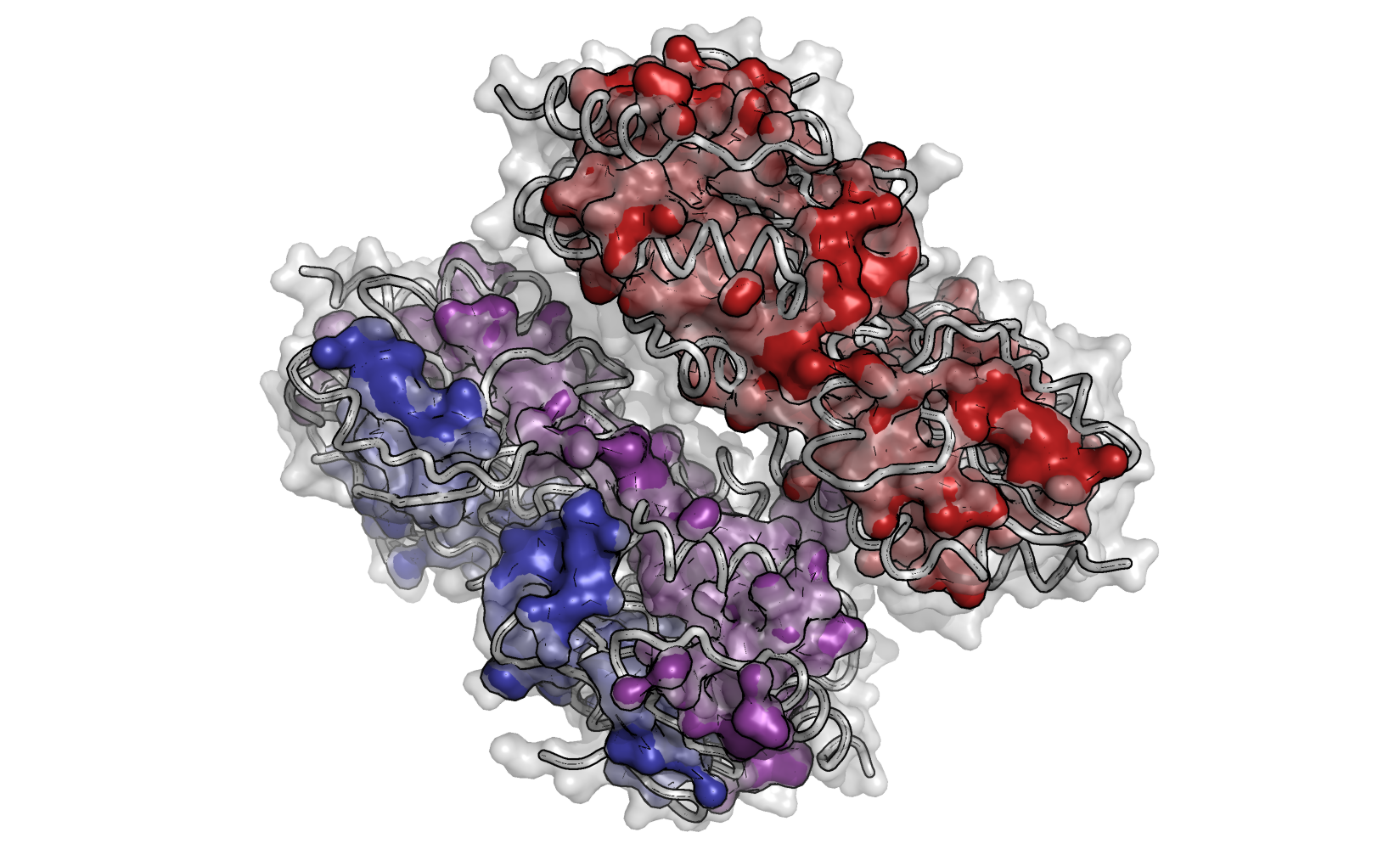 Рисунок 1. Молекулярная поверхность белка AhpE и его трех гидрофобных кластеров.
Рисунок 1. Молекулярная поверхность белка AhpE и его трех гидрофобных кластеров.
Видно, что кластеры слабо экспонированы на поверхность. Также можно заметить, что кластеры значимо участвуют в связывании субъединиц белка в биологическую единицу (димер), но почти не участвуют в связывании субъединиц в кристаллическую единицу (тетрамер).
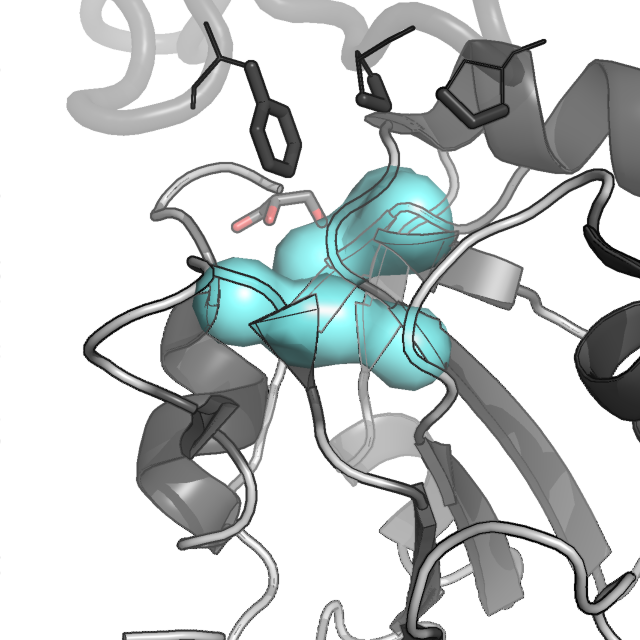
При небольшом уменьшении максимального расстояния видим, как главное гидрофобное ядро в одной из биологических единиц распадается на 2 ядра таким же образом, как ядра представлены в другой биологической единице внутри общей кристаллической единицы.
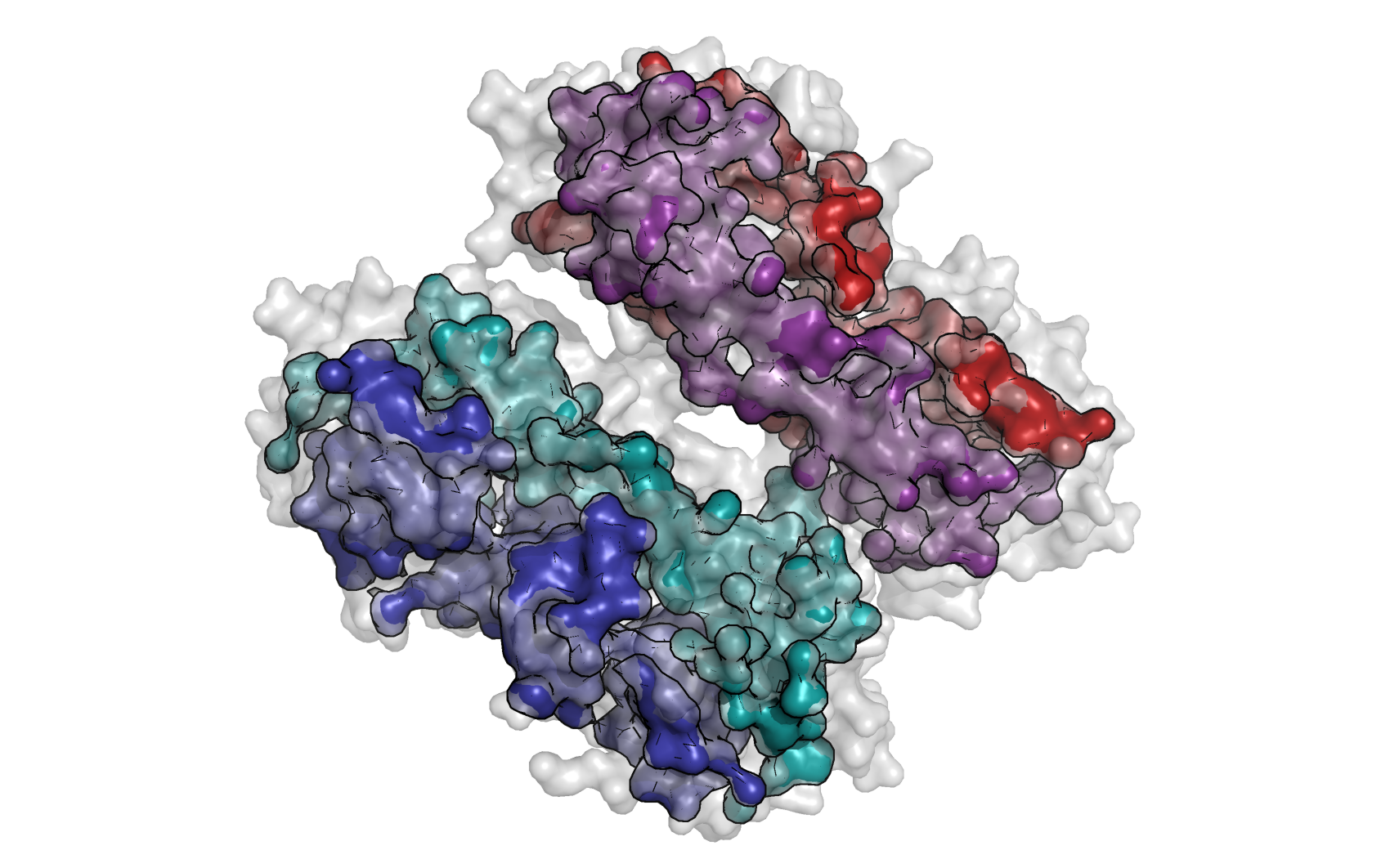 Рисунок 2. Молекулярная поверхность белка AhpE и его четырех гидрофобных кластеров.
Рисунок 2. Молекулярная поверхность белка AhpE и его четырех гидрофобных кластеров.
Гидрофобные ядра внутри цепи
Для анализа гидрофобных ядер внутри цепи быили выставлены следующие параметры:
Atom list: strict
Model number (for NMR): 1
Restriction: chain A
Distance threshold: 4.5 Å
В результате в цепи A было выделено 16 гидрофобных ядер. 4 из них были удалены из-за незначительных размеров. Ядра, поверхности которых соприкасались, были сгруппированы. В результате этих действий было оставлено 8 наиболее важных (на мой взгляд) гидрофобных ядер.
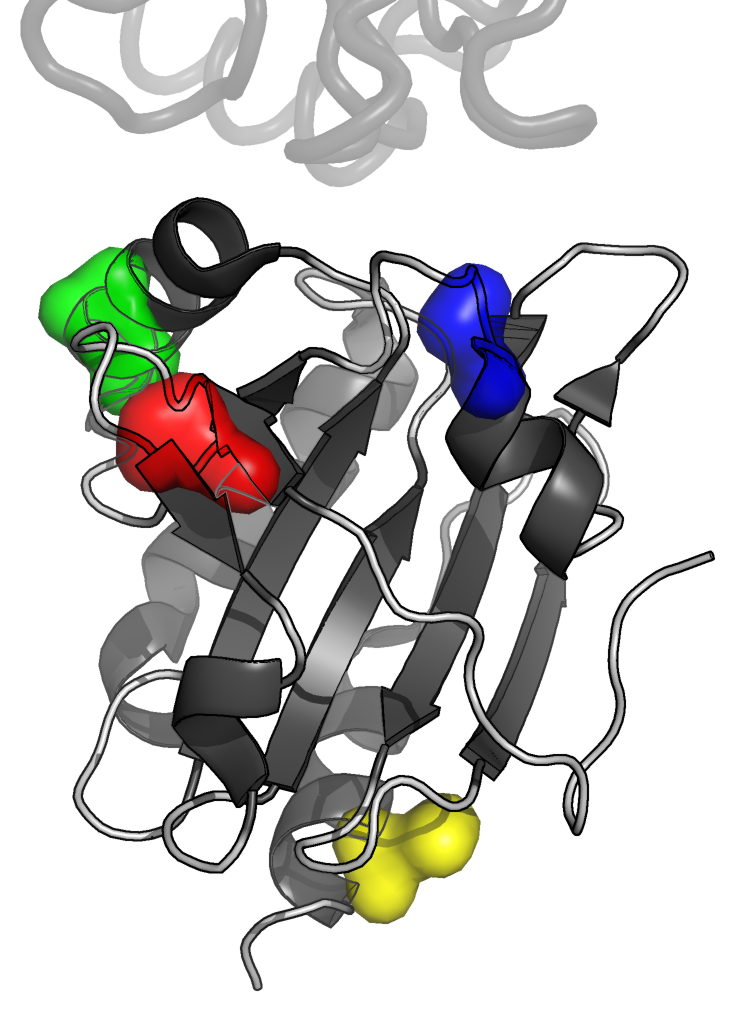
Гидрофобные кластеры были раскрашены и пронумерованы следующим образом:
- Красный
- Оранжевый
- Желтый
- Светло-зеленый
- Темно-зеленый
- Голубой
- Синий
- Фиолетовый
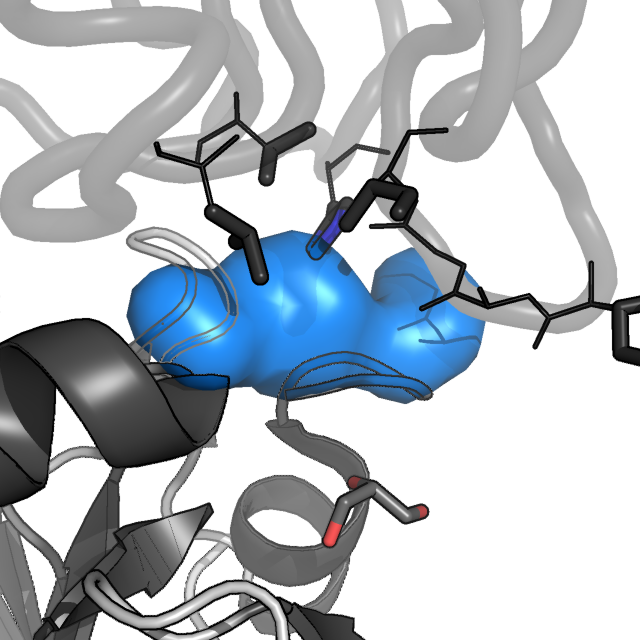
Рисунок 3. Молекулярная поверхность четырех удаленных гидрофобных ядер цепи A белка AhpE. Цепь A показана в схематическом виде, темно-серым раскрашены α-спирали и β-листы, светлым - петли; цепь B показана в виде сосиски (cartoon tube).
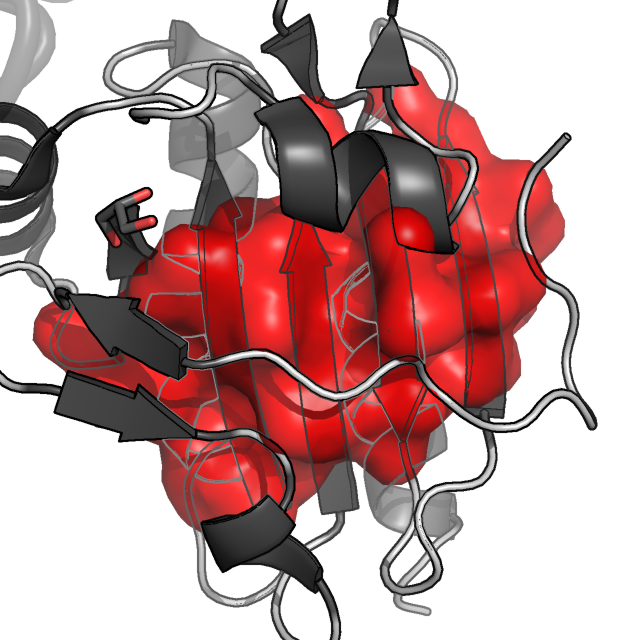
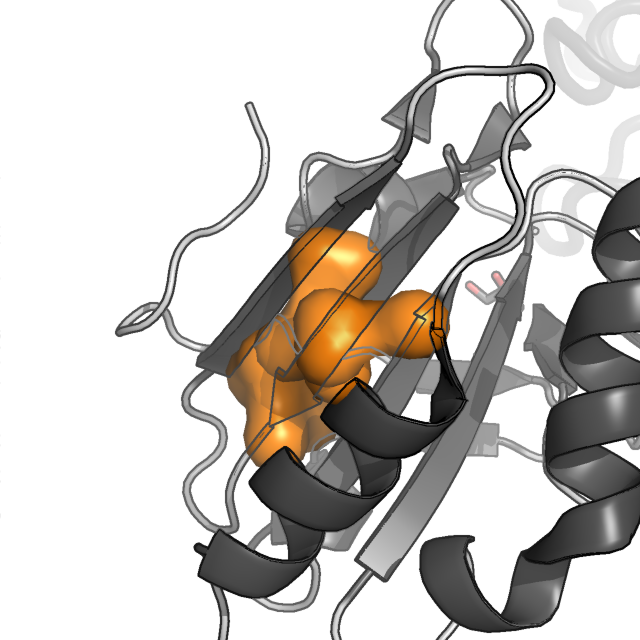
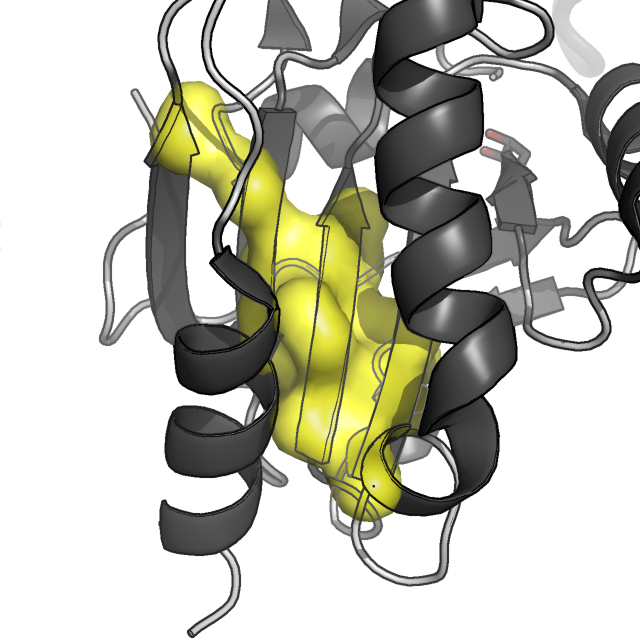
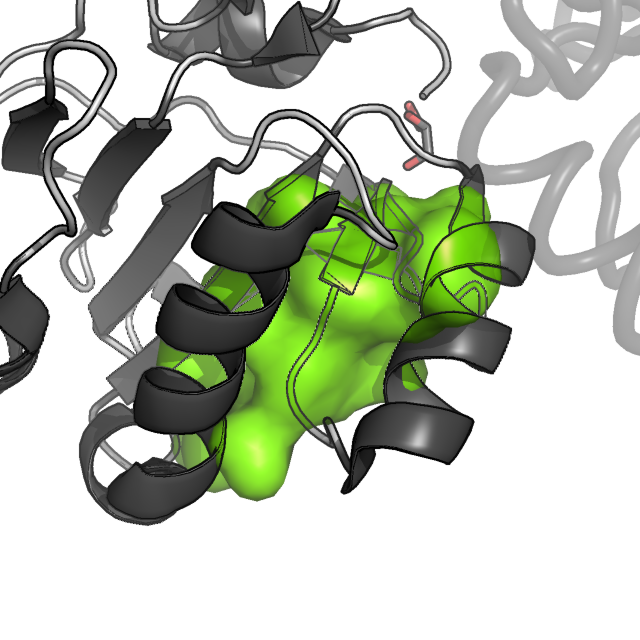
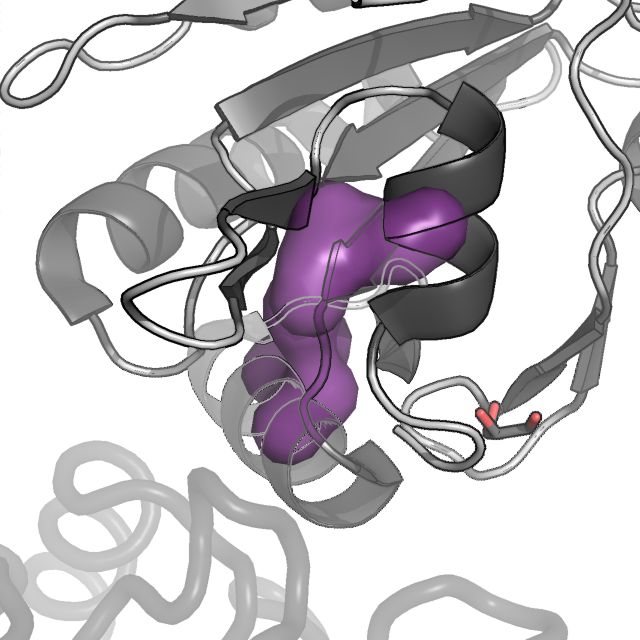
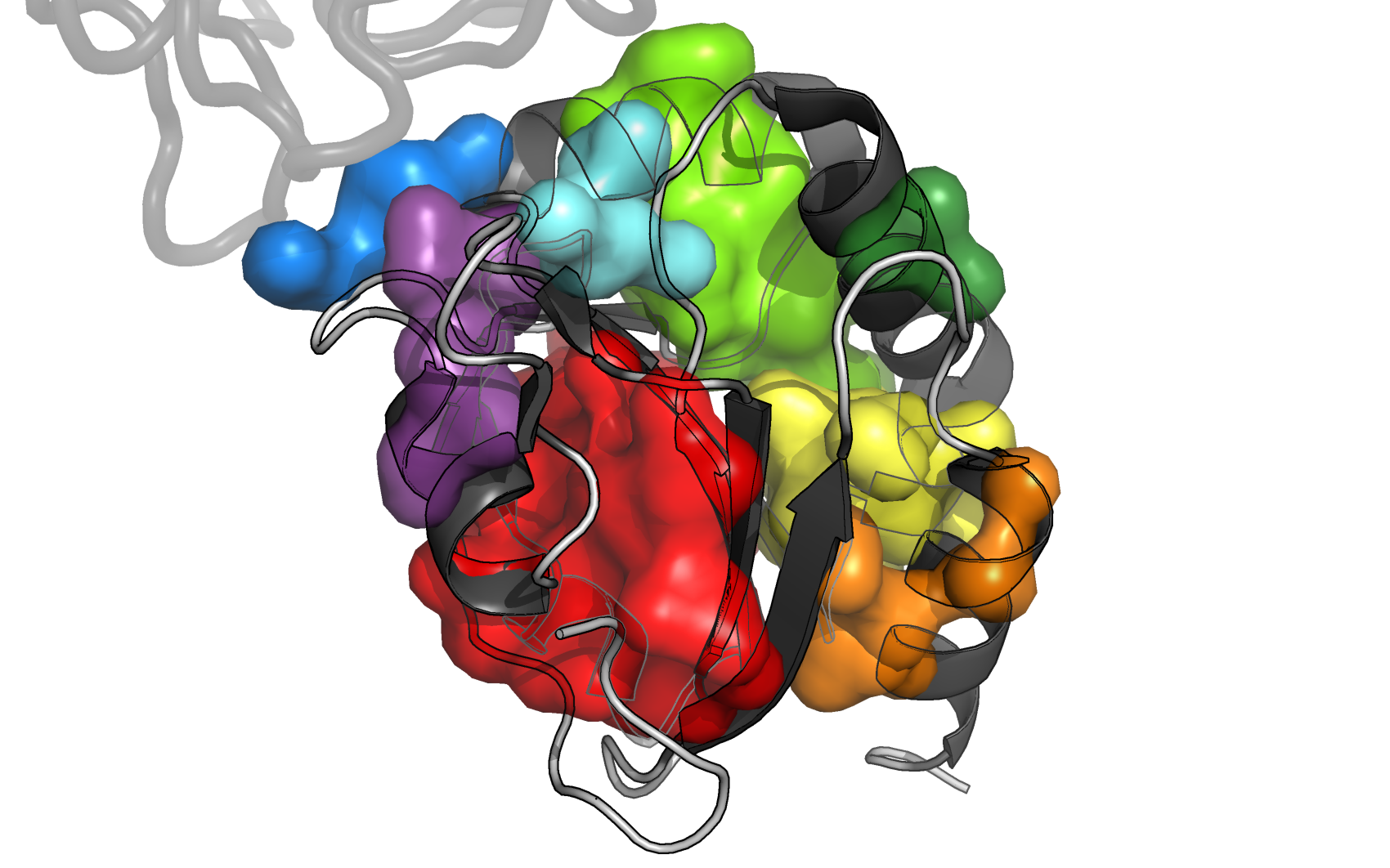 Рисунок 4. Молекулярная поверхность восьми гидрофобных ядер цепи A белка AhpE. Цепь A показана в схематическом виде, темно-серым раскрашены α-спирали и β-листы, светлым - петли; цепь B показана в виде сосиски (cartoon tube).
Рисунок 4. Молекулярная поверхность восьми гидрофобных ядер цепи A белка AhpE. Цепь A показана в схематическом виде, темно-серым раскрашены α-спирали и β-листы, светлым - петли; цепь B показана в виде сосиски (cartoon tube).
Как мы видим, наиболее важными в поддержании структуры белка являются кластер 1 (красный), кластер 3 (желтый), 4 (светло-зеленый) и 8 (фиолетовый).
Поиск гидрофобных кластеров в комплексе белка с ДНК
Для поиска гидрофобных ядер в ДНК-связывающем комплексе была взята структура белка Chd1 (Chromo domain-containing protein 1) с PDB ID 3TED. Онлайн-сервис CLuD был запущен со стандартными параметрами для этого комплекса. Было выявлено 3 значимых кластера: 2 в белке и 1 в двухцепочечной ДНК.
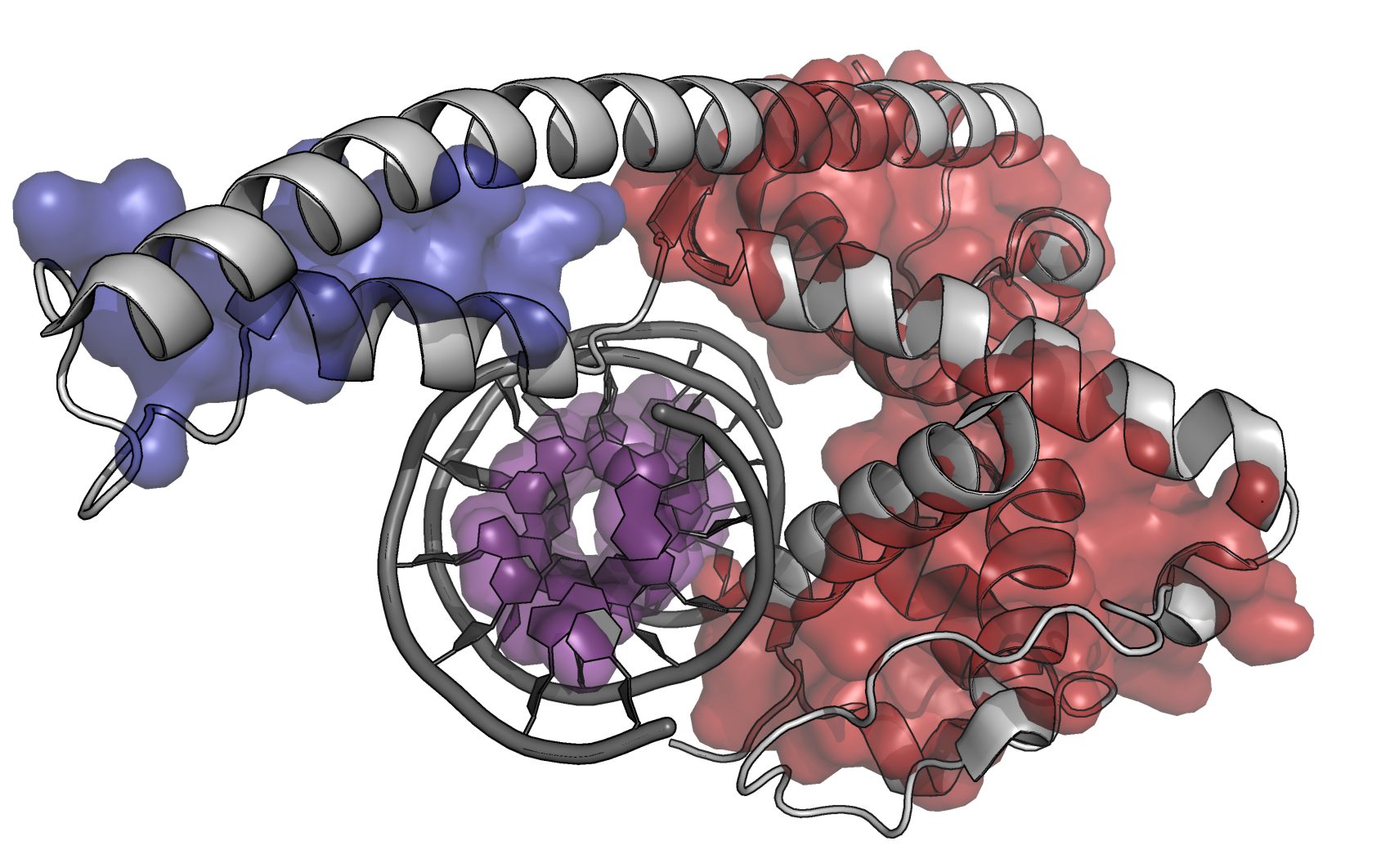 Рисунок 5. Гидрофобные ядра ДНК-связывающего белка Chd1 и связанной с ним молекулы ДНК.
Рисунок 5. Гидрофобные ядра ДНК-связывающего белка Chd1 и связанной с ним молекулы ДНК.
На рисунке хорошо видно единственное место гидрофобного контакта белка Chd1 с молекулой ДНК.
© Arsenii Loginovskii, 2016-2020