Практикум 11. Базы даннных
Для выполнения практикума мне был выдан список идентификаторов генов, белки которых предположительно взаимодействуют между собой в организме человека. Вот этот список: AGA, CTSA, ENGASE, FUCA1, FUCA2, GALNS, GLB1, GNS, HEXA, HEXB, HEXDC, NAGA, NEU1.
Задача исследования - изучение взаимодействий белков из списка, их роли в биохимических процессах, уровня экспрессии наиболее изученных представителей в разных тканях и их локализации в клетке.
База данных GO
Работа проводилась на сайте https://geneontology.org. По заданному списку генов можно просмотреть, в связи с какими биологическими процессами он упоминаетсяв литературе - провести "enrichment anlysis", который позволяет провести поиск "ключевых слов", связанных с набором генов. Результат изображен на Рисунке 1.
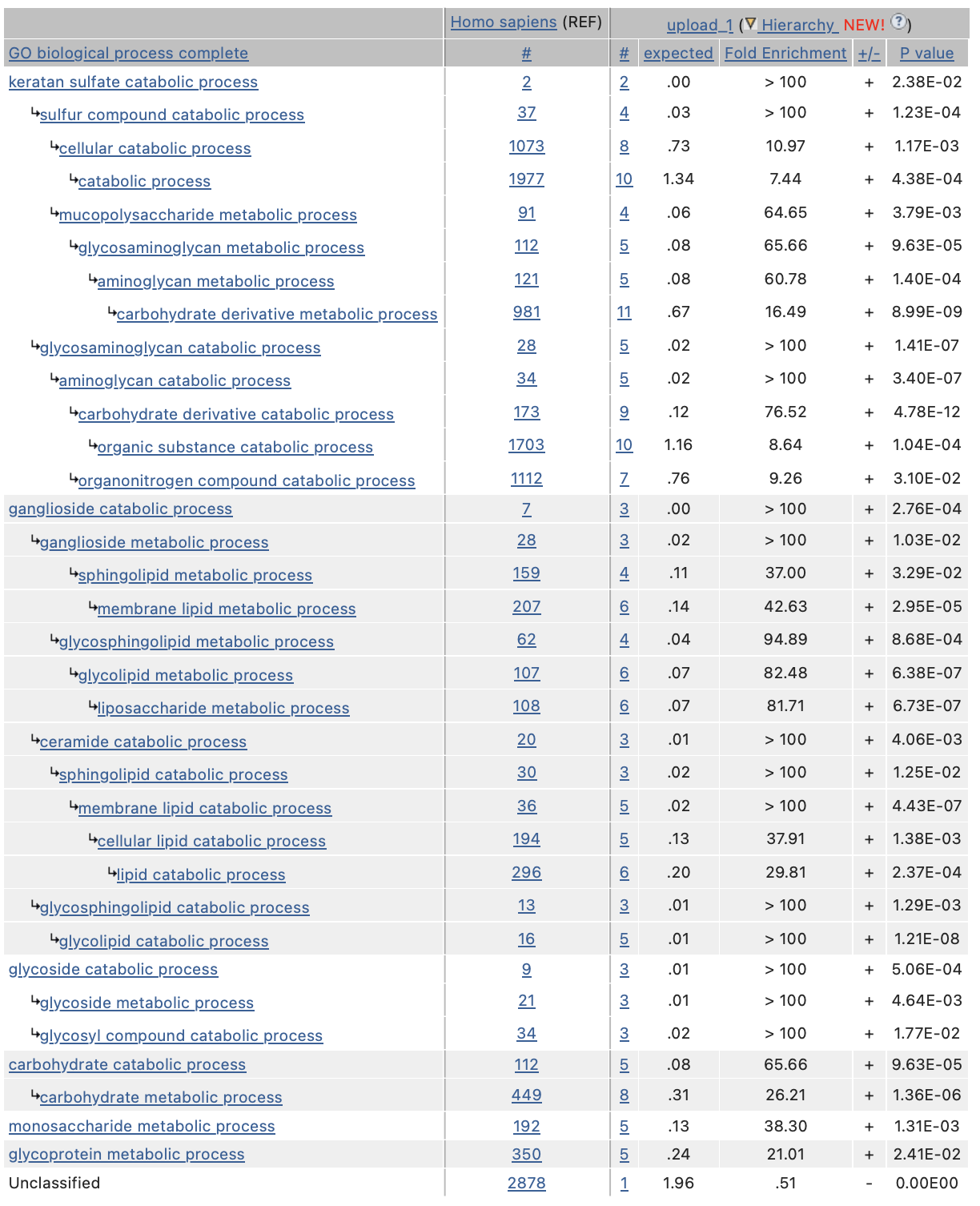
Резюмируя список биологических процессов, связанных с нашим списком белков, можно сказать что это в основном катаболические процессы полисахаридов, являющихся серосодержащими, фосфор-содержащими и азот-содержащими соединениями. Многообещающим результатом является отсутствие упоминания нескольких радикально разных функций. Возможно, наши белки взаимодействуют для выполнения общего для них биологического процесса. Для поиска взаимодействий белков из списка хорошо подходит следующая база данных - STRING.
База данных STRING
Работа проходила на сайте на сайте https://string-db.org/. Эта база данных позволит нам выяснить известные из различных источников взаимодействия между белками из списка. На рисунках 2 и 3 представлены результаты построения графов взаимодействий исследуемых белков. В каждой вершине графа содержится изображение структуры белка, это значит, что она исследована или предсказана. Салатовые ребра в графе обозначают, что белки совместно упоминаются в статьях ("Textmining"), эти ребра связывают очень многие белки друг с другом, делая весь граф связным (Рисунок 2.1, 2.2 - легенда).
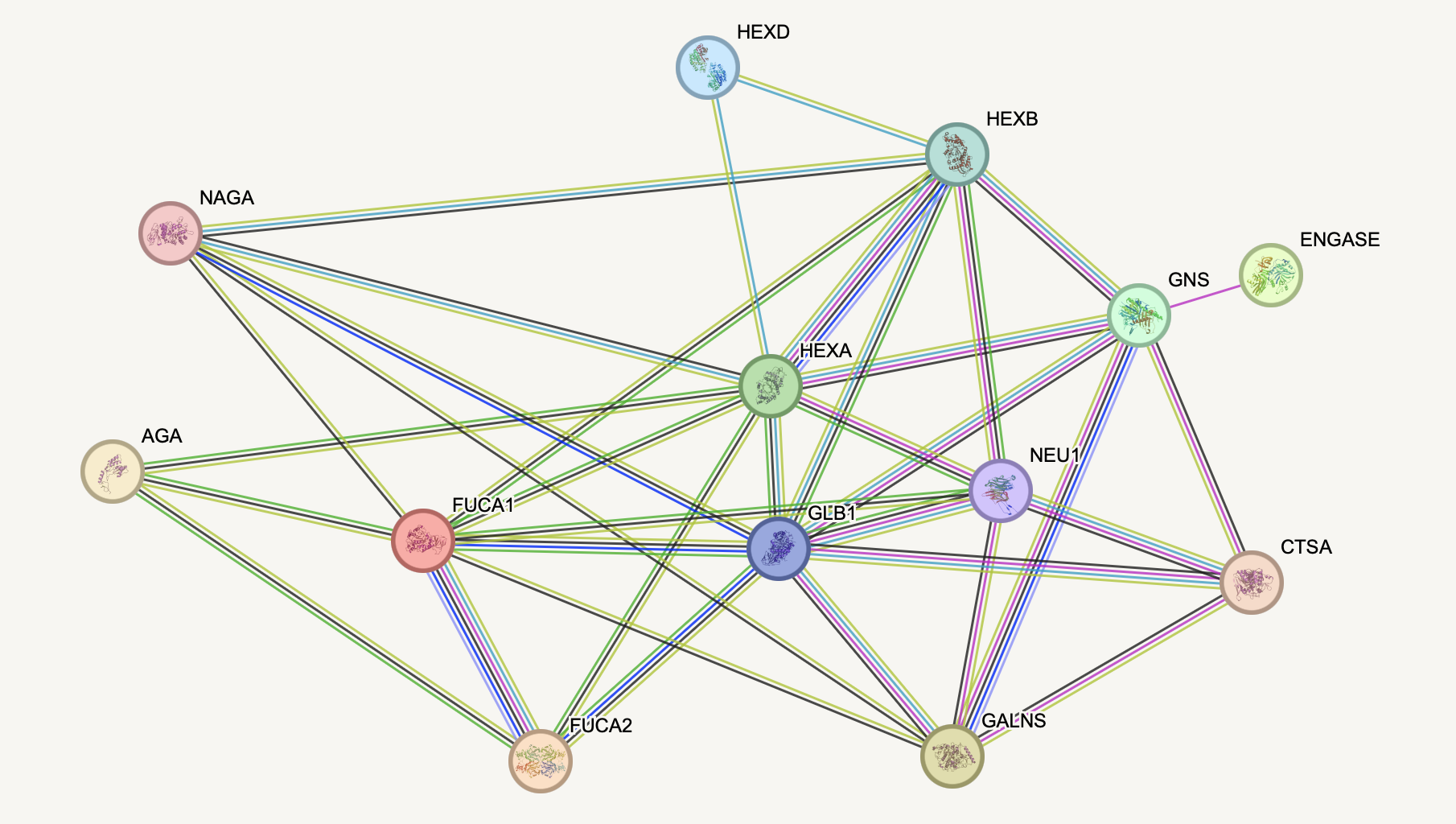
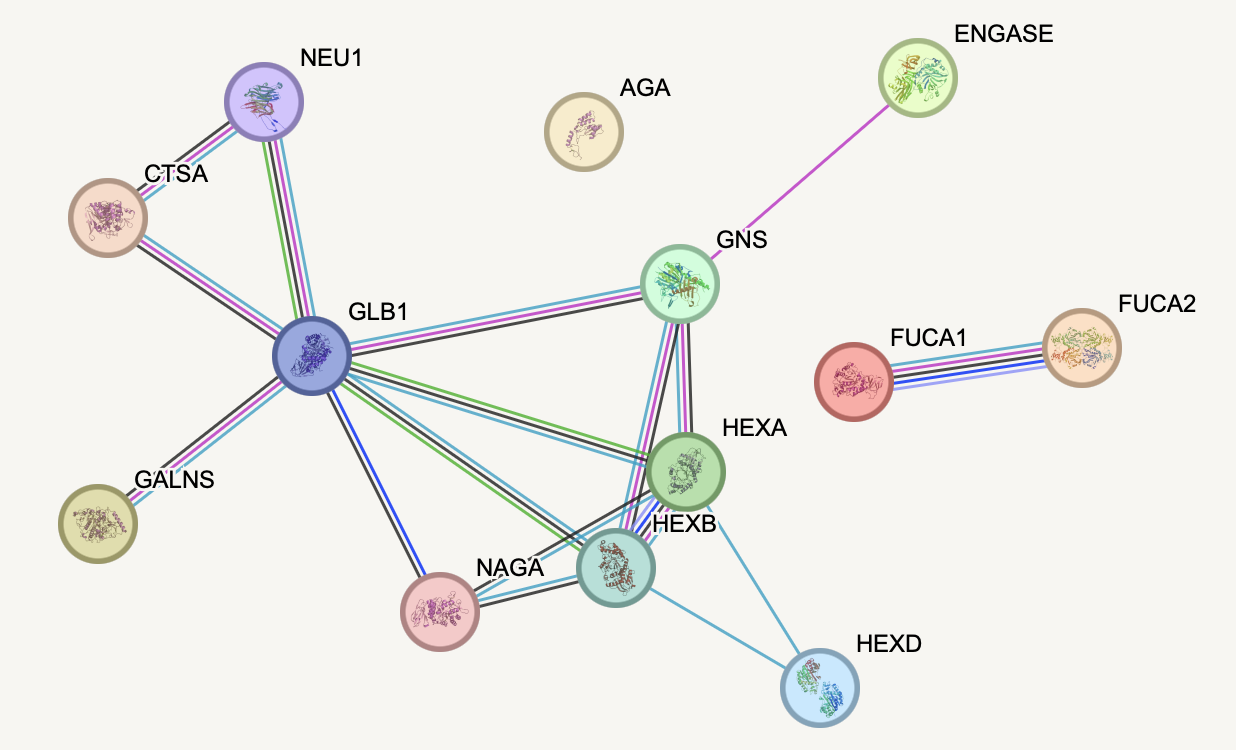
Встроенные аннотации с описанием функции белков помогают понять, что все белки кроме GALNS участвуют в процессе расщепления гликозидной связи, чаще всего это связь различных моно- и олигосахаридов с атомом азота. GALNS является сульфатазой. При отключении отображения связей типа "Textmining" в графе становится проще анализировать предсказанные и доказанные взаимодействия между белками (Рисунок 3). Центрами, связывающими между собой многие белки, являются белки HEXA, HEXB, GLB1. Белки FUCA1 и FUCA2 экспериментально доказанно взаимодействуют, но не доказано, что взаимодействуют с остальными белками из списка. Белок AGA, по-видимому, плохо изучен в контексте взаимодействия с другими белками списка, или может не иметь с ними совместного биологического процесса, так как он расщепляет связь между пептидом и олигосахаридом в гликопротеинов, связанных через аспарагин, а его взаимодействия с другими белками - соупоминание в литературе и совместная экспрессия.
База данных THE HUMAN PROTEIN ATLAS
Эта база данных несет в себе подборку существующей на данный момент информации о белках человека, удобно оформленную в постраничном отчете по каждому белку. База данных содержит в себе информацию о внутриклеточной локализации белка, уровне экспрессии мРНК данного белка в различных тканях и отдельных типах клеток, в том числе по результатам single cell анализа. Информацию о специфичности экспрессии генов данного белка по важным для медицинских исследований категориям: экспрессия в разных отделах мозга, в разных типах клеткок крови, имунной системы, содержание белка в плазме крови. Также тут отображается информация о роли данного белка в известных типах раковых заболеваний, принадлежности белка к онкогенным. Здесь же можно посмотреть некоторую информацию о структуре и взаимодействиях белка, хотя второе менее подробно, чем в STRING.
Воспользуемся этой базой данных для выяснения тканеспецифичности и внутриклеточной локализации нескольких белков из нашего списка. Я возьму белки с большим количеством партнеров по взаимодействию в STRING. Также я выдвигаю гипотезу о локализации в центральной нервной системе белка GLB1 так как там ганглиозиды, в катаболизме которых он участвует, играют важную роль в образовании межклеточных контактов[1] и гипотезу о тканеспецифичности белка AGA, из-за которой не обнаружено его взаимодействий с другими белками из списка при схожей функции.
Результаты исследования GLB1 при помощи THE HUMAN PROTEIN ATLAS
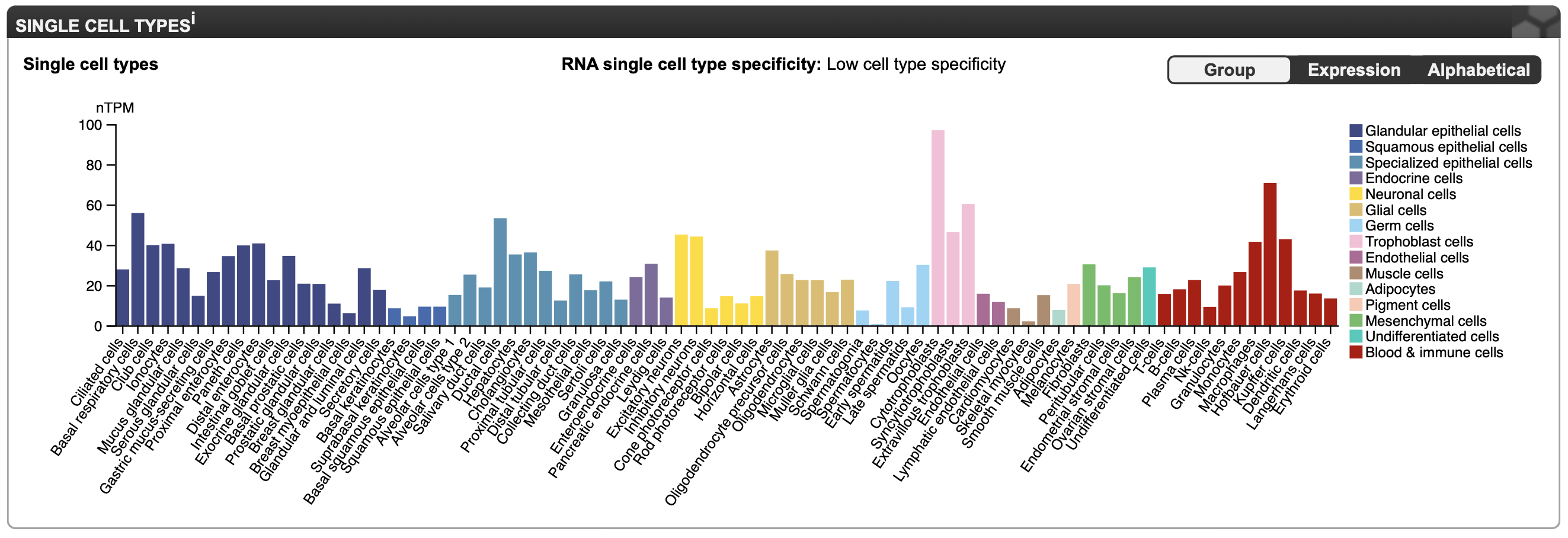
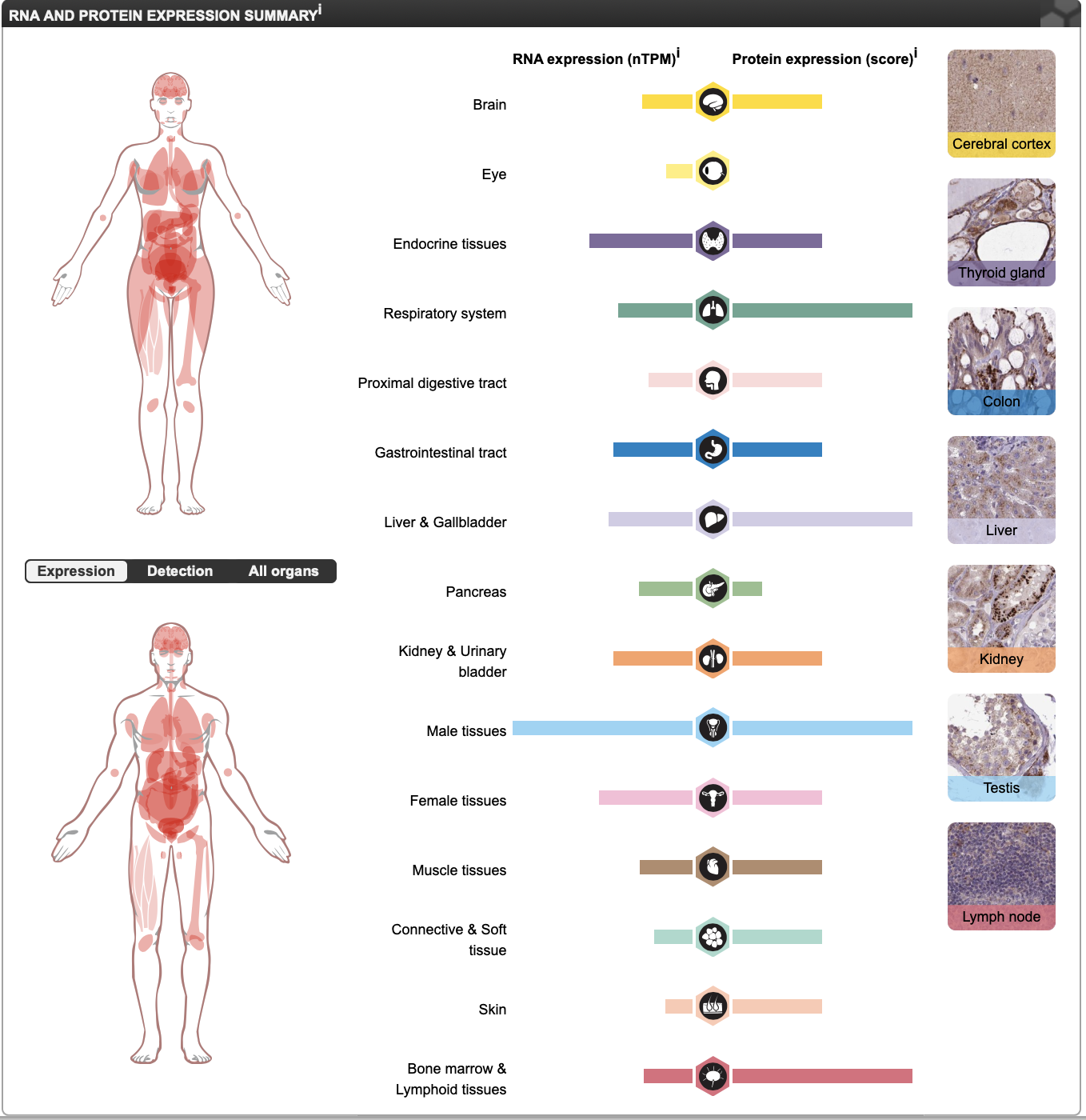
Внутриклеточная локализация белка наблюдается в аппарате Гольджи и в лизосомах. На мой взгляд это логично, ведь фермент, расщепляющий компоненты клетки, может представлять опасность для клетки при свободном нахождении в цитоплазме, поэтому он хранится и транспортируется в мембранных структурах.
Результаты исследования AGA при помощи THE HUMAN PROTEIN ATLAS
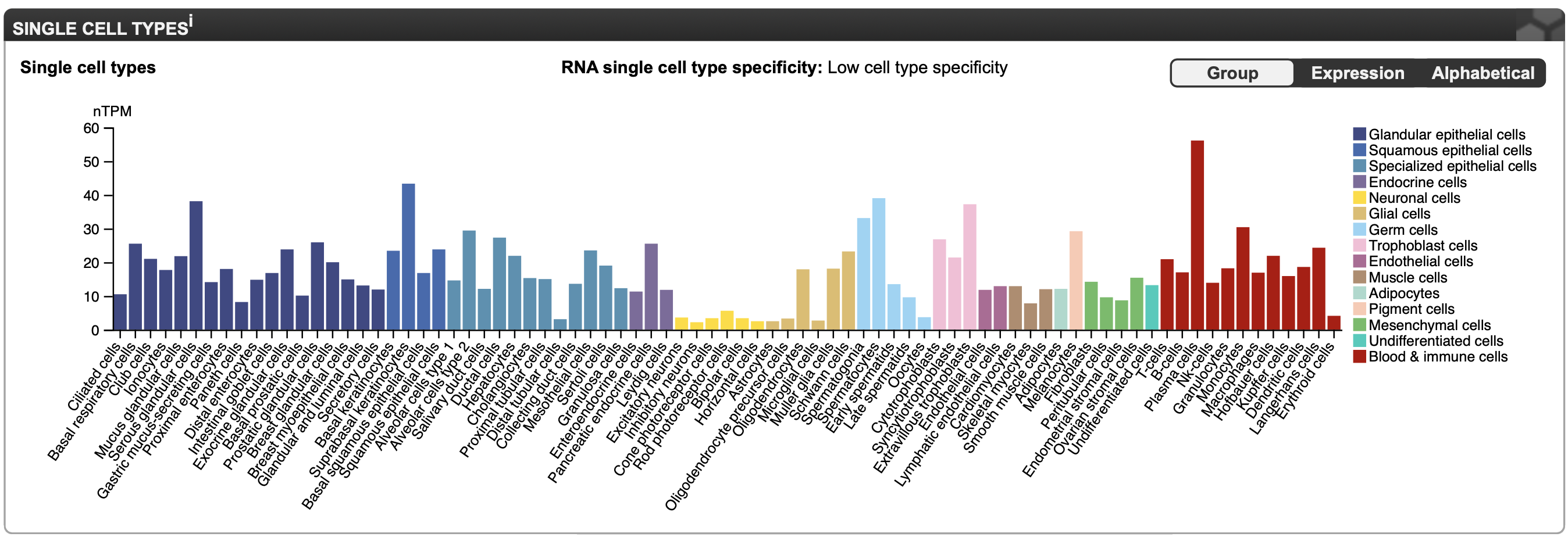
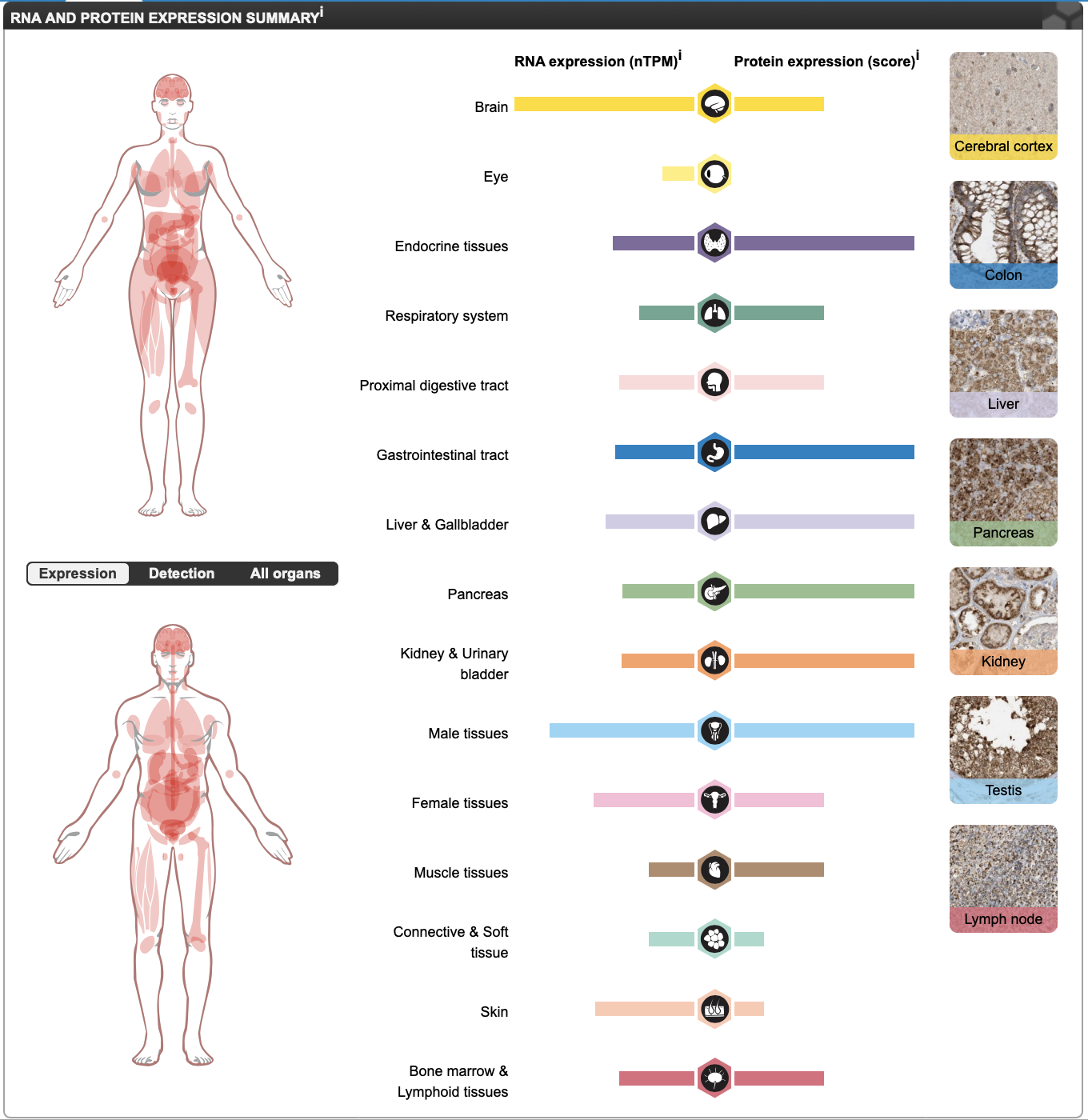
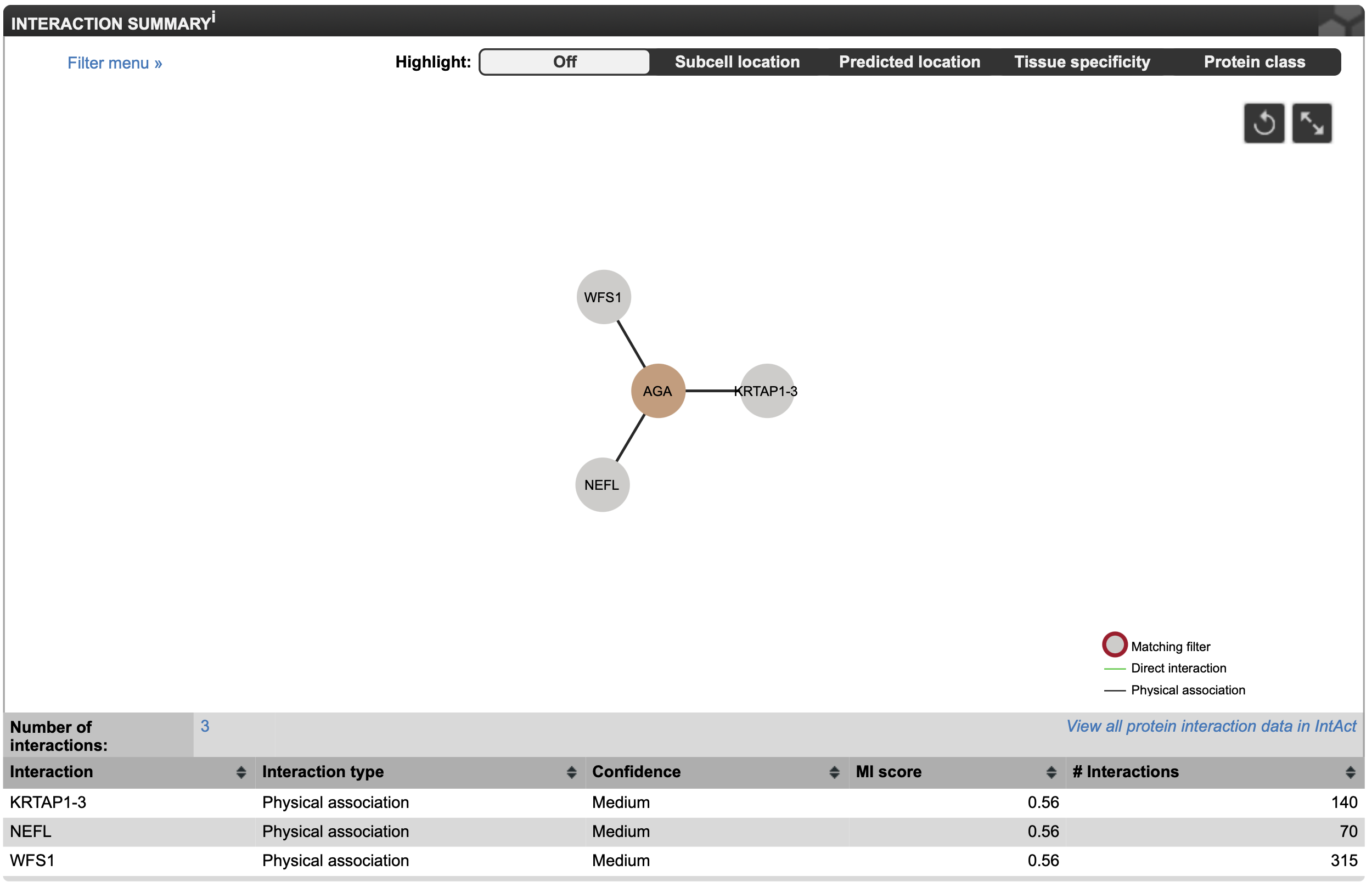
В THE HUMAN PROTEIN ATLAS нет информации о внутриклеточной локализации белка AGA. Это грустно. Заглянем в раздел Interactions. Тут нет знакомых белков, однако есть три взаимодействующих белка (Рисунок 8). Посмотрим на их функции, чтобы лучше понять внутриклеточный контекст функций белка AGA. WFS1 является трансмембранным гликопротеином-транспортером. Возможно, он катаболизируется именно белком AGA (быстро статьи о доказанном таком пути его распада не нашлось). KRTAP1-3 является кератин-ассоциированным белком, как-то взаимодействует с AGA, понятно, что он тканеспецифичен для кожи. Белок NEFL, взаимодействующий с AGA, является легкой цепью белка нейрофиламента - структуры цитоскелета нервных клеток. Этот белок относится к группе "промежуточных нитей", к которым относится и кератин[2].
Вывод: белок AGA регулирует взаимодействует с тканеспецифичными структурными белками, но не имеет известных взаимодействий с белками, ответственными за катаболизм углеводов. Различие в функциях объясняет отсутствие белковых взаимодействий.
Вывод: Использование баз данных GO, STRING, THE HUMAN GENOME ATLAS позволило мне установить катаболическую функцию белков из списка, дало информацию о их изученных на данный момент взаимодействиях друг с другом. На примере белков GLB1 и AGA я отработал алгоритм поиска информации о человеческих белках, их тканеспецифичности и клеточной локализации. По итогу могу сказать, что большинство белков из списка отвечают за катаболизм соединений с углеводами, однако их функции в общих биологических процессах могут быть специализированы и тканеспецифичны.
Источники:
[1]https://doi.org/10.1152/physrev.00033.2013
[2]https://en.wikipedia.org/wiki/Neurofilament