Практикум 4: работа со структурой 1SFX в PyMOL
Структура 1SFX является HTH транскрипционным регулятором Archaeoglobus fulgidus. Всего в структуре присутсвует две пептидные цепи. Биологическая единица представляет из себя гомодимер.
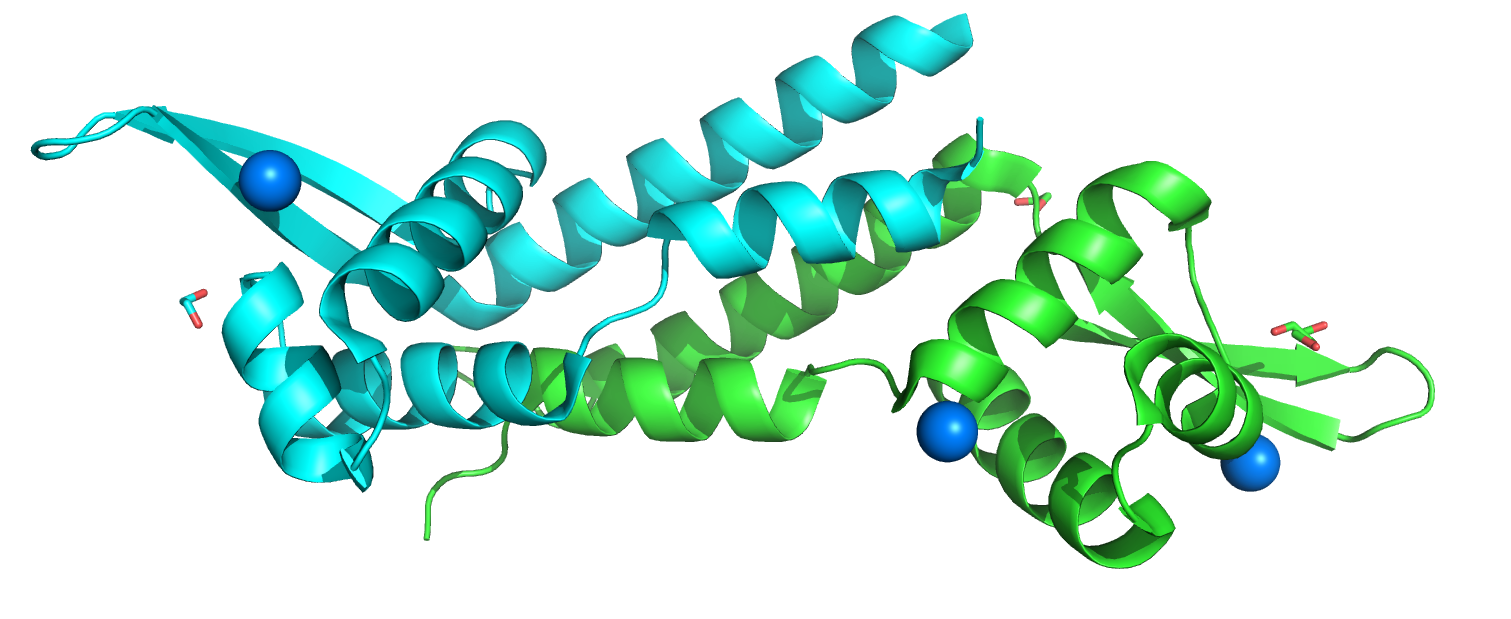
Самая распространенная вторичная структура - альфа-спираль. Бета-листы тоже представлены, но в меньшей степени.
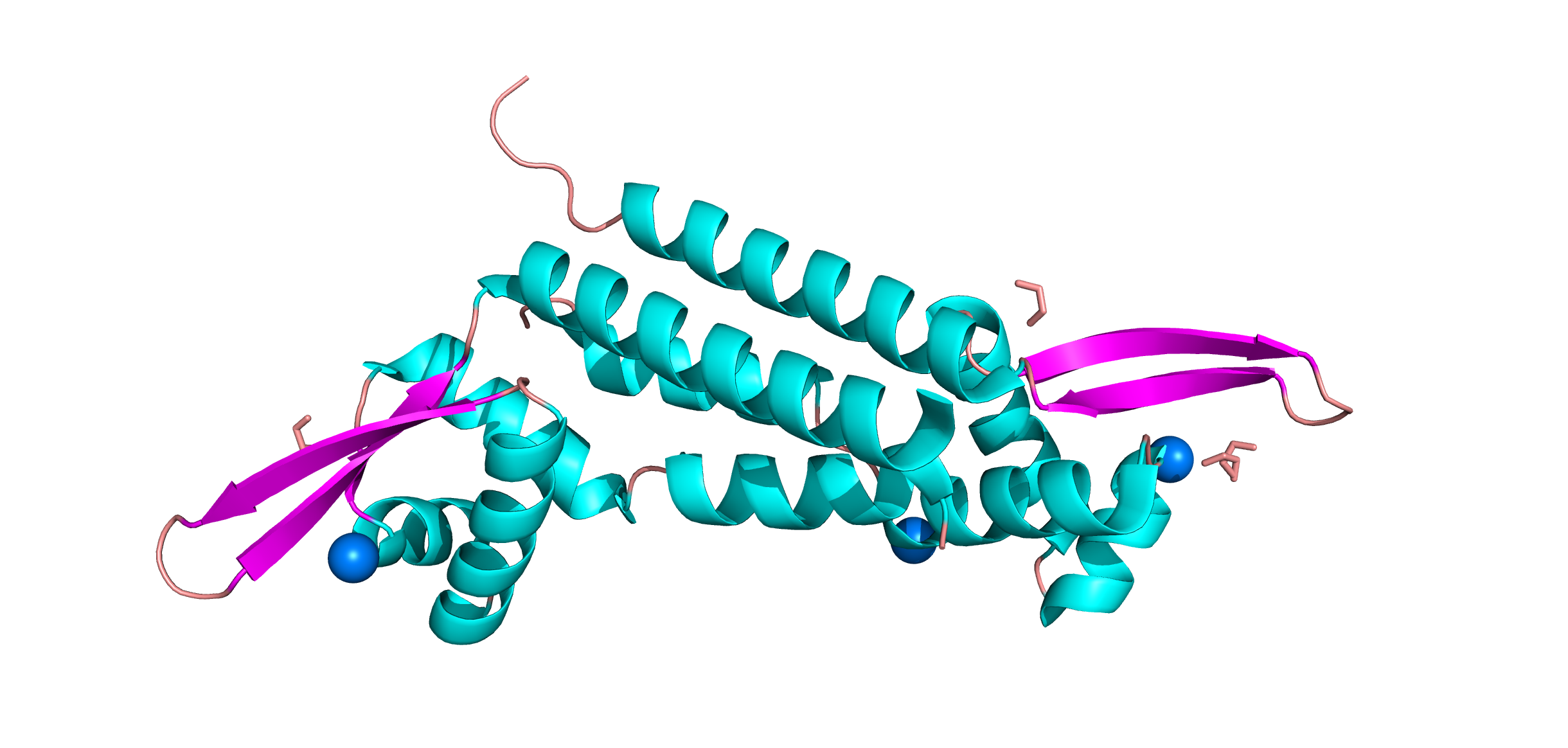
По данным PDB на структуре присутсвует 2 типа малых молекул: ионы хлора (обозначены зеленым) и 1,2-этандиол (обозначен бирюзовым).
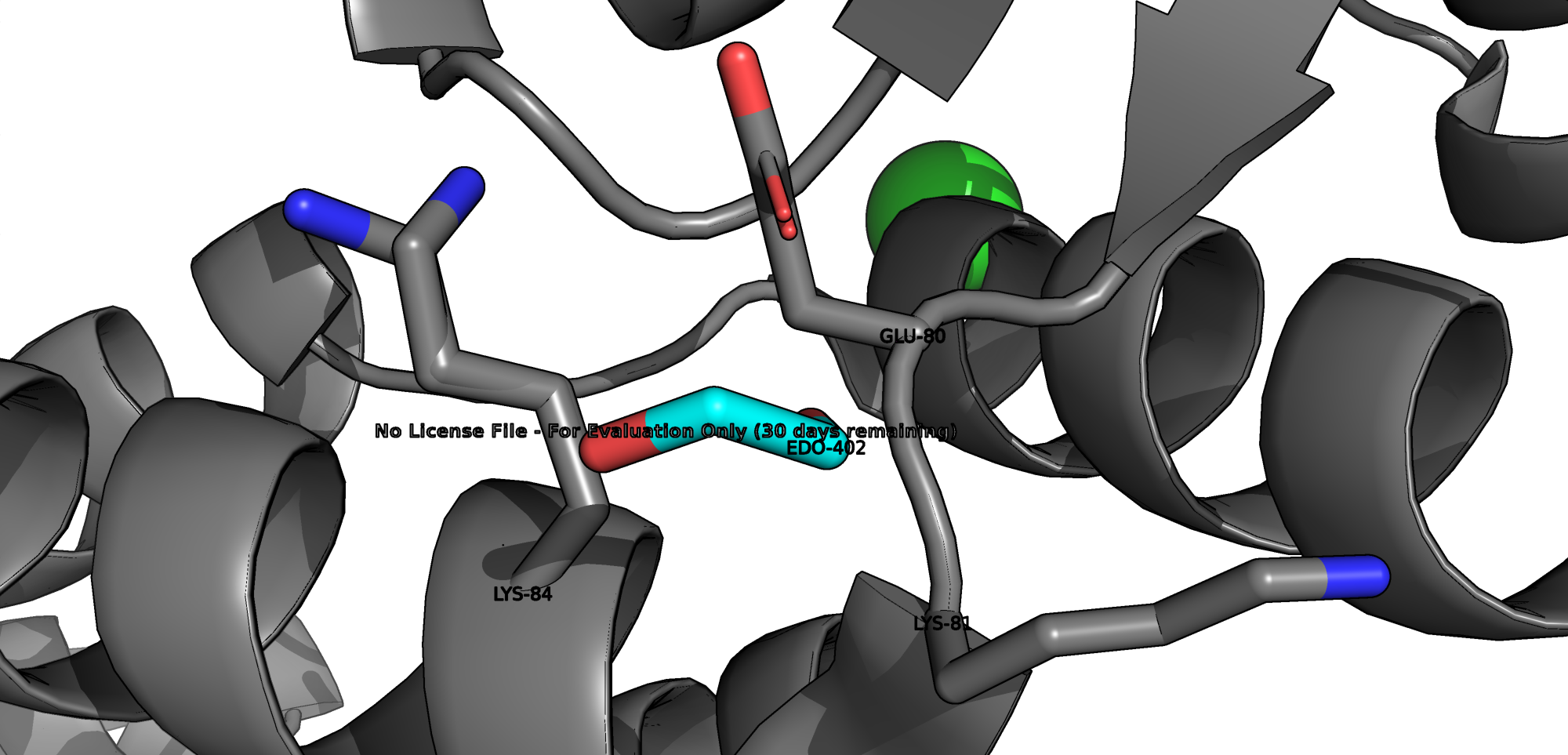
Взаимодействия между аминокислотными остатками в PyMOL
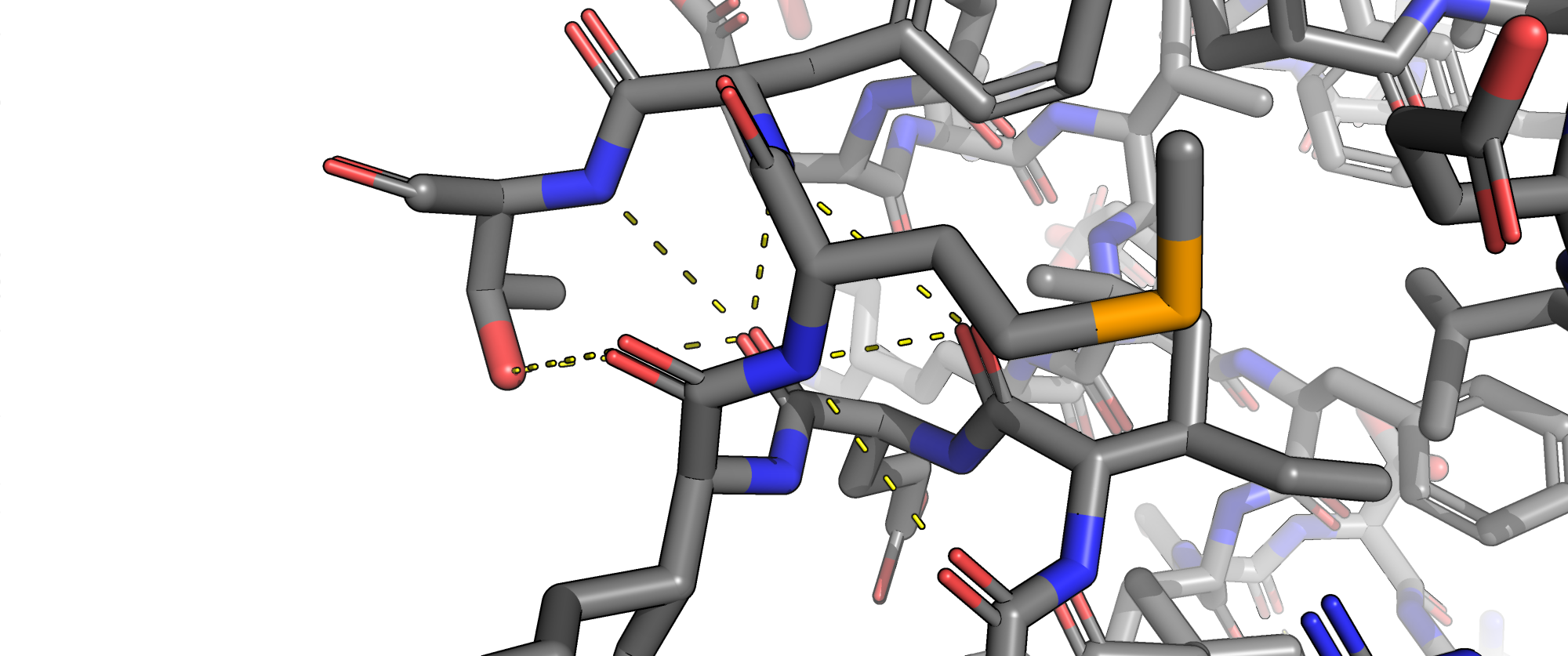
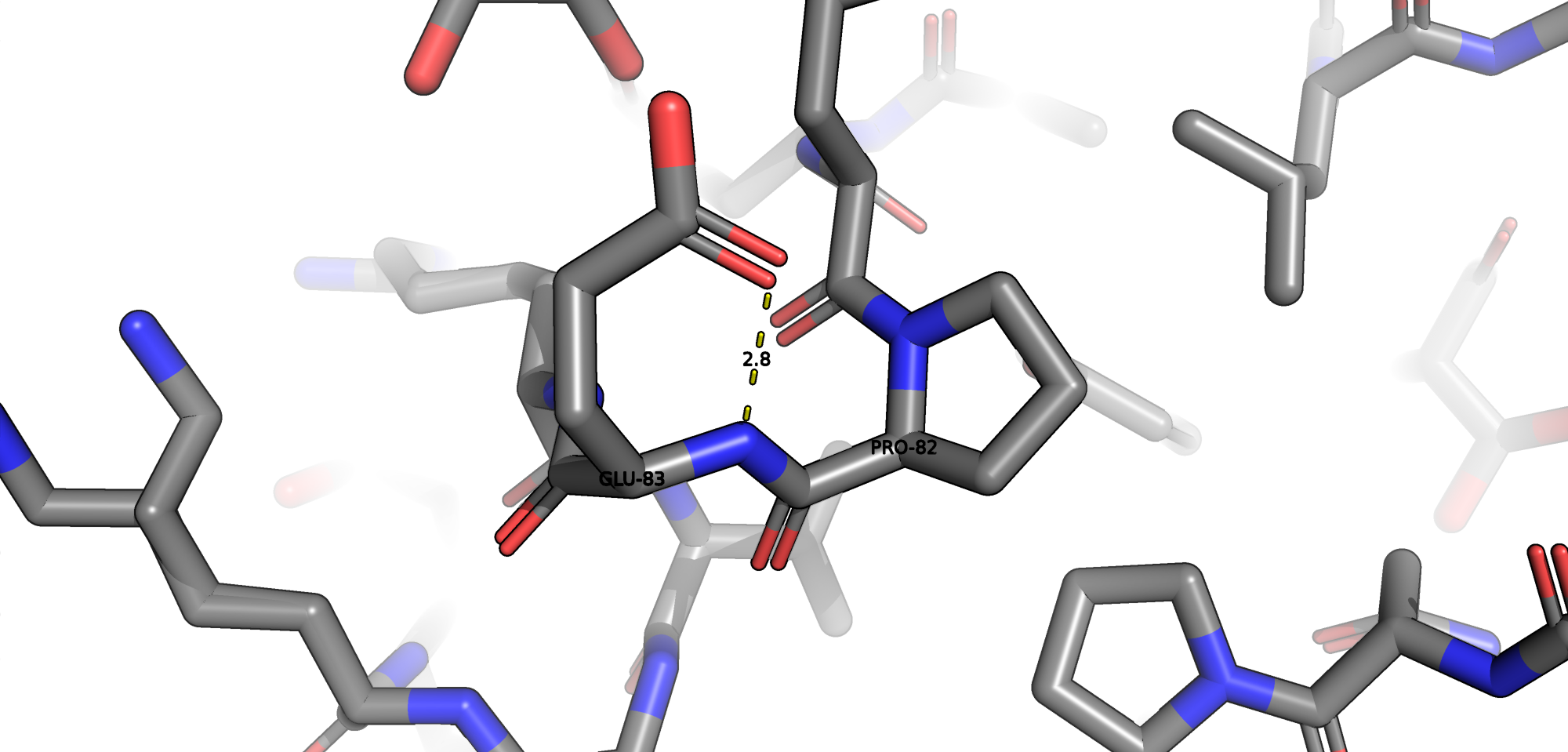
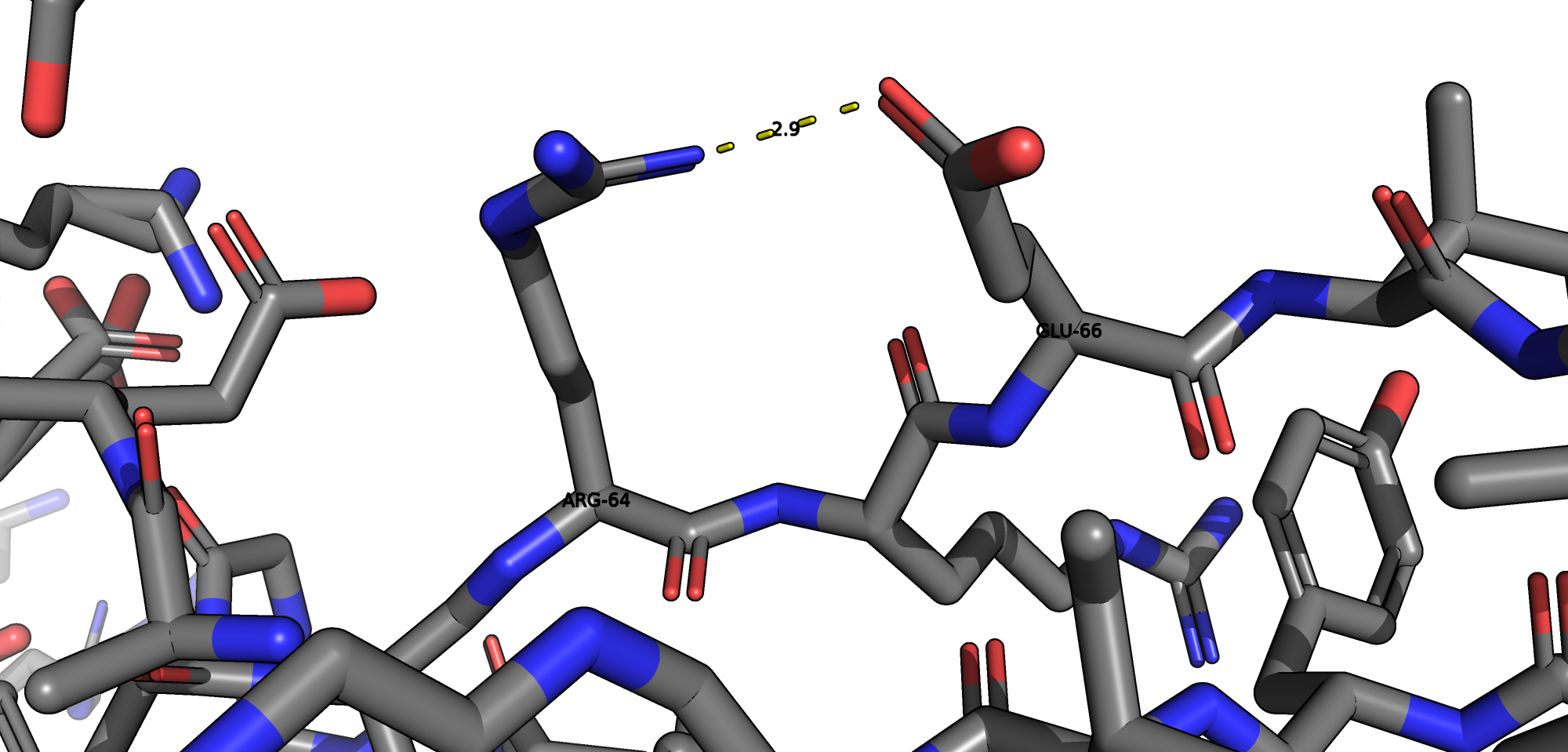
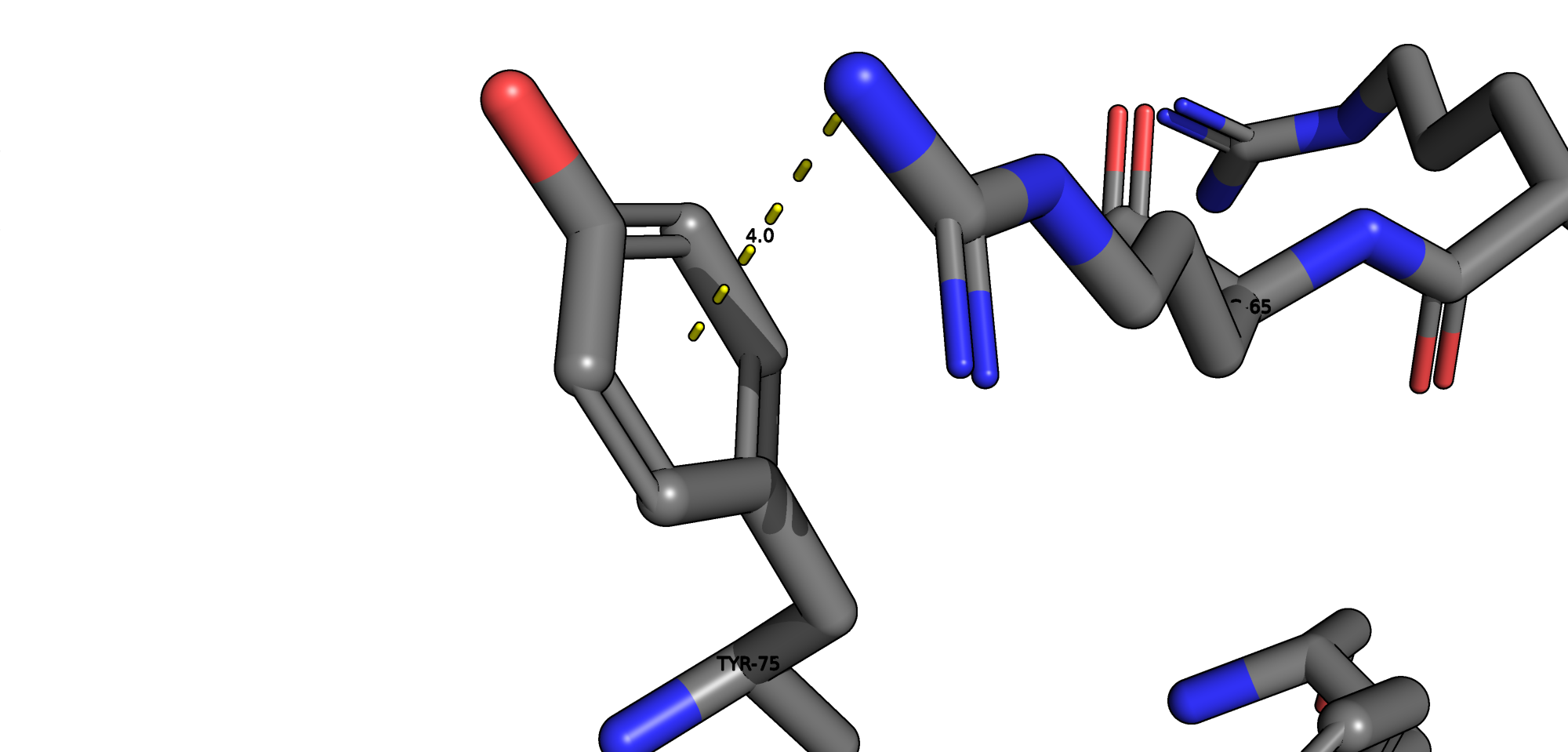
В данной структуре присутсвуют следующие типы взаимодействий: водородные связи, солевые мостики, пи-катионный стекинг. Остатков цистеина и, соответсвенно, дисульфидных мостиков в белке обнаружено не было.