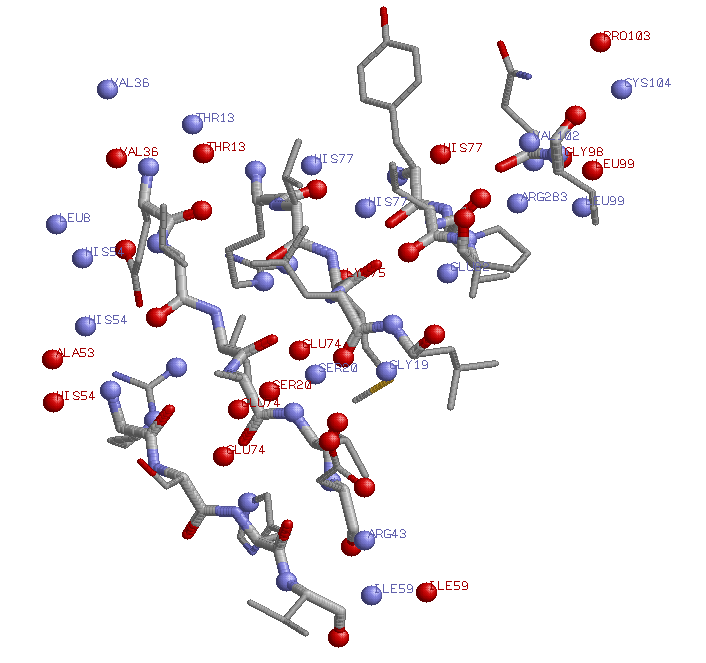
Гидрофильные контакты бета-листа и остальной части белка
Изображены атомы азота (синие) и кислорода (красные) бета-листа и остальной части белка, находящиеся не дальше 3.7 Å (критерий контакта) друг от друга
Атомы, не принадлежащие альфа-спирали, подписаны
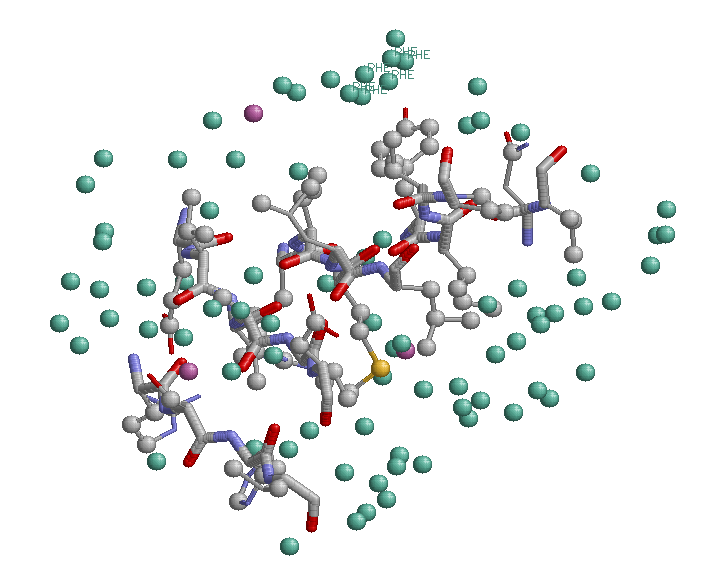
Гидрофобное взаимодействие
Изображны атомы углерода (серые) и серы (желтые) боковых остатков (бета-листа и остальной части белка), находящиеся не дальше 5.0 Å (критерий контакта) друг от друга
Атомы углерода, не принадлежащие альфа-спирали, подкрашены зеленым, а атомы серы - фиолетовым
Интересно заметить, что около 6 атомов TYR 78 распологаются 6 атомов PHE 307 (PHE подписаны на рисунке), оба аминокислотных остатка ароматические, возможно между ними возникает π стекинг, но с другой стороны, плоскости ароматических колец не паралельны, и расстояние между ними большое (порядка 5 Å)