
Согласно полю COMPND записи 1MNM банка PDB, в записи содержаться 2 цепи ДНК (обозначены как E и F) - двуцепочечный участок ДНК - STE6 оператор. В записи содержаться также 4 белковых цепей: MCM1 регулятор транскрипции (цепь A, B) и MAT ALPHA-2 репрессор транскрипции (цепи C и D).
В записи PDB цепи C и D содержат 87 а.о., хотя сам белок MAT ALPHA-2 содержит 210 а.о. В структуре представлена его часть 113-189, что ~ соответсвует его ДНК-связывающему домену (занимающему 129-191 а.о.).
Аналогично цепи A и B представляют первые 100 а.о. своего белка MCM1 .
Цепь белка D в остовной модели:

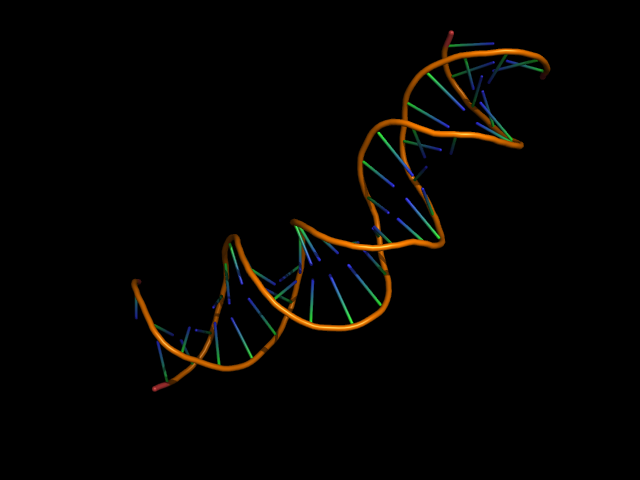
Обе цепи ДНК в остовной модели:
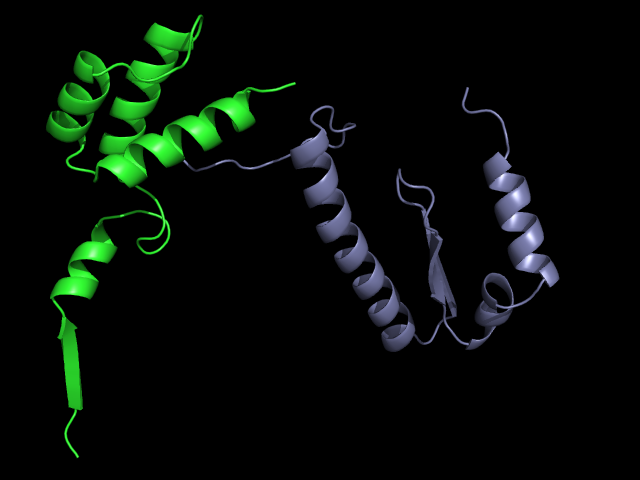
Цепь белка D (зеленая) и A в остовной модели:
Интересно заметить, что структура белка MAT Alpha-2 репрессора несколько отличается в двух его цепях (C и D): так цепь C содержит в своей структуре 3 альфа-спирали (138-152; 159-169; 173-187) и 2 бета-тяжа (115-120; 125-127), в то время как D - 4 альфа-спирали (те же + 121-128) и 1 бета-тяж (115-120). Бетя-тяжи цепи C образуют единый бета-лист с бета-тяжами цепей A и B - молекулами белка MCM1 - регулятора транскрипции. Информация о вторичной структуре, согласно записи PDB.
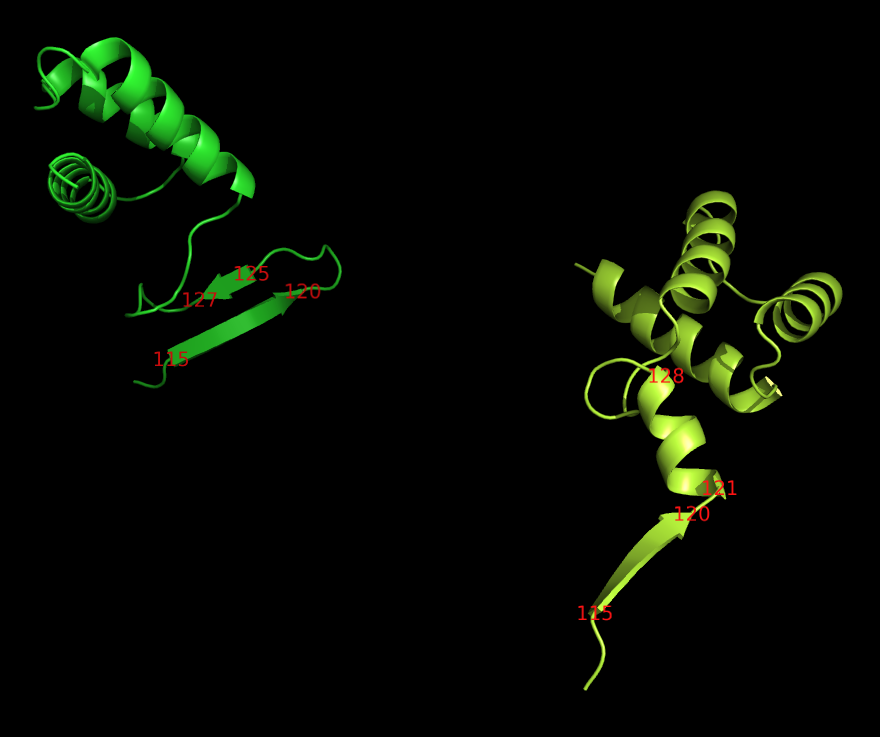
Цепь C покрашена в зеленый цвет, D - в лимонный.
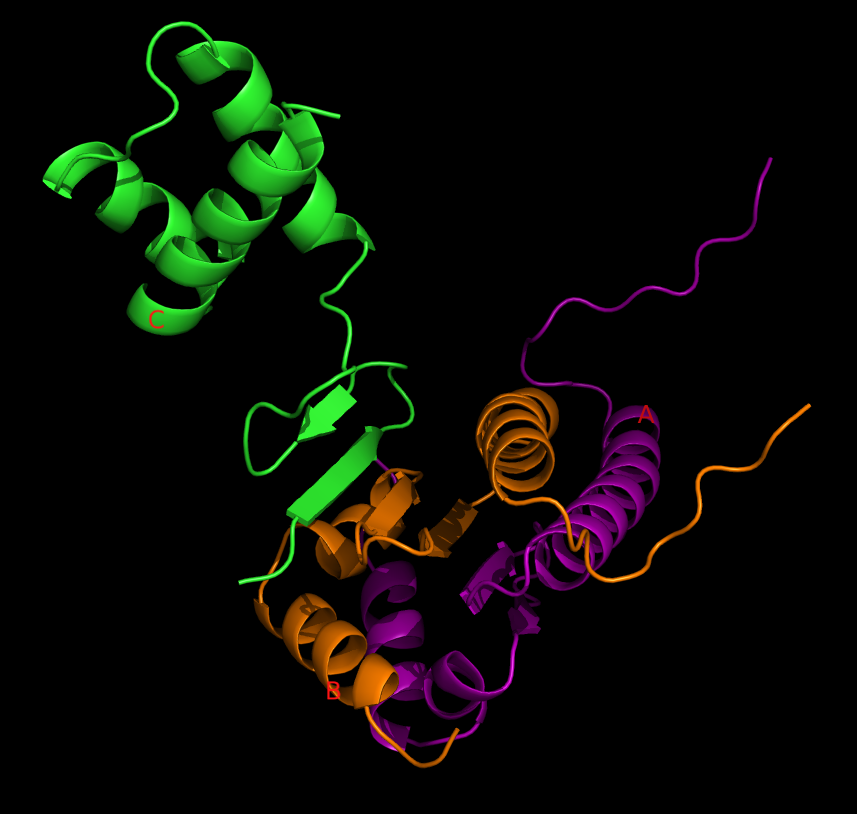
Водородные связи цепи D с другими цепями в пределах асимметрической единицы:

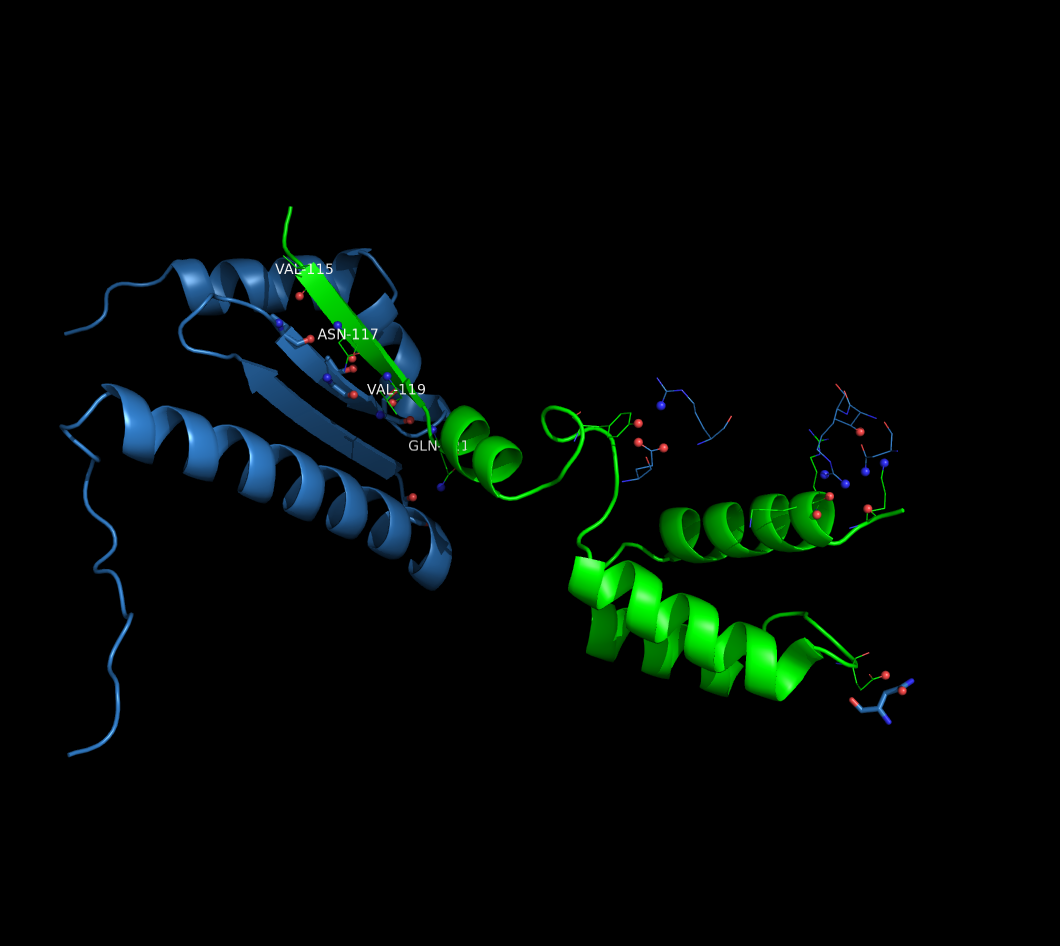
На рисунке изображены цепи белков D (зеленая), A (голубая), обе цепи ДНК.
В проволочной модели изображены аминокислотные и нуклеотидные остатки, связанные водородными связями с цепью D, и все остатки цепи D, связанные с другими цепями.
Углероды этих остатков цепи D покрашены в зеленый цвет, цепи A - в голубой, цепей ДНК - в желтый.
Сами взаимодействующие атомы азота и кислорода показаны в виде сфер.
Водородной связью считаем расположение атомов двух полярных (азот или кислород) атомов из разных цепей на расстоянии менее 3,5 Å.
Как видно из рисунка, цепь D взаимодействует с большой и малой бороздками ДНК и одновременно с цепей белка A.
В пределах асимметрической ячейки цепь D образует гидрофильные контакты как с атомами азотистых оснований ДНК, так и с атомами ее сахаро-фосфатного остова. Из других же белковых молекул - контактирует лишь с цепью A.
Водородные связи цепи D с молекулами ДНК, находящимися в той же асимметрической ячейке и в соседней:
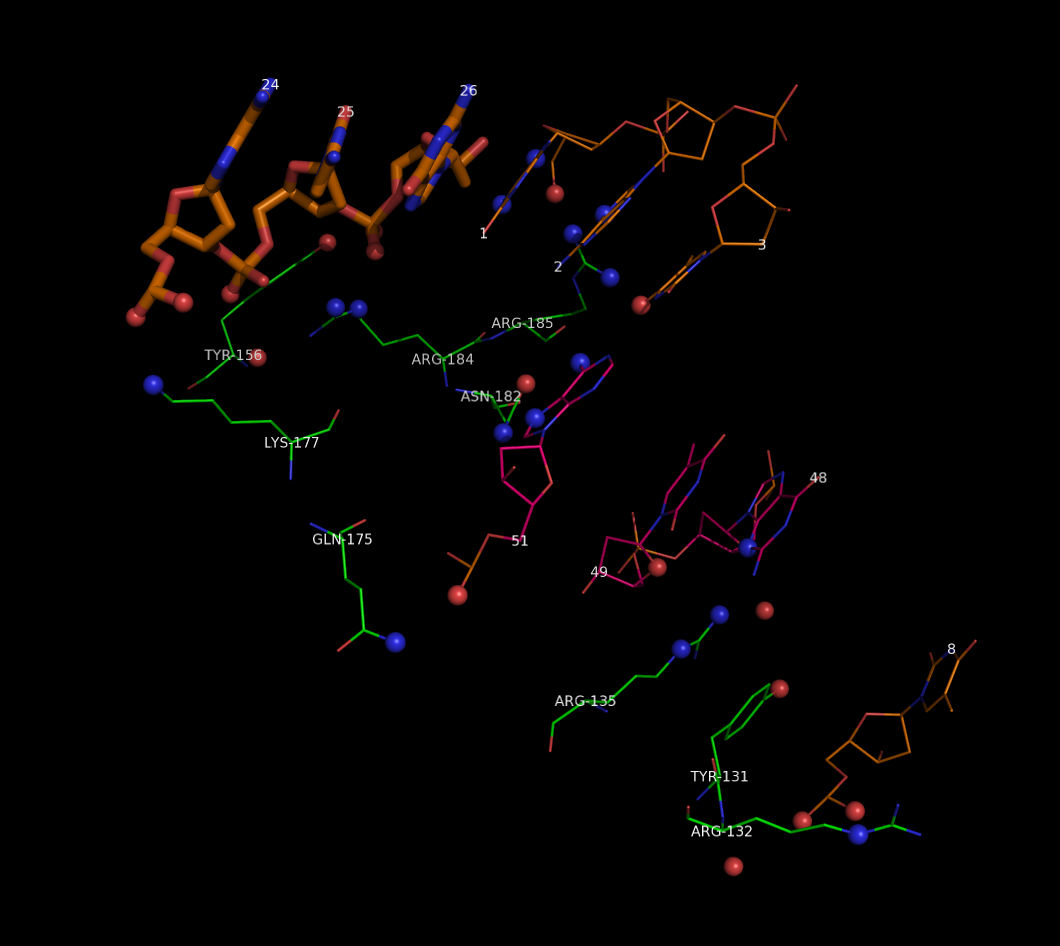
На рисунке изображены остатки цепи D, связанные водородными связями с атомами ДНК той же ячейки и соседней ячейке (нуклеотиды соседней ячейки показаны толще).
Так выглядит тоже взаимодействие, цепь D и цепи ДНК той же и соседней ячейки показаны в остовной модели:

Как видно из рисунка цепь D в кристалле контактирует еще с 3 нуклеотидами цепи E ДНК соседней ячейки. Причем контактирует не спецефически (не с атомами азотистых оснований, а с кислородами сахаро-фосфатного остова).
Водородные связи цепи D с молекулами белка, находящимися в той же асимметрической ячейке и в соседних:
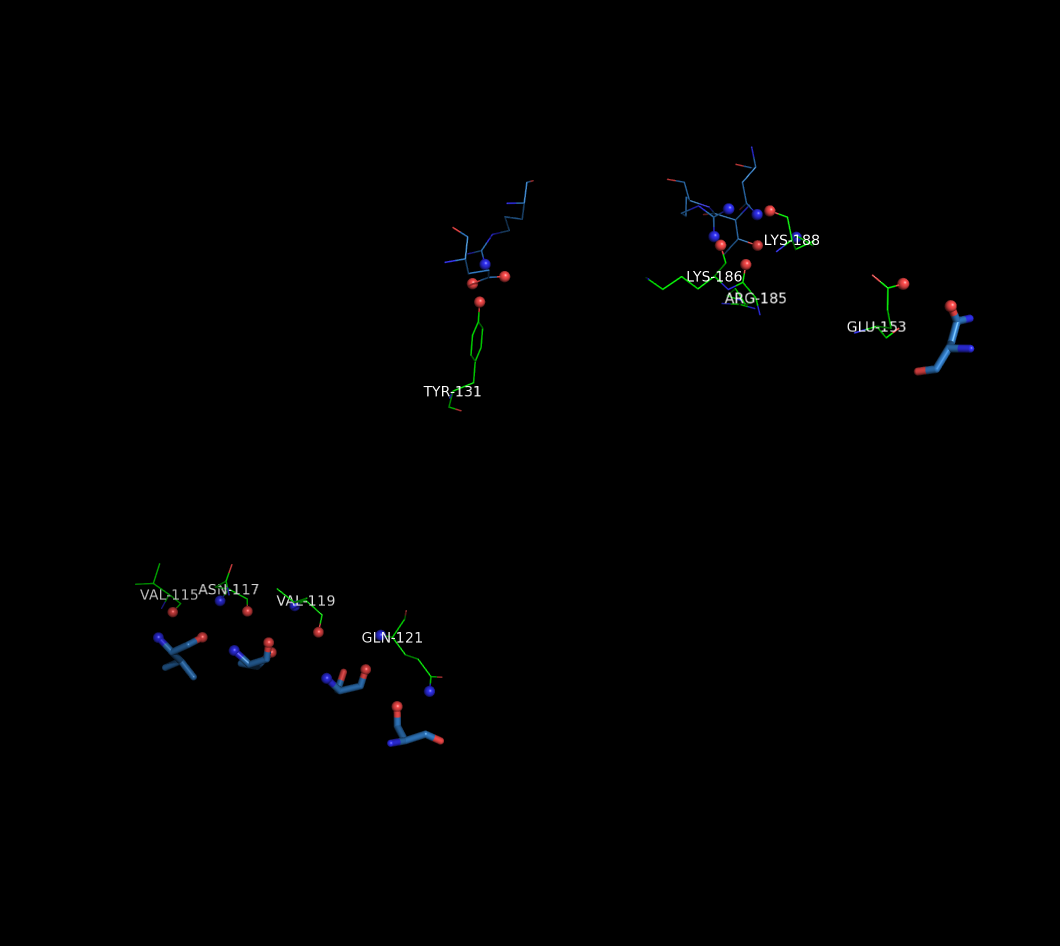
На рисунке изображены остатки цепи D, связанные водородными связями с атомами белка той же ячейки и соседних ячеек (а.о. соседних ячеек показаны толще).
Цепь D по-прежнему образует контакты только с цепью A. С цепью из одной ячейки - 1 водородную связь, с цепью A из другой ячейки совместно формирует бета-лист:
Белок MAT Alpha-2 представлен в 2 конформациях, обе из которых формируют устойчивую связь (бета-листы) с молекулами фактора транскрипции MCM1.
Возможно в клетке этот комплекс существуют в форме с С конформацией белка MAT Alpha-2, а наблюдаемое в 1MNM - артефакт (возможно из-за того, что при кристаллизации использовались большие концентрации белков, на участок ДНК село сразу 2 молекулы MAT Alpha-2, в то время как должна была сесть 1, вторая же молекула приняла наиболее выгодную конформацию и образовала связи с молекулами из соседних асимметрических ячеек).
Возможно в клетке этот комплекс выглядит совсем иначе, ведь в записи 1MNM присутствуют полипептиды, соотвесвующие лишь фрагментам реальных белков.
Согласно записи UniProt, репрессор MAT Alpha-2 может взаимодействовать также с фактором транскрипции MATA1 . Возможно при этом реализуется другая структура MAT Alpha-2. Эти белки представлены в записи 1LE8 PDB, однако цепь MAT Alpha-2 (покрашена в зеленый цвет) содержит 128-210 а.о. белка и как выглядит участок 113-127 при этом неизвестно:

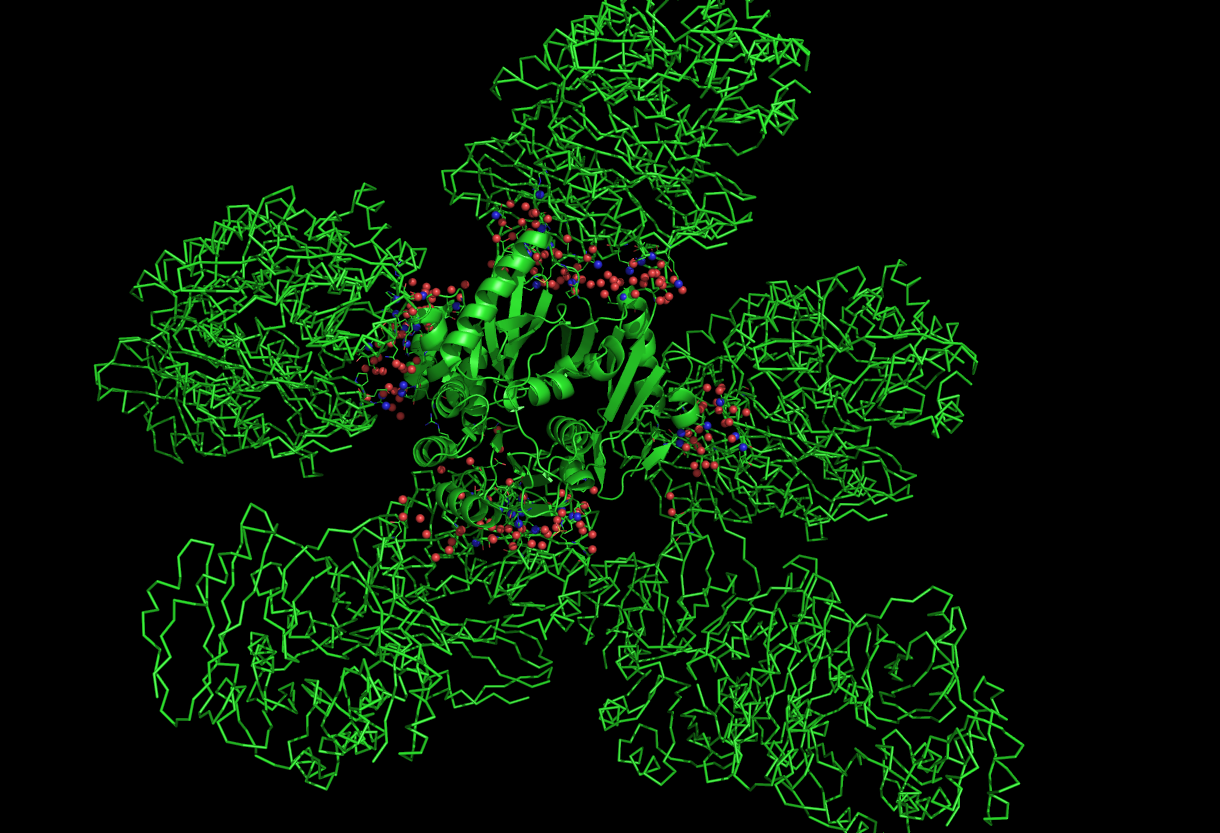
Контакты между разными образами ассиметрической единицы записи 1EYZ
Рассмотрим контакты цепи A с цепями соседних ассиметрических единиц.
Гидрофильные контакты цепи A (в модели cartoon) с с цепями соседних ассиметрических единиц (в модели ribbon):
Гидрофобные контакты:

Таким образом, цепь A образует множество гидрофильных и гидрофобных контактов с цепями других ячеек в кристалле. Возможно за счет этих взаимодействий, молекулы белка и закристаллизовались.